利用尿液蛋白质组学对阿托伐他汀进行药物一致性评价
2022-11-16赵晨阳陈昱臻付晓越侯芙芳高友鹤
赵晨阳,陈昱臻,付晓越,侯芙芳,高友鹤
(北京师范大学生命科学学院基因工程药物及生物技术北京市重点实验室,中国北京 100875)
目前,药物一致性评价采用的是化学和生物方法:化学方法是测定药物的溶出曲线等;生物方法多是对健康受试者进行药物的试用,通过空腹服药和采集静脉血进行检测,对比相关指标,得出被测药物是否具有一致性的结论。根据现有的药物一致性评价方法,我们产生了利用尿液蛋白质生物标志物进行一致性评价的设计思路。生物标志物最基本的特征是“变化”,合适的生物标志物能够更早、更灵敏地反映身体变化。血液作为常用的检测样本,有着严格的稳态调控,其中大多数变化信息会被机体的调节机制清除,仅在相当短的时间内存在。相比之下,尿液是血液滤过的产物,不受体内稳态机制的严格调节,可以容纳并积累更多、更大的变化[1],而且,尿蛋白可在较长时间内保持稳定[2],尿液蛋白质组的复杂性相对较低,更容易检测到低丰度蛋白质的变化特征[3],可见尿液是良好的生物标志物来源。不过,尿液蛋白质组易受多种因素的影响,如饮食、药物治疗、日常活动等,要使实验结果更为准确,关键是采用简单且可控制的系统。由于动物模型的遗传和环境因素可以人为控制,能够最大程度减少无关的影响因素,因此采用动物模型开展尿液生物标志物的研究是一种非常合适的实验方法。那么对于最广泛应用的他汀类降脂药,我们是否可以从尿液的角度对原研药和仿制药进行一致性评价呢?
他汀类药物是一种还原酶抑制剂,是临床上广泛使用的降血脂药物[4]。其降脂作用机制为竞争性抑制胆固醇合成的限速酶——羟甲基戊二酰辅酶A还原酶,从而降低细胞内的胆固醇水平;这一机制也可以上调患者肝细胞表面低密度蛋白质的受体表达,从而对患者体内的血脂进行调节[5]。他汀类药物还有除调脂以外的多种疗效,它的多效性在治疗动脉粥样硬化、冠心病、心房颤动、室性心律失常及抗心肌肥厚等方面发挥了重要作用[6]。本研究通过将合适剂量的两种阿托伐他汀片分别灌胃到大鼠,收集了大鼠灌胃前后的尿液并进行了非标记定量蛋白质组学分析,探究了两种药物灌胃后的蛋白质组变化并进行了比较,创新性地为药物一致性评价提供了新的评价方法。
1 材料与方法
1.1 灌胃动物模型的建立
健康SD(Sprague Dawley)雄性大鼠,体重(160±20)g,10只,购于北京维通利华实验动物技术有限公司。大鼠在标准环境[室温(22±1)℃、湿度65%~70%]中饲养3 d后开始实验,一切实验操作遵循北京师范大学生命科学学院伦理委员会的审查和批准。
采用自身前后对照的方式,将10只大鼠随机均分为A、B两组,每组5只大鼠。A组用A厂药物研磨后溶于生理盐水内进行灌胃操作,B组用B厂药物研磨后溶于生理盐水内进行灌胃操作,A、B两种药物剂型相同,剂量均为10 mg/kg[7],每日1次于同一时间灌胃,持续5 d,每天称取大鼠重量,按大鼠重量给与对应剂量的药品。
1.2 尿液样品的收集
大鼠灌胃给药处理前统一将其置于代谢笼中收集12 h的尿液,然后在标准环境下饲养3 d后进行灌胃给药,第5天灌胃给药处理后再将大鼠置于代谢笼中收集12 h的尿液。在尿液收集过程中大鼠禁食禁水,两次收集的尿液都放入-80℃冰箱保存。
1.3 尿液样品的处理
尿蛋白提取和定量:将两个时间点收集到的大鼠尿液在4℃的条件下以12 000g离心40 min,取上清液转移到新的EP管中,3倍上清体积加入预冷乙醇。均匀混合后在-20℃条件下沉淀过夜。第2天,将乙醇上清混合液于4℃条件下以12 000g离心30 min,弃上清,留蛋白质沉淀,倒扣于滤纸上,用吹风机冷风吹干。将蛋白质沉淀重悬于120 μL裂解液[8 mol/L尿素、2 mol/L硫脲、25 mmol/L二硫苏糖醇(dithiothreitol,DTT,德国Sigma公司)、50 mmol/L Tris],用枪头反复吹打,直到无沉淀为止,并于涡旋混合器完全混匀2 h。混合均匀后4℃条件下12 000g离心30 min,取上清蛋白质置于新的EP管内,用Bradford法测量蛋白质浓度。
尿蛋白酶切:取100 μg尿蛋白样品加入1.5 mL离心管中,加入25 mmol/L NH4HCO3溶液使总体积为200 μL;加入20 mmol/L DTT溶液,涡旋混匀后,金属浴(97℃)加热5 min,随后冷却至室温;加入50 mmol/L的碘乙酰胺(iodoacetamide,IAA,德国Sigma公司),涡旋混匀后,室温避光反应40 min。向10 kD超滤管(美国Pall公司)中加入200 μL UA溶液(8 mol/L尿素、0.1 mol/L Tris-HCl,pH 8.5),按照14 000g、5 min、18℃的条件离心洗涤两次;加入处理后的蛋白质样品,在14 000g、40 min、18℃条件下进行离心,再加入200 μL UA溶液,涡旋混匀,于18℃条件下14 000g离心40 min,弃下层滤过液,重复两次;加入25 mmol/L NH4HCO3溶液,涡旋混匀,在18℃条件下14 000g离心40 min,弃下层滤过液,重复两次。更换新的套管,加入100 μL 25 mmol/L的NH4HCO3溶液,以胰酶∶蛋白质为1∶50的质量比加入胰蛋白酶(Trypsin Gold,美国Promega公司)进行消化,37℃水浴过夜后收集溶有肽段的溶液[8]。最后通过HLB柱(美国Waters公司)除盐,用真空干燥仪进行抽干,于-80℃条件下保存。
1.4 液相色谱串联质谱分析
酶解后的样品加入0.1%的甲酸复溶,使用BCA试剂盒(美国Thermo Fisher Scientific公司)对肽段进行定量,将肽段稀释为0.5 μg/μL。取每个样品9 μL制备混合多肽样,按照说明书,使用高pH反相肽分离试剂盒(美国Thermo Fisher Scientific公司)进行分离。离心收集10份流出液,使用真空干燥仪抽干后用0.1%甲酸复溶。以样品∶iRT(indexed retention time,英国BioGnosis公司)为10∶1的体积比例加入iRT。每个样品(单个实验样品和10个流出液)取1 μg使用EASY-nLC1200色谱系统(美国Thermo Fisher Scientific公司)和Orbitrap Fusion Lumos Tribrid质谱仪(美国Thermo Fisher Scientific公司)进行质谱分析并采集数据。
1.5 数据处理
十个流出液的raw文件通过PD(Proteome Discoverer 2.1,美国Thermo Fisher Scientific公司)软件进行分析,分析结果用于建立DIA(data independent acquisition)采集方法。新建立的DIA方法用于进行单个实验样品的DIA模式采集。采集结束后使用Spectronaut(英国BiogGnosis公司)对质谱数据进行处理和分析。导入每个样本DIA采集的raw文件进行搜库。采用二级肽段所有碎片离子峰面积进行蛋白质定量。
1.6 数据分析
采取自身对照的方式,将灌胃前后鉴定到的蛋白质进行比较,筛选差异蛋白质。差异蛋白质筛选条件为:组间变化倍数(fold change)≥1.50或≤0.67,配对t检验分析的P校正值<0.05。对筛选到的差异蛋白质使用UniProt网站(https://www.uniprot.org/;2022-03-03)和DAVID数据库(https://david.ncifcrf.gov/;2022-03-03)进行生物学分析,并在PubMed数据库(https://pubmed.ncbi.nlm.nih.gov/;2022-03-03)上对已报道文献进行检索。
2 结果与分析
2.1 实验动物的行为学分析
在造模前后对A、B两组大鼠进行行为学观察,观察结果显示,两组大鼠活动正常,饮食饮水均正常,且两组大鼠之间无明显的行为学差异。同时,在灌胃给药处理前及给药处理的5 d时间里,两组大鼠体重均持续增加(图1),生长状况正常。
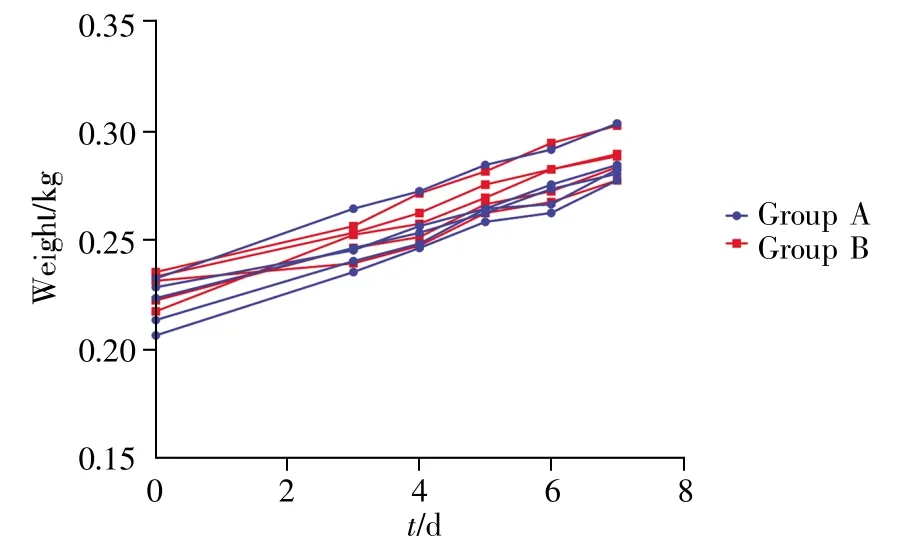
图1 A、B组大鼠体重变化Fig.1 Weight changes of rats in groups A and B
2.2 尿液蛋白质组变化分析
2.2.1 尿液蛋白质鉴定情况
在灌胃给药处理后,对所收集到的两组大鼠共20个尿液蛋白质样品(灌胃前后)进行液相色谱串联质谱(liquid chromatography coupled with tandem mass spectrometry,LC-MS/MS)分析。总共鉴定到1 261个蛋白质,其中特异性多肽≥2个,蛋白质水平错误发现率(false discovery rate,FDR)<1%。A、B两组大鼠灌胃前后尿液样本的比较结果表明,相对于灌胃给药前,灌胃给A药后鉴定到116个差异蛋白质,灌胃给B药后鉴定到66个差异蛋白质,差异蛋白质的详细信息列于表1(A组)和表2(B组)。用韦恩图展示A、B两种药物灌胃处理后鉴定到的差异蛋白质的重叠情况,发现有24个蛋白质在两组大鼠中均被鉴定到(图2)。同时,我们对总蛋白质进行了偏最小二乘法判别分析(partial least squares-discriminant analysis,PLSDA),结果如图3所示,橙色区域和蓝色区域分别代表灌胃B药物和A药物的样本情况,灰色区域是灌胃前的样本情况。从图中可知,药物灌胃带来的差异是十分明显的,且这两种药物的区别不大。
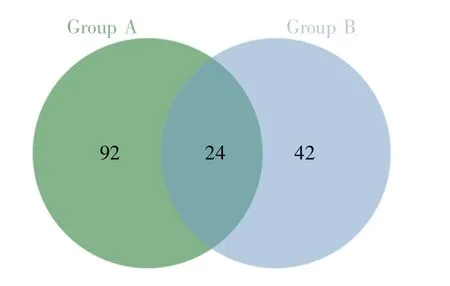
图2 A、B两组大鼠灌胃给药处理鉴定到的差异蛋白质的韦恩图Fig.2 The Venn diagram of differential proteins identified in urine samples of rats treated with intragastric drug administration in groups A and B

图3 鉴定到的总蛋白质偏最小二乘法判别分析结果Fig.3 Partial least squares-discriminant analysis of the identified urine proteins
2.2.2 灌胃A组大鼠差异蛋白质的功能分析
使用DAVID数据库(https://david.ncifcrf.gov/)对灌胃A组大鼠鉴定到的差异蛋白质从生物学过程、细胞成分和分子功能3个方面进行功能富集分析(图 4,https://www.bioinformatics.com.cn)。从图中可以看出,这些差异蛋白质主要参与了细胞黏附、底物黏附依赖性细胞扩散、内肽酶活性的负调控、肽基酪氨酸磷酸化的正向调控、细胞迁移、蛋白质水解等生物学过程。在细胞成分上,这些差异蛋白质大多来自胞外和细胞质膜外,而在分子功能中,我们发现这些差异蛋白质大多具有整合素结合、水解酶活性、丝氨酸型内肽酶抑制剂的活性、胰岛素样生长因子结合等功能。
2.2.3 灌胃B组大鼠差异蛋白质的功能分析
同上,我们通过功能分析发现,灌胃B组大鼠鉴定到的差异蛋白质主要参与了蛋白质水解、肝细胞生长因子刺激的细胞反应、免疫反应、半胱氨酸代谢、甲状腺激素刺激的细胞反应、谷胱甘肽代谢等生物学过程(图5,https://www.bioinformatics.com.cn)。在细胞成分上,这些差异蛋白质仍旧是源于胞外区、分泌体;在分子功能中,差异蛋白质主要具有肽酶活性、羧肽酶活性、水解酶活性、肽链内切酶抑制剂活性、谷氨酰半胱氨酸连接酶活性等功能(图 5)。
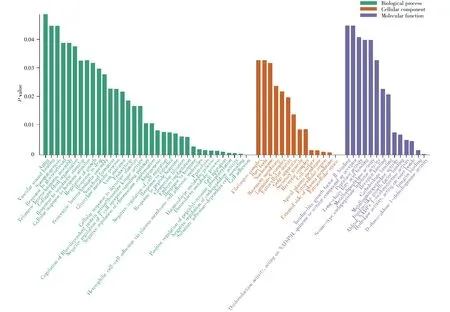
图4 A组灌胃大鼠差异蛋白质功能分析Fig.4 Functional analysis of differential proteins in group A
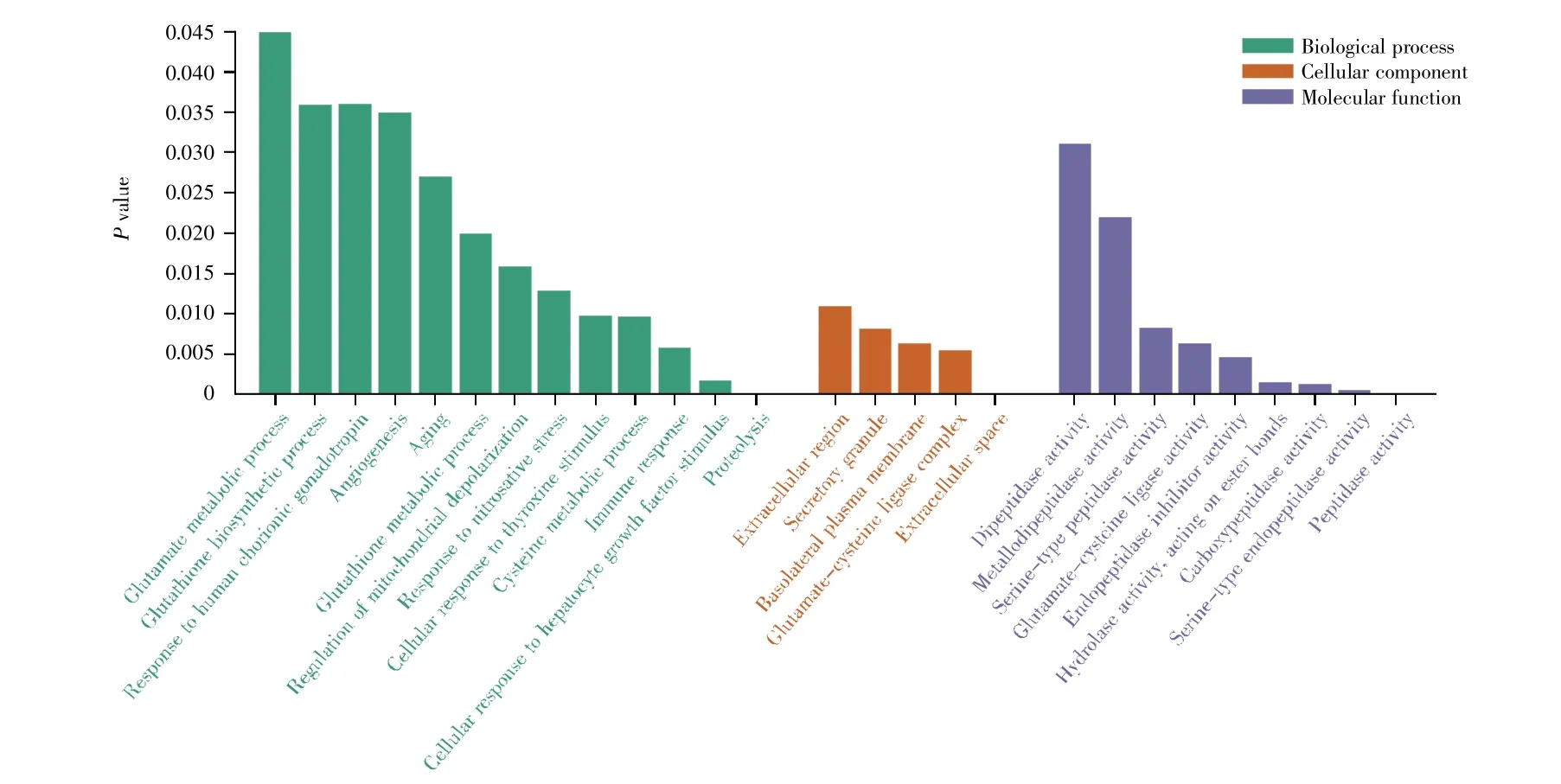
图5 B组灌胃大鼠差异蛋白质功能分析Fig.5 Functional analysis of differential proteins in group B
3 讨论
本研究使用源于两种药厂的阿托伐他汀片分别建立了大鼠灌胃模型,通过对灌胃前后收集的尿液进行非标记LC-MS/MS鉴定和分析,探究不同药厂所制药物对大鼠尿蛋白的影响。统计分析结果显示,将灌胃后的尿液和灌胃前的尿液进行对比,在A组灌胃模型中共鉴定到116个差异蛋白质(表1),在B组灌胃模型中共鉴定到66个差异蛋白质(表2),其中有24个蛋白质在两组中都被鉴定到(图 2)。
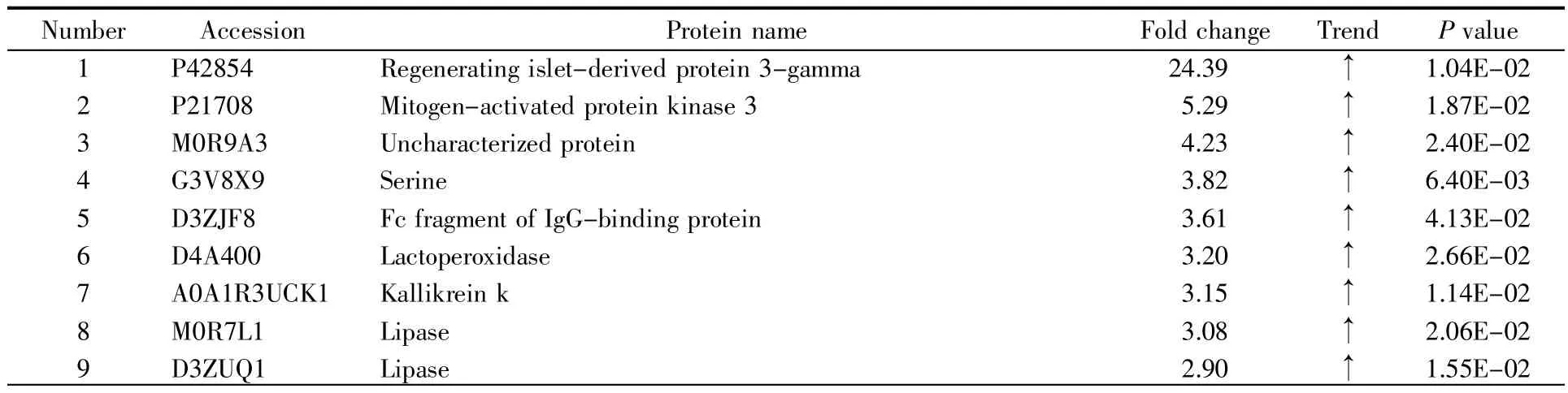
表1 A组鉴定到的尿液差异蛋白质Table 1 The differential proteins identified in group A
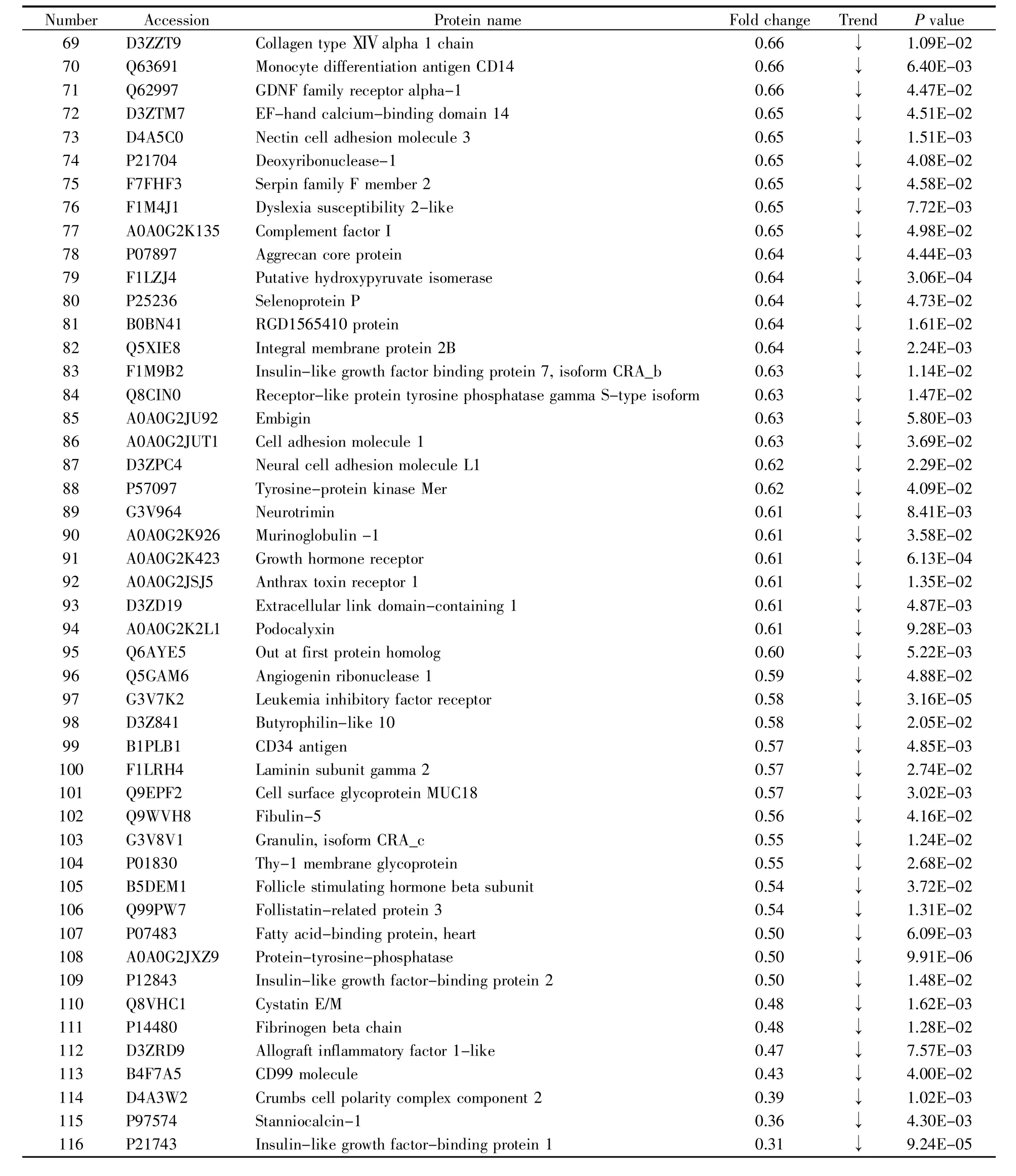
表1 (续)

表1 (续)

表2 B组鉴定到的尿液差异蛋白质Table 2 The differential proteins identified in group B
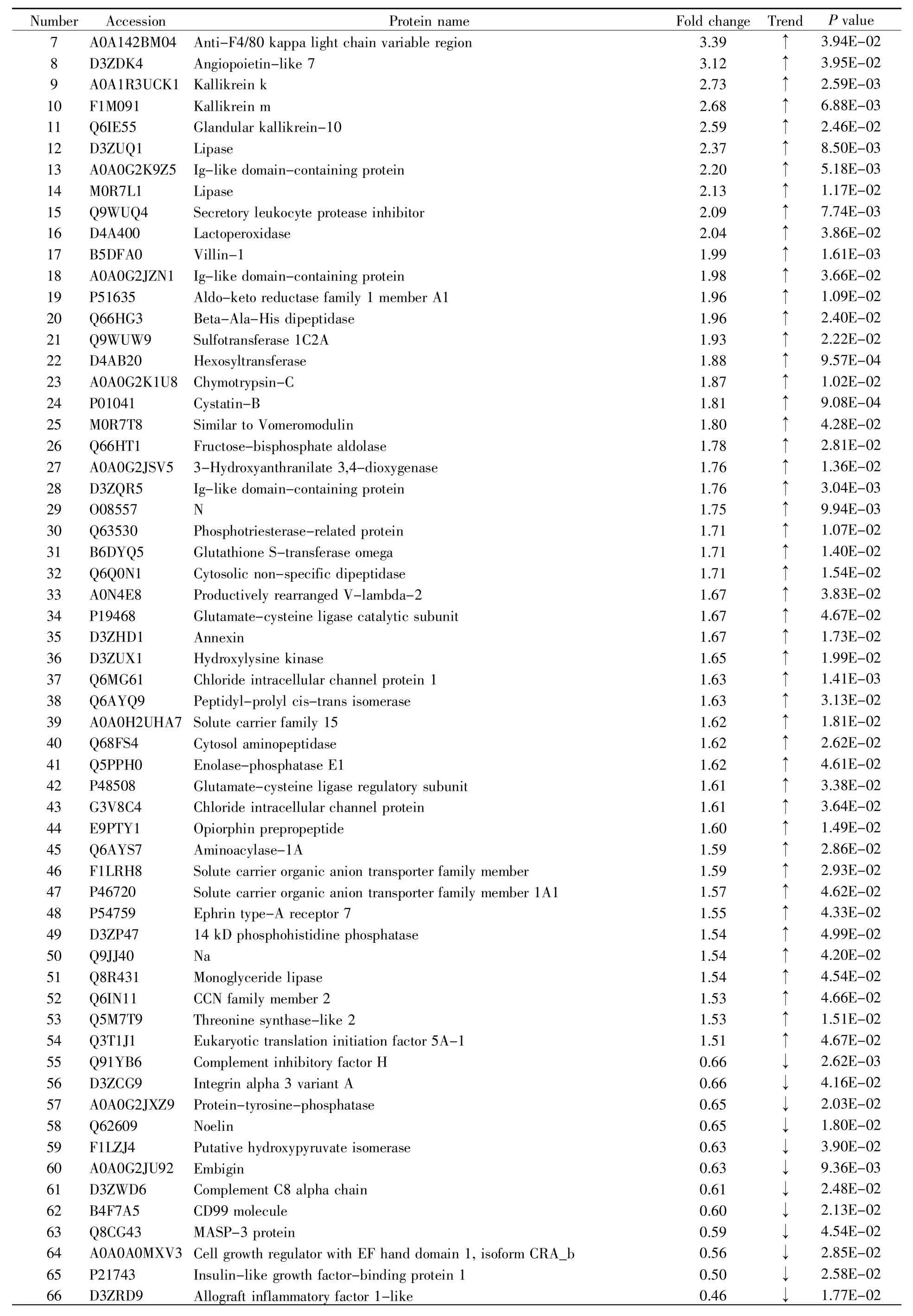
表2 (续)
根据偏最小二乘法判别分析结果我们可以发现,尿蛋白可以显示出阿托伐他汀对机体的显著影响,而不同厂家的成分、剂型、剂量一致的药物对机体产生的差异影响也能被观测到,这说明我们能从尿蛋白中看到很细致的变化。从差异蛋白质的生物学功能分析结果上看,我们不能很明显地区分出这些影响源自于药物的药理作用还是毒理作用,首先我们没有观察到和降脂有显著关系的生物学通路,其次如果有他汀类药物副作用的话,我们可能会看到和平滑肌细胞迁移、血小板黏附下调相关的生物学通路[9],而这些在本研究中并没有观测到。从目前的研究阶段来看,可能是因为剂量的问题让我们没有看到显著的药理或毒理作用,但在本研究中,即使是很小的剂量,我们依旧可以通过尿液观测到机体受到的影响,这充分说明了尿液的灵敏性,以及其用于药物一致性评价的巨大潜力。
4 结论
通过建立阿托伐他汀大鼠灌胃模型,我们能从尿液上显著区分药物带来的影响;针对产自不同药厂的阿托伐他汀片,尿蛋白甚至可以检测到两种药物之间细致的差别,这充分验证了尿液的灵敏性,同时提示尿液蛋白质组学在药物一致性评价上有很大潜力。