奥利司他干预对高脂饮食大鼠肠道微生物的影响
2022-11-16汪洁仪郭佳婧钱玉娇李高阳付复华单杨
汪洁仪,郭佳婧,钱玉娇,李高阳,付复华,单杨*
奥利司他干预对高脂饮食大鼠肠道微生物的影响
汪洁仪1,2,3,4,郭佳婧2,3,4,钱玉娇1,2,3,4,李高阳1,2,3,4,付复华1,2,3,4,单杨1,2,3,4*
(1.湖南大学研究生院隆平分院,湖南 长沙 410125;2.湖南省农业科学院农产品加工研究所,湖南 长沙 410125;3.果蔬贮藏加工与质量安全湖南省重点实验室,湖南 长沙 410125;4.果蔬贮藏加工与质量安全国际联合实验室,湖南 长沙 410125)
将大鼠随机分为正常组(10只)与造模组(高脂饮食组,20只),连续喂养10周后造模成功;再将造模组随机分为模型组(10只)和奥利司他组(10只),正常组、模型组和奥利司他组分别给予正常饮食、高脂饮食、高脂饮食+奥利司他灌胃,再持续饲喂10周后采集样品进行血清生化指标检测、组织病理学观察和肠道菌群分析,以探究奥利司他对高脂饮食诱导肥胖大鼠的影响。结果表明:奥利司他干预可显著降低高脂饮食大鼠的体质量;降低长期高脂饮食所引起的肝脏脂质堆积,减少肝损伤及体内脂肪的堆积;降低高脂饮食大鼠的血清总胆固醇和低密度脂蛋白胆固醇水平,升高高密度脂蛋白胆固醇水平,改善肥胖大鼠的血脂代谢异常问题;升高肥胖大鼠血清中脂联素水平,同时降低血清瘦素以及游离脂肪酸水平;奥利司他干预会造成大鼠小肠和盲肠菌群丰度和多样性的减少,增加大鼠结肠内微生物群落的物种多样性;奥利司他干预降低了高脂饮食大鼠结肠中厚壁菌门与拟杆菌门相对丰度的比值,在小肠和盲肠中则提高了该比值;高脂饮食后大鼠盲肠中螺旋体门和疣微菌门的相对丰度显著高于正常组的,但奥利司他治疗后螺旋体门的相对丰度较模型组有所降低;奥利司他促进高脂饮食大鼠小肠中的乳杆菌属()和罗姆布茨菌属(),盲肠中的阿克曼菌属()和布劳特氏菌属(),结肠中的布劳特氏菌属、毛形杆菌属()和罗斯伯里氏菌属()等肠道有益菌的生长,并抑制小肠中链球菌属()等有害菌的繁殖。可见,奥利司他干预可有效地改善因高脂饮食引起的肥胖及其代谢紊乱,并可改善因高脂饮食造成的肠道菌群结构失调。
大鼠;奥利司他;高脂饮食;减肥;肠道菌群
随着社会的高速发展,人们的饮食习惯和结构也发生了很大的改变,人们更多、更频繁地摄入肉类、奶油和油炸食品等高脂食品。长期过量摄入高脂食品已成为肥胖及非酒精性脂肪肝、高脂血症和糖尿病等代谢性慢性病症高发的重要原因[1–2]。肠道微生物种类众多,数目庞大,且与能量代谢、免疫调节等生理活动密切相关[3]。
围绕肠道微生物参与和影响代谢相关疾病的病理和生理学的研究[4]表明,肠道微生物(如种类、结构等)的变化与宿主能量代谢及代谢性慢性病症密切相关。也有学者[5]提出“肠道微生物群–脂肪组织”轴在减肥作用中起着至关重要的作用。通过调节肠道微生物,可影响肠道屏障功能,间接参与宿主机体的营养吸收和调节机体的能量代谢,进而减轻肥胖及高脂血症等代谢性慢性病症的发生[6–8]。
奥利司他作为一种特异性脂肪酸合成酶抑制剂,能高效降低机体对脂质的吸收,抑制脂肪的合成,进而有效调节机体能量代谢[9]。此外,奥利司他还具有安全性高、可长期服用的特点[10]。已有研究显示,高脂饮食诱导肥胖的小鼠服用奥利司他后可使总肠道微生物相对丰度降低和细菌相对丰度明显上调[11],增加肠道内双歧杆菌的相对丰度[12]。此外,MORALES等[13]研究了高脂肪膳食条件下给药奥利司他后对结肠的影响,结果显示,健康志愿者的结肠微生物群没有显著变化。奥利司他与肥胖、代谢性慢性病症和肠道微生物之间的关系仍需进一步的探讨。鉴于饮食–肠道微生物–机体生理活动之间的关系,本研究中,拟建立高脂肥胖大鼠模型,探讨奥利司他与肥胖、代谢性慢性病症和肠道微生物之间的关系,进一步研究奥利司他对高脂饮食大鼠不同肠段肠道微生物的影响,旨在为奥利司他调控脂质吸收和肠道菌群的应用提供依据。
1 材料与方法
1.1 材料与仪器
供试动物为雄性SD大鼠(SPF级)30只,体质量(125±10) g,由湖南斯莱克景达实验动物有限公司提供。实验动物生产许可证号为SCXK(湘)2019– 0004,伦理审查编号为IACUC–2019022。基础饲料主要成分包括淀粉、豆油、纤维素等,购自湖南斯莱克景达实验动物有限公司;高脂饲料成分为蔗糖20.0%、猪油15%、胆固醇1.2%、胆酸钠0.2%、基础饲料63.6%,购自江苏美迪森生物医药有限公司。
奥利司他,山东新时代药业有限公司产品,生产批号200513;总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL–C)、高密度脂蛋白胆固醇(HDL–C)测试盒购于湖南德荣医疗健康产业有限公司;瘦素(LEP)、脂联素(ADP)、游离脂肪酸(FFA)和Elisa试剂盒购于江苏晶美生物科技有限公司;NEXTFLEX Rapid DNA–Seq Kit建库试剂盒购于Bioo Scientific;MiSeq Reagent Kit v3测序试剂盒购于Illumina。
DF50 Vet型五分类血液分析仪为深圳市帝迈生物技术有限公司产品;FAITH–1000型全自动生化分析仪为南京劳拉电子有限公司产品、JT–12J型组织脱水机为武汉俊杰电子有限公司产品;JB–L6石蜡包埋机为武汉俊杰电子有限公司产品;Illumina Miseq型测序仪为Illumina产品。
1.2 方法
1.2.1奥利司他溶液的制备
临用前配置0.5%的羧甲基纤维素钠(CMC–Na)溶液,用CMC–Na溶液制备奥利司他悬浮灌胃液。
1.2.2大鼠肥胖模型的建立
大鼠饲养于SPF级清洁环境中,在可控制的光照(12 h明暗循环) 条件下,将大鼠安置在带有网状不锈钢盖的塑料底笼中,室温控制在21~24 ℃,相对湿度50%~80%,自由采食、饮水。经过适应性喂养阶段(3 d)后随机分为正常组(10只)与造模组(20只)。正常组每日喂食基础饲料,造模组(高脂饮食组)用高脂饲料进行饲喂。每周称量大鼠体质量1次。连续喂养10周后,造模组体质量与正常组体质量的差异有统计学意义,此时视为造模成功。将造模组随机分为模型组(10只)和奥利司他组(10只)。正常组继续喂普通饲料;模型组继续给予高脂饲料,并按照大鼠体质量每100 g灌胃1 mL 0.5%的CMC–Na溶液;奥利司他组继续给予高脂饲料,并按32.4 mg/kg灌胃奥利司他悬浮灌胃液。试验再持续进行10周。
1.2.3样品采集及指标检测和观察
末次灌胃24 h后,将大鼠麻醉,在超净工作台上对各组大鼠进行股动脉血液样本收集,低温离心后将血清于–20 ℃冻存。采用试剂盒并按照使用说明步骤测定样品中FFA、TC、TG、HDL–C、LDL–C、LEP和ADP的含量。解剖后,收集肝脏、肠、腹股沟皮下脂肪组织,并固定于4%多聚甲醛溶液中;收集小肠、盲肠和结肠内容物,液氮猝灭后,贮存于–80 ℃冰箱。每组每项肠内容物样品数为6个。取多聚甲醛固定的脂肪和肝组织,修剪后采用乙醇将其逐级脱水,石蜡包埋后制成3 μm切片,HE染色,光学显微镜下观察各组脂肪组织、肝组织的形态及病理变化。
运用高通量测序技术,在Illumina MiSeq/ NovaSeq平台对大鼠的小肠、盲肠和结肠内容物中菌群进行16S rDNA V3–V4区域测序分析。测序结果基于Majorbio云平台(www.majorbio.com)的免费在线平台进行分析。利用UPARSE(version 7.1)并根据97%的相似性标准对序列进行聚类分析(OTU)。α–多样性分析采用Simpson、Shannon、chao和Ace指数对群落丰富度和多样性进行评价。β–多样性则采用主坐标分析法(PCoA)分析肠道微生物多样性及其在OUT水平的变化。基于测序结果,利用R语言(version 3.3.1)工具作图,分析不同分组(或样本)在各分类水平(门、属、OTU等)上的优势物种组成情况。
1.3 数据统计方法
试验数据运用SPSS 16.0进行单因素方差分析(One–Way ANOVA);方差齐时采用LSD法,方差不齐时采用Dunnett’s T3法进行组间均数两两比较。
2 结果与分析
2.1 供试大鼠体质量的变化
造模成功后记为0周,连续饲喂10周大鼠体质量的变化如图1所示。在0周时,模型组相比于正常组体质量极显著(<0.01)升高,说明成功获得高脂饮食诱导肥胖模型。连续灌胃奥利司他10周后,奥利司他组的体质量显著(<0.05)低于模型组的,说明奥利司他具有良好的减肥效果。
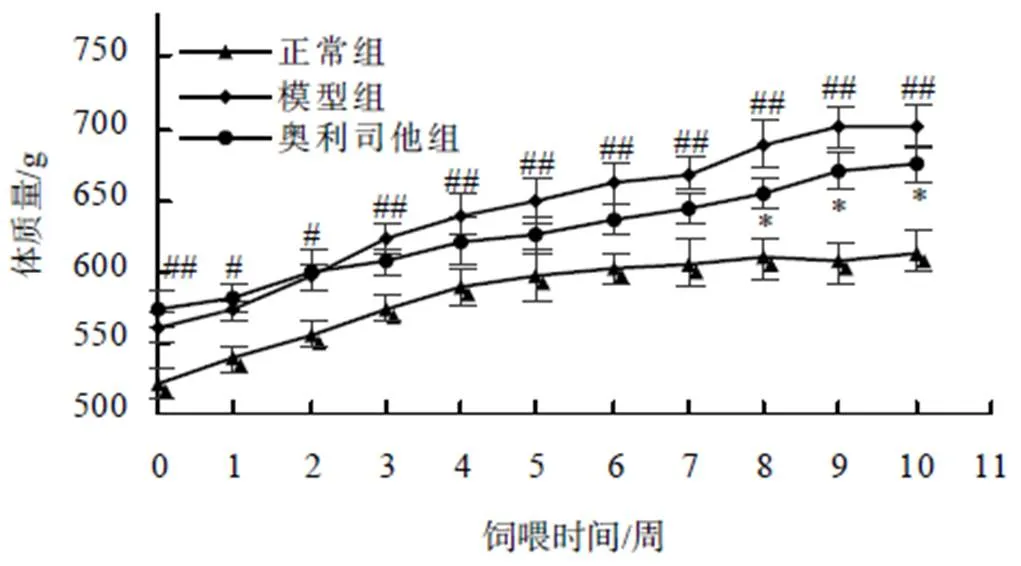
“#”“##”示模型组与正常组比较差异有统计学意义(P<0.05、P<0.01);“*”示奥利司他组与模型组比较差异有统计学意义(P<0.05)。
2.2 奥利司他对供试大鼠血清生化指标的影响
从表1可知,与正常组比较,长期高脂饮食喂养可极显著(<0.01)提高大鼠血清TC和LDL–C水平,显著提高大鼠血清TG水平(<0.05);与模型组比较,奥利司他干预可不同程度降低大鼠血清TC和LDL–C水平,提高HDL–C水平。此外,奥利司他组大鼠血清的LEP质量浓度低于模型组和正常组的,ADP质量浓度高于模型组和正常组的。与正常饮食相比,大鼠经过高脂饮食喂养后,血清中FFA的质量浓度显著升高,但在奥利司他灌胃后出现降低,奥利司他组的FFA质量浓度与正常组间的差异无统计学意义(>0.05)。可见,长期的高脂饮食会导致大鼠血脂代谢异常,而奥利司他干预可不同程度改善高脂饮食引起的大鼠血脂代谢异常问题。

表1 连续灌胃奥利司他10周后大鼠的血清生化指标
“#”“##”示与对照组比较差异有统计学意义(<0.05、<0.01)。
2.3 奥利司他对高脂饮食大鼠肝组织和脂肪组织病理形态的影响
从图2可知,正常组肝组织结构完整,肝细胞索无变性、坏死,排列有序,肝窦未见淤血等情况;高脂饮食模型组肝细胞有明显肿大,空泡变性严重;奥利司他组肝脏肝细胞肿胀,偶见空泡变性。在相同大小的视野内,正常组脂肪细胞数为4个,大小为100 μm左右;模型组脂肪细胞数只有1个,脂肪细胞大小约为256.59 μm;奥利司他组脂肪细胞数为4个,脂肪细胞大小为110 μm左右。可见,奥利司他干预可降低因长期高脂饮食所引起的脂质在肝脏堆积,减少肝损伤,也可减轻高脂饮食下体内脂肪的堆积。
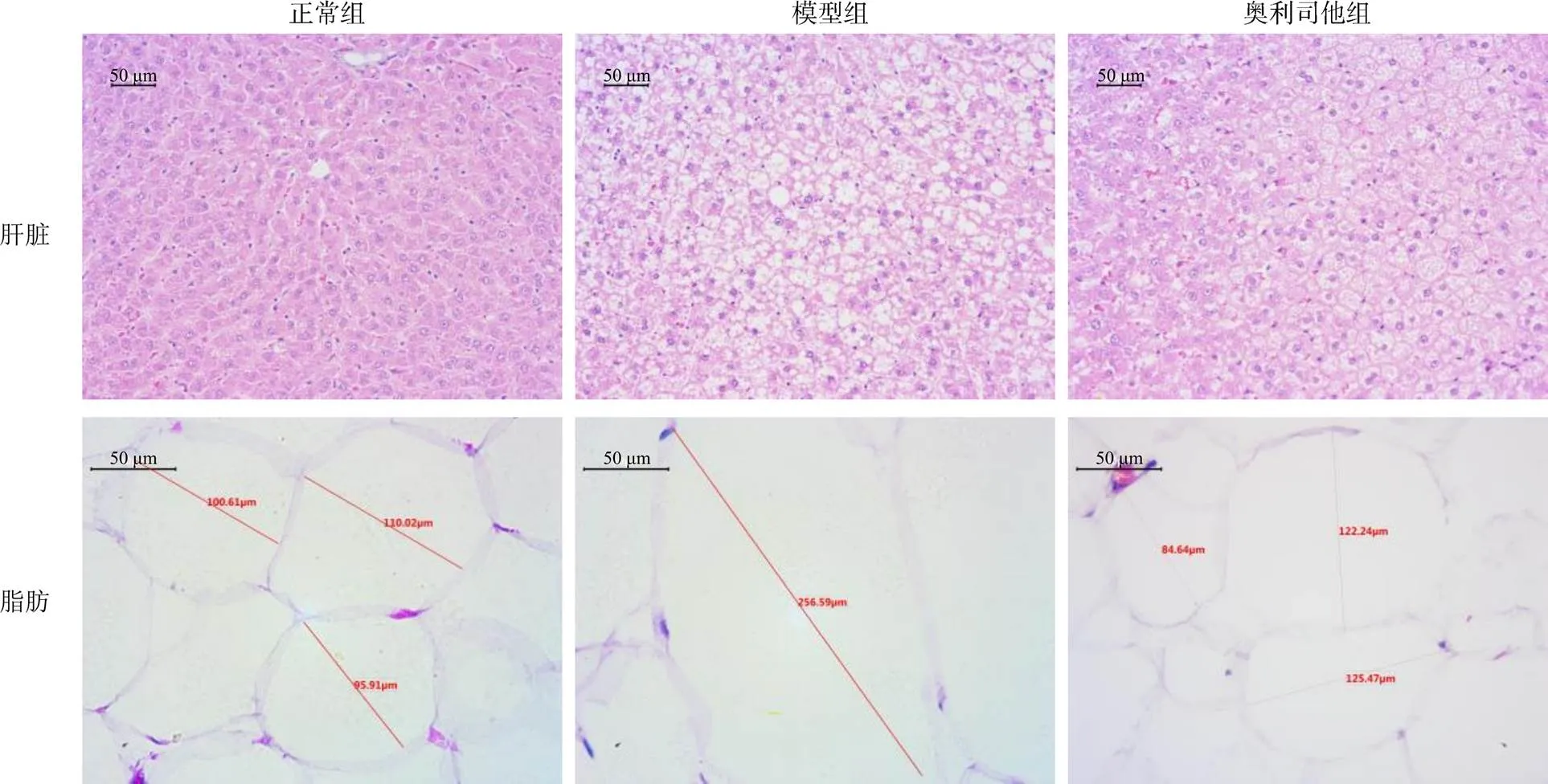
图2 连续灌胃奥利司他10周后大鼠的肝脏和脂肪组织切片
2.4 奥利司他对高脂饮食大鼠不同肠段肠道微生物的影响
2.4.1奥利司他对高脂饮食大鼠不同肠段菌群多样性的影响
从表2可知,除了奥利司他大鼠的结肠内容物外,模型组和奥利司他组大鼠的各肠段中Ace和Chao指数均低于正常组的,而奥利司他组大鼠结肠内容物中Ace和Chao指数均高于模型组;模型组结肠肠道菌群的Shannon指数显著低于正常组的,而Simpson指数显著高于正常组的,奥利司他干预后,结肠肠道微生物Shannon、chao和Ace指数均升高。说明奥利司他组小肠和盲肠内的菌群多样性较模型组少,而在结肠段奥利司他组的菌群多样性超过了模型组。由表2和图3可以看出,随着消化过程的推进,奥利司他组小肠、盲肠、结肠内的Shannon,Ace和Chao指数均逐渐升高,Simpson指数逐渐降低,物种OUT数逐渐增多,表明物种多样性逐渐升高;而模型组大鼠在小肠、盲肠、结肠内的物种多样性变化不大。可见,奥利司他的干预影响了高脂喂养大鼠的肠道微生物,特别是增加了高脂喂养大鼠结肠内微生物群落的物种多样性。

表2 连续灌胃奥利司他10周后大鼠不同肠段的α多样性指数

组别AceChao 小肠盲肠结肠小肠盲肠结肠 正常组1482.30±830.981054.80±159.511338.70±313.351229.80±739.571046.10±132.16917.50±220.61 模型组1345.10±671.54(811.69±192.77)#(786.79±172.12)##1151.70±689.95827.11±222.36(766.38±201.67)## 奥利司他组(363.76±102.41)##**(735.63±132.88)##(901.28±224.31)*(295.73±63.01)#*(736.23±137.96)##(1248.60±254.84)#
“#”“##”分别示与正常组比较差异有统计学意义(<0.05、<0.01);“*”“**”分别示与模型组比较差异有统计学意义(<0.05、<0.01)。

图3 连续灌胃奥利司他10周后大鼠不同肠段内容物的OTUs韦恩图
经PCoA分析,正常组明显区别于模型组和奥利司他组,奥利司他组与模型组主成分区域虽有不同程度的重合,但也有部分区域分开(图4)。可见,肠道菌群β多样性存在差异,奥利司他可调节高脂饲料喂养大鼠的肠道菌群结构。
2.4.2奥利司他对高脂饮食大鼠不同肠段菌群构成的影响
各组大鼠肠内容物门水平菌群的相对丰度如图5所示。不同肠段相对丰度最高的门水平肠道微生物均为厚壁菌门(Firmicutes),而其他优势菌门则有所不同:结肠中,另一优势菌门是拟杆菌门(Bacteroidetes);盲肠中,正常组、模型组、奥利司他组中优势菌门分别是拟杆菌门、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia);小肠中,正常组、模型组、奥利司他组中优势菌门分别是变形菌门、变形菌门、放线菌门(Actinobacteria)。此外,奥利司他组大鼠中结肠部分的肠道微生物在门水平上的种类较其小肠和盲肠中丰富。说明奥利司他对高脂饮食大鼠不同肠段的门水平菌群构成有着不同的影响,但影响较大的为结肠微生物。

图4 连续灌胃奥利司他10周后大鼠不同肠段内容物的PCoA分布结果

图5 连续灌胃奥利司他10周后大鼠不同肠段内容物门水平菌群的相对丰度
在小肠微生物中,与正常组和模型组相比,奥利司他组的厚壁菌门的相对丰度升高,而变形菌门的相对丰度下降;小肠中拟杆菌门在高脂饮食组的相对丰度低于正常组,特别是奥利司他组几乎没有拟杆菌门,同时放线菌门的相对丰度在奥利司他组和模型组中均显著(<0.05,<0.01)升高。在结肠和盲肠中,模型组中厚壁菌门与拟杆菌门的相对丰度比值(/值)显著(<0.01)高于正常组的,说明高脂饮食会使肠道微生物菌群的组成结构发生显著变化,导致厚壁菌门相对丰度升高,而拟杆菌门相对丰度降低;与模型组相比,奥利司他组大鼠结肠微生物的厚壁菌门相对丰度降低,而拟杆菌门相对丰度升高,/值下降;高脂饮食后大鼠盲肠中螺旋体门(Spirochaetes)和疣微菌门的相对丰度显著高于正常组的,但奥利司他干预后螺旋体门的相对丰度较模型组有所降低。说明奥利司他对高脂饮食导致的肠道微生物菌群失调能够起到一定的调节作用,较为明显的是促进了结肠微生物中有益菌的生长。
从图6可知,在小肠肠段,变化最为明显的为乳杆菌属(),模型组和奥利司他组中乳杆菌属的相对丰度均高于正常组的,且奥利司他组的显著高于模型组的;相比于正常组,高脂饮食组中罗姆布茨菌属()的相对丰度下降,但相比于模型组,奥利司他组的又有所升高;正常组中的相对丰度较高,而高脂饮食组几乎没有;相比于正常组,模型组中链球菌属()的相对丰度显著升高,而相比于模型组,奥利司他组的下降。在盲肠肠段,罗姆布茨菌属、布劳特氏菌属()和阿克曼菌属()在高脂饮食组中的相对丰度均显著高于正常组的,而奥利司他组的显著高于模型组的;相比于正常组,高脂饮食组的拟普雷沃菌属()相对丰度显著下降;模型组中瘤胃球菌科_UCG–014 (Ruminococcaceae_UCG–014)和的相对丰度显著低于正常组的,但相比于模型组,奥利司他组的有所升高。在结肠中,高脂饮食组中布劳特氏菌属、罗姆布茨菌属、异芽孢杆菌属()、毛形杆菌属()的相对丰度均显著高于正常组的;模型组中瘤胃球菌科_UCG–014和罗斯伯里氏菌属()的相对丰度显著低于正常组的,但相比于模型组,奥利司他组中的升高。

“*”“**”示组间差异有统计学意义(P<0.05、P<0.01)。
3 结论与讨论
本研究中,大鼠高脂饮食喂养后,其体质量显著高于正常饮食大鼠的,这与ALBRAHIM等[14]和WANG等[15]研究报道的结果一致。本研究中,高脂饮食诱导肥胖的大鼠经过奥利司他给药10周后,其体质量显著低于模型组的,这与前人[16–17]的研究结果一致,说明奥利司他具有良好的减肥效果。
有研究[18]表明,肥胖会导致大鼠血清TC,TG和LDL–C水平异常升高。本研究中,经过奥利司他灌胃治疗10周后,高脂饮食导致的血脂异常得到改善。瘦素在血清中的含量与动物脂肪组织大小成正比[19]。本研究中,奥利司他组大鼠中血清瘦素的质量浓度低于模型组和正常组的,与大鼠体质量成正比。脂联素能调节脂质代谢[20],而血清中游离脂肪酸的浓度与机体的脂代谢、糖代谢和内分泌功能密切相关,与代谢综合征以心血管疾病的发生发展相关[21]。此外,当脂肪组织合成能力降低、脂肪降解能力增加时,游离脂肪酸的释放增加,从而降低脂肪外组织的循环脂联素水平[22]。本研究中,奥利司他干预提高了大鼠血清中脂联素水平,同时减缓了高脂饮食喂养导致的血清中游离脂肪酸的浓度升高。可见,奥利司他可减轻高脂饮食引起的肥胖,同时在一定程度上还可改善血糖代谢及糖胰岛素抵抗状态,这与OLSZANECKA–GLINIANOWIC等[23]的研究结论一致。
高脂饮食会使肠道菌群的组成结构发生变化,提高厚壁菌门与拟杆菌门相对丰度的比值[24–25]。本研究中也观察到相似的结果,相比于正常饮食组,模型组结肠中厚壁菌门相对丰度升高,拟杆菌门相对丰度降低。但经过奥利司他治疗后,大鼠结肠微生物中厚壁菌门相对丰度降低,而拟杆菌门相对丰度升高,故而降低了/值。
本研究中,影响较为明显的菌群为乳杆菌属,大鼠小肠中的乳杆菌属相对丰度在摄入奥利司他后显著升高。乳杆菌属是一类益生菌,它能发酵产生乳酸,调节机体免疫,有利于机体健康。说明奥利司他可通过影响肠道微生物的组成,进而影响机体的状态[26]。奥利司他组的罗姆布茨菌属在小肠与盲肠中的相对丰度也高于模型组的,而有研究[27]表明,罗姆布茨菌属在碳水化合物利用、单一氨基酸发酵、厌氧呼吸和代谢终产物等方面具有广泛的代谢能力。布劳特氏菌属有助于清除肠道内有害气体[28],其在各肠段中的相对丰度在奥利司他给药10周后升高了。阿克曼菌属能够保持机体健康,帮助保持消化道发挥正常的生理功能,降低机体由于代谢异常导致的肥胖和糖尿病等疾病的风险[29]。奥利司他干预10周后,大鼠盲肠中的阿克曼菌属相对丰度显著高于正常组和模型组的。罗斯伯里氏菌属能发酵多种碳水化合物,增加肠道中有益物质丁酸的含量,具有预防和治疗肥胖相关疾病的作用[30]。罗斯伯里氏菌属在模型组大鼠结肠中的相对丰度显著低于正常组的,但在奥利司他组中显著升高。奥利司他还促进了结肠中毛形杆菌属和瘤胃球菌属的生长。据报道,毛形杆菌属主要发酵葡萄糖[31],瘤胃球菌属可吸收单糖和降解黏蛋白来获取能量,发酵代谢产生甲酸和乙酸[32]。除了有益菌之外,奥利司他抑制了高脂饮食大鼠小肠中的链球菌属的生长。
综上可见,奥利司他对高脂饮食引起的各肠段微生物菌群失调能够起到一定的改善作用,具体表现为促进肠道有益菌的生长,并抑制有害菌的繁殖。本研究结果表明,奥利司他具有良好的减肥效果,可不同程度改善小鼠血脂代谢异常问题,在减质量的同时,也在一定程度上改善糖胰岛素抵抗状态,降低因长期高脂饮食所引起的肝脏脂质堆积,减少肝损伤,也可减轻高脂饮食下体内脂肪的堆积。奥利司他干预会造成小肠和盲肠微生物菌群丰度的减少,在一定程度上增加高脂喂养大鼠结肠内微生物群落的物种多样性。
[1] GARCIA-RIOS A,TORRES-PEÑA J D,PEREZ- JIMENEZ F,et al.Gut microbiota:a new marker of cardiovascular disease[J].Current Pharmaceutical Design,2017,23(22):3233–3238.
[2] CANI P D.Microbiota and metabolites in metabolic diseases[J].Nature Reviews Endocrinology,2019,15(2):69–70.
[3] LYNCH S V,PEDERSEN O.The human intestinal microbiome in health and disease[J].The England Journal of Medicine,2016,375(24):2369–2379.
[4] BOULANGÉ C L,NEVES A L,CHILLOUX J,et al. Impact of the gut microbiota on inflammation,obesity,and metabolic disease[J].Genome Medicine,2016,8:42.
[5] ZHOU L,XIAO X,ZHANG Q,et al.Deciphering the anti-obesity benefits of resveratrol:the “gut microbiota- adipose tissue” axis[J].Frontiers in Endocrinology,2019,10:413.
[6] 宁素云,滕丹,慕杨娜,等.基于肠道微生态研究山楂粉调节高脂膳食小鼠血脂的机制[J].中成药,2020,42(11):3062–3069.
[7] 欧阳建,李秀平,周方,等.平阳黄汤对高脂饮食大鼠肠道屏障和肠道菌群的影响[J].食品科学,2021,42(23):170–181.
[8] 王方杰,吴祖芳,翁佩芳,等.胡柚黄酮对高脂饮食诱导的肥胖小鼠模型肠道菌群的调节作用[J].食品科学,2020,41(21):140–146.
[9] 蒋琪,贺婷婷,石玉华.奥利司他治疗肥胖型多囊卵巢综合征的研究进展[J].中华生殖与避孕杂志,2019,39(9):763–767.
[10] ARZOLA-PANIAGUA M A,GARCÍA-SALGADO LÓPEZ E R,CALVO-VARGAS C G,et al.Efficacy of an orlistat-resveratrol combination for weight loss in subjects with obesity:a randomized controlled trial[J]. Obesity,2016,24(7):1454–1463.
[11] KE J,AN Y,CAO B,et al.Orlistat-induced gut microbiota modification in obese mice[J].Evidence-based Complementary and Alternative Medicine:ECAM,2020,2020:9818349.
[12] JIAO X,WANG Y,LIN Y,et al.Blueberry polyphenols extract as a potential prebiotic with anti-obesity effects on C57BL/6 J mice by modulating the gut microbiota[J]. The Journal of Nutritional Biochemistry,2019,64:88–100.
[13] MORALES P,FUJIO S,NAVARRETE P,et al.Impact of dietary lipids on colonic function and microbiota:an experimental approach involving orlistat-induced fat malabsorption in human volunteers[J].Clinical and Translational Gastroenterology,2016,7(4):e161.
[14] ALBRAHIM T,ALONAZI M A.Lycopene corrects metabolic syndrome and liver injury induced by high fat diet in obese rats through antioxidant,anti-inflammatory,antifibrotic pathways[J].Biomedicine & Pharmacotherapy,2021,141:111831.
[15] WANG Y,YAO W F,LI B,et al.Nuciferine modulates the gut microbiota and prevents obesity in high-fat diet-fed rats[J].Experimental & Molecular Medicine,2020,52(12):1959–1975.
[16] 刘井如,季宇彬,陈明苍.奥利司他对营养性肥胖大鼠的减肥作用[J].中国实验方剂学杂志,2013,19(7):186–188.
[17] 张欣怡,王凯,柯盈,等.奥利司他对谷氨酸钠诱导肥胖小鼠的减肥作用[J].武警后勤学院学报(医学版),2016,25(4):266–268.
[18] LI Q,LIU Z H,HUANG J N,et al.Anti-obesity and hypolipidemic effects of Fuzhuan brick tea water extract in high-fat diet-induced obese rats[J].Journal of the Science of Food and Agriculture,2013,93(6):1310– 1316.
[19] FRIEDMAN J M,HALAAS J L.Leptin and the regulation of body weight in mammals[J].Nature,1998,395:763–770.
[20] 臧海军,张克英.脂肪细胞因子:脂联素(adiponectin)的研究进展[J].饲料工业,2008,29(1):21–24.
[21] 于佳雪,徐亚伟,肖丹,等.游离脂肪酸与心血管疾病[J].现代生物医学进展,2013,13(10):1979–1982.
[22] HUANG X J,LIU G H,GUO J,et al.The PI3K/AKT pathway in obesity and type 2 diabetes[J].International Journal of Biological Sciences,2018,14(11):1483– 1496.
[23] OLSZANECKA-GLINIANOWICZ M,DĄBROWSKI P,KOCEŁAK P,et al.Long-term inhibition of intestinal lipase by orlistat improves release of gut hormones increasing satiety in obese women[J].Pharmacological Reports,2013,65(3):666–671.
[24] CHENG M,ZHANG X,ZHU J Y,et al.A metagenomics approach to the intestinal microbiome structure and function in high fat diet-induced obesity mice fed with oolong tea polyphenols [J].Food & Function,2018,9(2):1079–1087.
[25] TOMAS J,MULET C,SAFFARIAN A,et al.High-fat diet modifies the PPAR-γ pathway leading to disruption of microbial and physiological ecosystem in murine small intestine[J].PNAS,2016,113(40):E5934–E5943.
[26] 陈曦.乳杆菌属的益生菌保健功能及研究进展[J].中国乳品工业,2011,39(7):40–43,49.
[27] RICABONI D,MAILHE M,KHELAIFIA S,et al.,a new species isolated from human gut[J].New Microbes and New Infections,2016,12:6–7.
[28] OZATO N,SAITO S,YAMAGUCHI T,et al.genus associated with visceral fat accumulation in adults 20-76 years of age[J].Npj Biofilms and Microbiomes,2019,5:28.
[29] BELZER C,DE VOS W M.Microbes inside:from diversity to function:the case of[J].The ISME Journal,2012,6(8):1449–1458.
[30] DUNCAN S H,HOLD G L,BARCENILLA A,et al.sp.nov.,a novel saccharolytic,butyrate-producing bacterium from human faeces[J]. International Journal of Systematic and Evolutionary Microbiology,2002,52(5):1615–1620.
[31] WHITFORD M F,YANKE L J,FORSTER R J,et al.bovis gen. nov.,sp. nov.,a novel bacterium isolated from the rumen and faeces of cattle[J]. International Journal of Systematic and Evolutionary Microbiology,2001,51(6):1977–1981.
[32] DABARD J,BRIDONNEAU C,PHILLIPE C,et al. Ruminococcin A,a new lantibiotic produced by agnavus strain isolated from human feces[J]. Applied and Environmental Microbiology,2001,67(9):4111–4118.
Effect of orlistat on gut microbiota of rats fed with high-fat diet
WANG Jieyi1,2,3,4,GUO Jiajing2,3,4,QIAN Yujiao1,2,3,4,LI Gaoyang1,2,3,4,FU Fuhua1,2,3,4,SHAN Yang1,2,3,4*
(1.Longping Branch Graduate School, Hunan University, Changsha, Hunan 410125, China; 2.Hunan Agricultural Product Processing Institute, Hunan Academy of Agricultural Sciences, Changsha, Hunan 410125, China; 3.Hunan Key Lab of Fruits & Vegetables Storage, Processing, Quality and Safety, Changsha, Hunan 410125, China: 4.International Joint Lab on Fruits & Vegetables Processing, Changsha, Hunan 410125, China)
To investigate the effects of orlistat on high-fat diet-induced obese rats, 30 rats were randomly grouped into normal group of 10 rats and high-fat diet group of 20 rats, and obese rats were obtained after 10 weeks. Then, these obese rats were randomly and evenly divided into model group(10 rats) and orlistat group(10 rats). The normal group, model group and orlistat group were given normal diet, high-fat diet, high-fat diet + orlistat intragastric administration, respectively. The serum samples were collected after 10 weeks of the experiment for serum biochemical index detection, histopathological observation and gut microbiota analysis. The results showed that orlistat significantly reduced the body mass of rats on a high-fat diet, while reducing the accumulation of lipids in the liver caused by a long-term high-fat diet and improving liver injury and the accumulation of body fat. Orlistat also reduced serum TC and LDL-C levels and increased HDL-C levels in rats on a high-fat diet, improving the dyslipidemia in obese rats. And orlistat treatment improved glucose insulin resistance by increasing serum lipocalin levels and decreasing serum leptin and free fatty acid levels in obese rats. In addition, orlistat intervention caused a reduction in the abundance and diversity of the small intestinal and cecum flora and an increase in the species diversity of the microbial community in the colon of rats. Orlistat reduced the ratio of the relative abundance of the Firmicutes to the Bacteroidetes in the colon of rats on a high-fat diet. The relative abundance of Spirochaetes and Verrucomicrobia in the cecum of rats after high-fat diet was significantly higher than that in the normal group, but the relative abundance of Spirochaetes decreased after orlistat treatment compared to the model group. Orlistat promoted the growth of beneficial intestinal bacteria, such asandin the small intestine;andin the cecum; and,in the colon; and inhibited the colonization of harmful bacteria, such asin the small intestine. Therefore, the results of this study suggested that orlistat could effectively improve obesity and metabolic disorders caused by high-fat diet, and could improve the regulation of dysbiosis of gut microbiota caused by high-fat diet.
rat; orlistat; high fat diet; anti-obesity; gut microbiota
汪洁仪,郭佳婧,钱玉娇,李高阳,付复华,单杨.奥利司他干预对高脂饮食大鼠肠道微生物的影响[J].湖南农业大学学报(自然科学版),2022,48(5):585–593.
WANG J Y,GUO J J,QIAN Y J,LI G Y,FU F H,SHAN Y.Effect of orlistat on gut microbiota of rats fed with high-fat diet[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(5):585–593.
http://xb.hunau.edu.cn

R589.2;R965
A
1007-1032(2022)05-0585-09
10.13331/j.cnki.jhau.2022.05.012
2021–03–12
2022–09–18
国家重点研发计划项目(2017YFD0400701)
汪洁仪(1996—),女,湖南怀化人,硕士研究生,主要从事食品生物技术研究,wangjieyi1996@163.com;*通信作者,单杨,博士,研究员,主要从事柑橘等果蔬贮藏加工与综合利用研究,sy6302@sohu.com
责任编辑:邹慧玲
英文编辑:柳正
