高温胁迫下不同耐热性水稻品种的差异表达基因分析
2022-11-16周佳彭艳陈信波
周佳,彭艳,陈信波*
高温胁迫下不同耐热性水稻品种的差异表达基因分析
周佳1,2,彭艳2,陈信波1,2*
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.作物基因工程湖南省重点实验室,湖南 长沙 410128)
以耐热水稻品种996和热敏感水稻品种4628为材料,提取2个水稻品种在40 ℃高温处理0、10、20、60 min和2 h的5~6期幼穗中的RNA进行微阵列分析。结果表明:高温胁迫下2个不同耐热性品种的差异表达基因显著富集在苯丙烷生物合成、热休克蛋白、四肽重复以及一些与非生物胁迫相关的过程;耐热型水稻品种996的差异表达基因还显著富集于细胞色素P450,而热敏感水稻品种4628的差异表达基因显著富集到五肽重复;对高温胁迫下具有品种特异性表达的基因进行分析,推测可能是细胞色素P450家族基因的差异表达提高了耐热水稻996的耐热能力,基因的存在影响了热敏感水稻4628的抗逆性。
水稻;高温胁迫;耐热;热敏感;差异表达基因
高温(超过35 ℃以上)是影响水稻产量和质量的重要因素,对水稻生殖生长影响显著[1]。据国际水稻所研究,在水稻生长的环境敏感期和敏感温度范围,温度每升高1 ℃,产量损失10%以上[2]。长江中下游地区水稻常常在抽穗开花前后一段时期内遭遇持续高温,导致水稻花器官发育不良、授粉行为障碍、籽粒灌浆不饱满、结实率下降、水稻大幅度减产[3]。此外,高温还会引起淀粉糊化特性(糊化温度、峰值黏度、保持黏度、最终黏度等)发生改变,导致稻米品质变劣[4–5]。
随着工业进程化的加快以及温室效应的加剧,高温热害已经成为水稻生产的主要非生物胁迫之一。本研究中,以耐热水稻品种996和热敏感品种4628为材料,研究40 ℃高温处理对水稻幼穗基因表达的影响,并对差异表达的基因进行功能富集分析,旨在为耐热相关基因的筛选、鉴定以及耐热机理的研究提供依据。
1 材料与方法
1.1 供试水稻材料
耐热型水稻品种996、热敏感品种4628由湖南农业大学水稻研究所提供。
1.2 方法
1.2.1 高温胁迫处理
2个水稻品种在湖南农业大学试验田生长至孕穗期后,将生长基本一致的水稻移至实验室的培养箱中,在温度为32 ℃/28 ℃(白天/夜晚)、相对湿度80%、光照强度为600 μmol/(m2·s)的培养箱内预培养1 d,然后在40 ℃、相对湿度80%、光照强度600 μmol/(m2·s)的条件下处理10、20、60 min和2 h,取经高温处理的发育至5~6期的主穗中部的小花,混合后液氮速冻,–80 ℃保存,以备微阵列分析。
1.2.2基因芯片试验
试验材料为–80 ℃保存的经高温胁迫处理的幼穗,以未经高温处理的材料为对照。所用基因芯片为4×44 k 安捷伦寡核苷酸水稻芯片。试验在上海生物芯片有限公司进行。试验过程包括总RNA抽提、质量检测和定量、逆转录、标记、芯片杂交、洗脱、扫描以及对杂交信号值进行扣本底、标准化。
1.2.3差异表达基因分析
采用GEO2R软件比较分析2个水稻品种未处理组(对照组)数据和高温处理(实验组)数据,筛选差异表达基因。将4个时间点中有2个或2个以上时间点高温处理表达变化满足倍数变化(fold change, FC)大于2或小于0.5的基因定义为差异表达基因(differentially expressed genes,DEGs)。
1.2.4基因的功能富集分析
为分析差异表达基因的功能,运用生物信息学工具Database for Annotation, Visualization and Integrated Discovery (DAVID) v6.8(https://david. ncifcrf.gov/)进行GO功能富集分析、KEGG通路富集分析、INTERPRO蛋白结构域富集分析等。选取错误发现率(FDR)小于0.05的术语(terms)用于基因的功能分析。
1.2.5维恩分析
采用在线工具venny 2.1 (https://bioinfogp.cnb. csic.es/tools/venny/) 编制Venn图。
2 结果与分析
2.1 高温胁迫下2个水稻品种的基因表达
高温胁迫下,从耐热品种996中鉴定出3113个DEGs,从热敏感品种4628中鉴定出7297个DEGs(图1)。高温胁迫下,热敏感品种差异表达基因比耐热品种多,可能是因为热敏感品种对高温更敏感,进而触发级联反应,致使更多基因差异表达。

“↑”和“↓”分别表示高温胁迫下基因表达上调和下调。
2.2 高温胁迫下2个水稻品种DEGs的功能富集分析
2.2.1DEGs的GO富集分析
从图2可以看出,高温胁迫下,耐热品种996的DEGs主要富集到22个GO terms,包括6个生物过程(biological process,BP),4个细胞组分(cellular component,CC)及12个分子功能(molecular function,MF)。GO富集分析表明,这6个生物过程为热响应、次生代谢产物生物合成、碳水化合物代谢、几丁质分解代谢、毒素分解代谢、草酸代谢;在细胞组分中,质外体、胞外区、膜和细胞壁的DEGs最为显著;分子功能中,富集基因较多的为血红素结合、转录因子活性的序列特异性DNA结合、铁离子结合,各有104、94、77个差异表达基因。高温胁迫下,热敏感品种4628的DEGs主要富集到5个GO terms,包括2个生物过程和3个细胞组分,没有显著富集的分子功能。
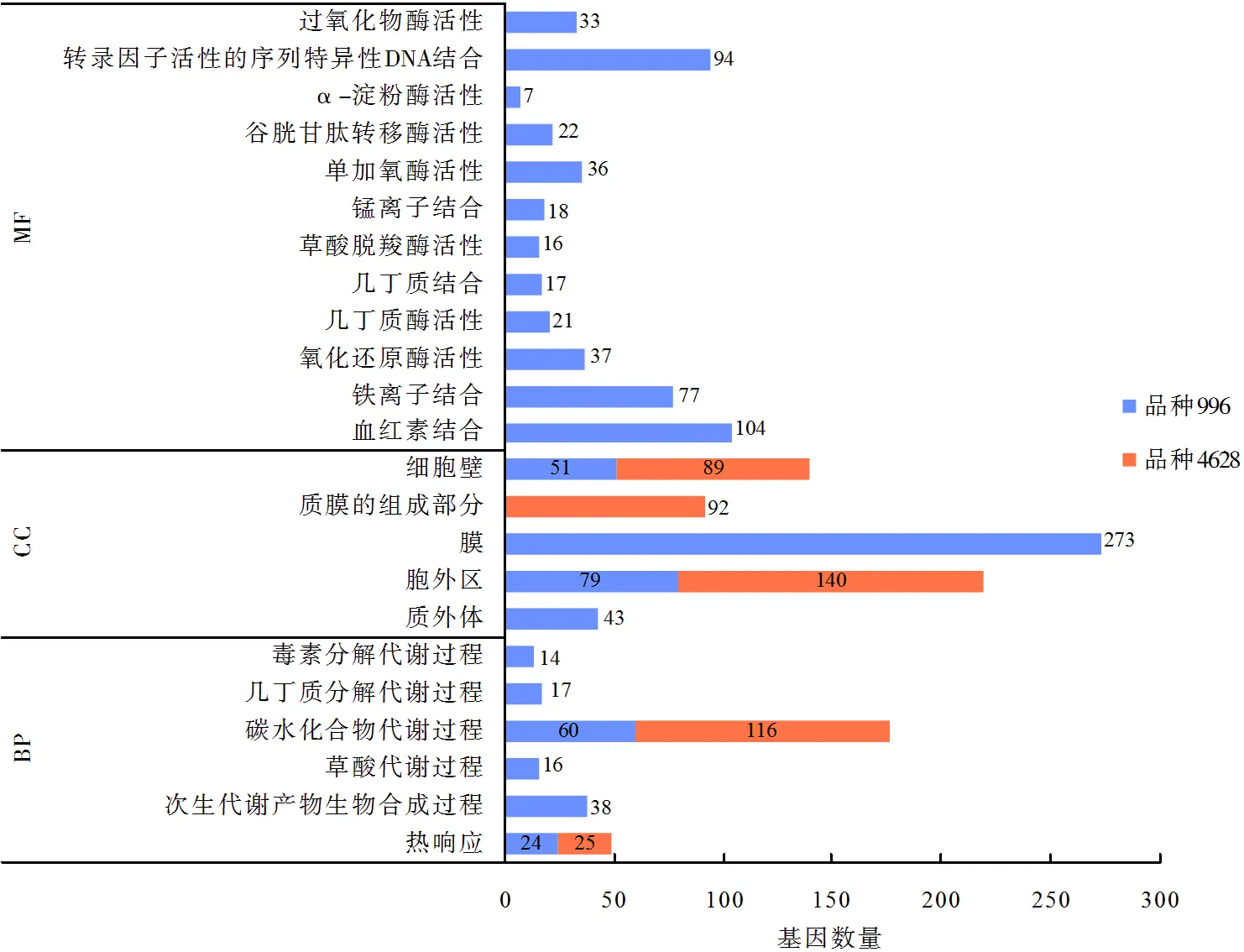
图2 高温胁迫下耐热型、热敏感型水稻DEGs的GO terms
2.2.2DEGs的KEGG通路富集分析
从表1可以看出,耐热品种996的DEGs主要富集在4条KEGG通路,富集基因最多的是内质网中的蛋白质加工,为62个。热敏感品种4628的DEGs主要富集在7条KEGG通路,其中代谢途径富集的基因最多,为504个。2个品种的DEGs都显著富集到苯丙烷生物合成。

表1 高温胁迫下2个不同耐热性水稻品种DEGs富集的KEGG通路
2.2.3DEGs的INTERPRO蛋白结构域分析
为了识别品种996与品种4628 DEGs蛋白结构域的特征,采用DAVID在线工具进行INTERPRO蛋白结构域的富集分析。结果(图3)表明,品种996 DEGs主要富集到20个蛋白质结构域。富集基因排在前5的蛋白结构域有细胞色素P450、细胞色素P450的E类I组、细胞色素P450的保守位点、糖苷水解酶超家族、糖苷水解酶的催化结构域,分别为69、64、62、62、56个。品种4628 DEGs主要富集到类HSP20分子伴侣、α–晶体蛋白/Hsp20结构域、五肽重复、糖苷水解酶超家族、糖苷水解酶的催化结构域等5个蛋白质结构域。
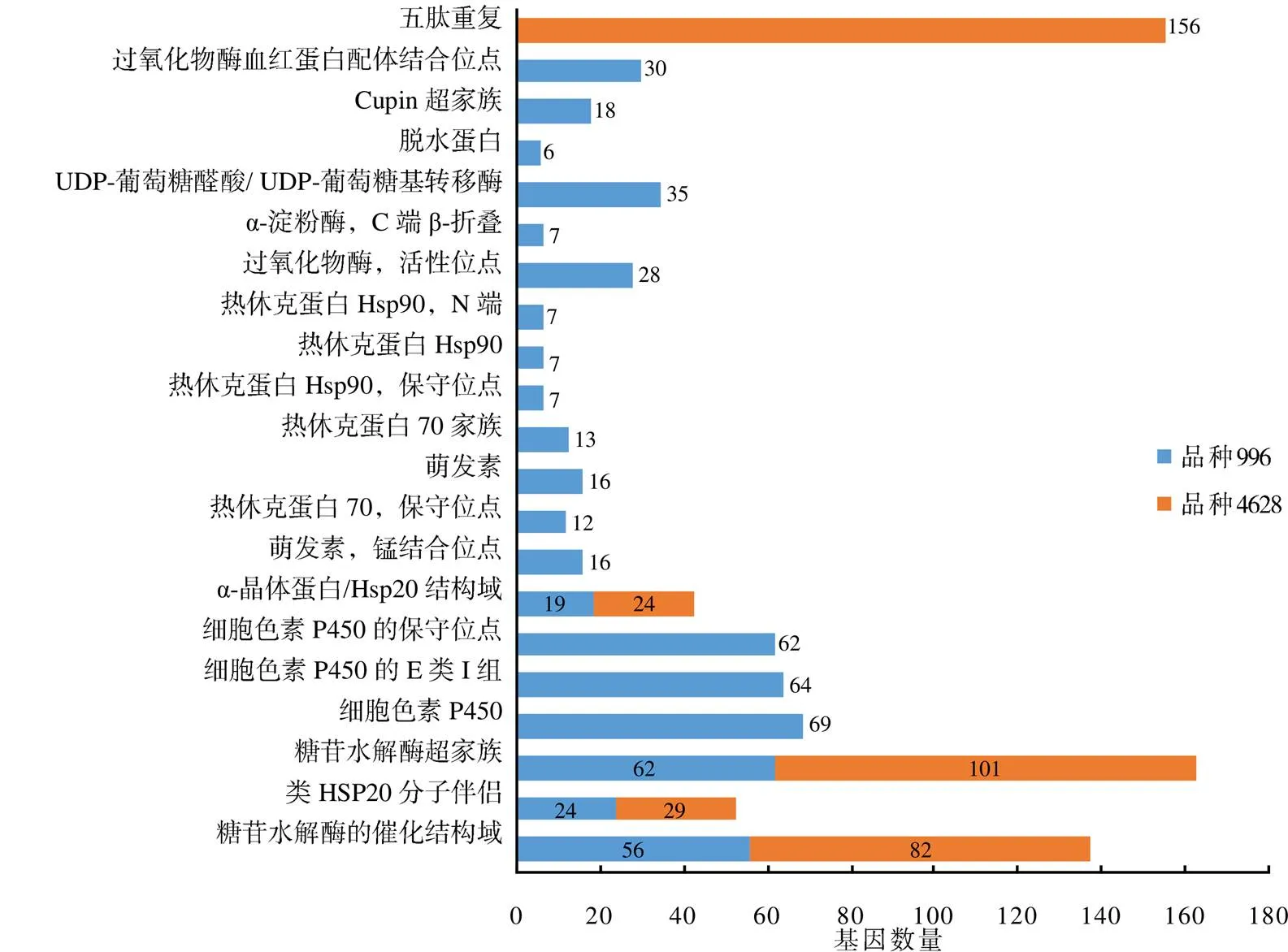
图3 高温胁迫下2个水稻品种DEGs的INTERPRO蛋白结构域富集分析结果
2.3 高温胁迫下2个水稻品种中差异表达一致基因的功能富集分析
选取2个品种在高温处理差异表达一致的基因(314个)进行富集分析。GO富集分析结果(图4)表明,2个品种差异表达一致的基因主要富集到5个基本生物学过程,没有显著富集的细胞组分和分子功能。在KEGG富集分析中发现,高温胁迫下2个品种差异表达一致的基因主要富集在1条通路,即内质网中的蛋白质加工。INTERPRO蛋白结构域富集分析结果(图4)表明,2个品种差异表达一致的基因富集到8个蛋白质结构域,主要为热休克蛋白和四肽重复相关的蛋白结构域。

图4 高温胁迫下2个水稻品种差异表达一致基因的功能富集分析结果
2.4 高温胁迫下2个水稻品种中差异表达相反的基因功能富集分析
选取了2个品种在高温处理差异表达相反的基因(在品种4628表达上调而在品种996表达下调的429个;在品种996表达上调而在品种4628表达下调的149个)进行富集分析。GO富集分析结果(图5)表明,在品种4628表达上调而在品种996表达下调的基因主要富集到6个GO terms,包括1个生物过程、1个细胞组分及4个分子功能;在品种996表达上调而在品种4628表达下调的基因没有显著富集到生物过程、细胞组分及分子功能。在本GO富集分析中,所富集到的基因在草酸盐代谢过程、草酸脱羧酶活性部分和锰离子结合部分完全一致,均为基因。
在KEGG通路富集分析(图5)中发现,在品种4628表达上调而在品种996表达下调的基因主要富集在4条KEGG通路,富集基因最多的是代谢途径,为53个。对在品种4628表达下调而在品种996表达上调的基因进行富集分析后,发现只有1条KEGG通路,即内质网中的蛋白质加工。
INTERPRO蛋白结构域分析结果(图5)表明,在品种4628表达上调而在品种996表达下调的基因主要富集到6个蛋白质结构域,前2位显著富集的蛋白结构域为糖苷水解酶的超家族和糖苷水解酶的催化结构域,这2个蛋白结构域富集的基因数量较多,分别为20和17。在品种996表达上调而在品种4628表达下调的基因没有显著富集到INTERPRO蛋白结构域。在本INTERPRO蛋白结构域富集分析中,萌发素的锰结合位点、萌发素以及Cupin超家族蛋白所富集的基因一致,均为基因。

“↑”和“↓”分别表示高温胁迫下基因表达上调和下调。
2.5 高温胁迫下具有品种特异性表达的基因
对2个品种DEGs的功能进行富集分析发现,耐热型水稻996 DEGs蛋白结构域富集到细胞色素P450、细胞色素P450的E类I组、细胞色素P450保守位点的基因基本一致,包括LOC_Os09g28390 ()、LOC_Os02g36150()、LOC_Os 02g36190()、LOC_Os02g36070()、LOC_Os04g48170()、LOC_Os05g40384 ()等。其中在高温胁迫下表达上调,、、、在高温胁迫下表达下调。热敏感水稻4628 DEGs显著富集在五肽重复,包括LOC_Os09g24680 ()、LOC_Os12g17080()等。其中在高温胁迫下表达上调,在高温胁迫下表达下调。品种4628显著富集于草酸盐代谢过程、草酸脱羧酶活性、锰离子结合、萌发素的相关基因在高温胁迫下特异上调,这些基因包括LOC_Os08g08980 ()、LOC_Os08g08960 ()、LOC_Os01g18170 ()、LOC_Os08g3576 0()、LOC_Os08g09000 ()、LOC_Os03g589 80()等。
3 结论与讨论
本研究中,通过对高温胁迫下2个水稻品种的转录组数据进行分析,发现耐热水稻品种996与热敏感水稻品种4628的DEGs均显著富集在一些基本的或者与胁迫密切相关的生物学过程、代谢途径以及蛋白结构域。苯丙烷代谢有多个分支,可产生包括木质素、类黄酮、木脂素、类苯丙酸酯、羟基肉桂酸酰胺和单宁的前体在内的代谢物[6]。维管植物需要木质素为细胞壁提供机械支持,使得植物能够长得更高[7]。研究[8–9]发现,木质素有助于植物对各种非生物胁迫的响应;类黄酮可减少由非生物胁迫引起的ROS积累造成的氧化损伤[10]。热休克蛋白(HSP)通常起分子伴侣的作用,根据其相对分子质量大小和序列同源性可分为Hsp100、Hsp90、Hsp70、Hsp60和小热休克蛋白sHsp(如Hsp40、Hsp20)。Hsp90可能对非生物胁迫具有直接的保护能力,并在信号转导中发挥作用[11–14]。Hsp70蛋白可增强植物对热和其他非生物胁迫的耐受性[15]。研究[16]表明,线粒体Hsp70可通过调控ROS含量来抑制水稻原生质体中的细胞编程性死亡。植物中含量最多的一类热休克蛋白为小热休克蛋白(sHsp),它能防止热诱导的蛋白质聚集,防止蛋白的变性以及不可逆的沉淀,促进变性蛋白正确的重折叠[17]。热休克蛋白表达的诱导是对非生物胁迫的最佳反应之一[18–20]。四肽重复与水稻抗性有关[21],且与伴侣蛋白有特定的相互作用。有研究[22]报道,基因的重复和基因的启动子区TFBs (transcription factor binding sites)的后续变异可能是基因及其启动子对水稻生物和非生物胁迫耐受性的新功能化的结果。
耐热型水稻996 的DEGs显著富集在细胞色素P450。基因在控制水稻脱落酸水平和非生物胁迫中起重要作用[23]。本研究中,在高温胁迫下表达上调,说明其可能是提高水稻耐高温性的关键基因。CYP87A3蛋白可能是生长素对生长反应的负调控因子,应用生长素可快速诱导的表达[24]。本研究中,在高温胁迫下表达下调,说明其可能不利于水稻开花。催化ent–异贝壳杉烯的C2–羟基化,催化ent–卡萨二烯的C2–羟基化[25]。是一种多功能/混杂羟化酶,可催化ent–卡萨–12,15–二烯的C11位羟基化[26](也称)编码细胞色素P450单加氧酶,该酶作为赤霉素失活酶,催化非13–羟基化GA的16α、17–环氧化[27]。本研究中,和在高温胁迫下表达下调,说明它们可能在胁迫反应中起负调控作用。的启动子区域包含多种顺式作用元件,其中非生物胁迫响应元件包括ABRE(脱落酸响应元件)、TGACG–motif (MeJA响应元件)、ERE(乙烯响应元件)、LTR(低温响应元件)、TATC/GARE(赤霉素响应元件)、TCA–Element(水杨酸响应元件)、MBS(干旱诱导响应元件)、TGA–Element(生长素响应元件)和AuxRR– Core(生长素响应元件)等[28]。推测耐热水稻996可能是因为细胞色素P450家族基因的差异表达提高了其耐热能力。
热敏感水稻4628的DEGs显著富集于五肽重复(PPR)。PPR蛋白在植物发育过程以及非生物胁迫反应中发挥重要作用,且基因可能在水稻对环境胁迫的反应中发挥作用[29]。保护RNA转录物免受核糖核酸酶降解[30]。本研究中,在高温胁迫下表达上调,说明其可能在水稻非生物胁迫下发挥重要作用。水稻编码一种含有DYW基序的五肽重复蛋白[31],对线粒体中的RNA编辑至关重要。推测可能是基因在水稻耐热性上发挥了特定作用,可见2个品种的不同耐热性是由不同基因的差异表达导致的。
[1] 杨军,章毅之,贺浩华,等.水稻高温热害的研究现状与进展[J].应用生态学报,2020,31(8):2817–2830.
[2] PENG S B,HUANG J L,SHEEHY J E,et al.Rice yields decline with higher night temperature from global warming[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(27):9971–9975.
[3] 彭艳,刘跃武,刘伯涵,等.高温干旱胁迫下水稻花器官中敏感基因的筛选[J].湖南农业大学学报(自然科学版),2022,48(1):13–21.
[4] YAO D P,WU J,LUO Q H,et al.Influence of high natural field temperature during grain filling stage on the morphological structure and physicochemical properties of rice (L.)starch[J].Food Chemistry,2020,310:125817.
[5] ZHANG C Q,ZHOU L H,ZHU Z B,et al. Characteriza- tion of grain quality and starch fine structure of tworice() cultivars with good sensory properties at different temperatures during the filling stage[J].Journal of Agricultural and Food Chemistry,2016,64(20):4048–4057.
[6] GRAY J,CAPARRÓS-RUIZ D,GROTEWOLD E.Grass phenylpropanoids:regulate before using![J].Plant Science,2012,184:112–120.
[7] ZHAO Q.Lignification:flexibility,biosynthesis and regulation[J].Trends in Plant Science,2016,21(8):713–721.
[8] MOURA J C M S,BONINE C A V,DE OLIVEIRA FERNANDES VIANA J,et al.Abiotic and biotic stresses and changes in the lignin content and composition in plants[J].Journal of Integrative Plant Biology,2010,52(4):360–376.
[9] CESARINO I.Structural features and regulation of lignin deposited upon biotic and abiotic stresses[J].Current Opinion in Biotechnology,2019,56:209–214.
[10] NAKABAYASHI R,SAITO K.Integrated metabolomics for abiotic stress responses in plants[J].Current Opinion in Plant Biology,2015,24:10–16.
[11] YAMADA K,FUKAO Y,HAYASHI M,et al.Cytosolic HSP90 regulates the heat shock response that is responsible for heat acclimation in[J]. Journal of Biological Chemistry,2007,282(52):37794–37804.
[12] SONG H M,ZHAO R M,FAN P X,et al. Overexpression of AtHsp90.2,AtHsp90.5 and AtHsp90.7 inenhances plant sensitivity to salt and drought stresses[J].Planta,2009,229(4):955–964.
[13] NISHIZAWA-YOKOI A,TAINAKA H,YOSHIDA E,et al.The 26S proteasome function and Hsp90 activity involved in the regulation of HsfA2 expression in response to oxidative stress[J].Plant and Cell Physiology,2010,51(3):486–496.
[14] XU J Y,XUE C C,XUE D,et al.Overexpression of GmHsp90s,a heat shock protein 90 (Hsp90) gene family cloning from soybean,decrease damage of abiotic stresses in[J].PLoS One,2013,8(7):e69810.
[15] MONTERO-BARRIENTOS M,HERMOSA R,CARDOZA R E,et al.Transgenic expression of thehsp70 gene increasesresistance to heat and other abiotic stresses[J].Journal of Plant Physiology,2010,167(8):659–665.
[16] QI Y C,WANG H J,ZOU Y,et al.Over-expression of mitochondrial heat shock protein 70 suppresses programmed cell death in rice[J].FEBS Letters,2011,585(1):231–239.
[17] 周丽,何非,潘秋红,等.热休克蛋白在植物抗逆反应中的作用[J].热带生物学报,2011,2(4):297–301.
[18] JIANG L Y,HU W J,QIAN Y X,et al.Genome-wide identification,classification and expression analysis of the Hsf and Hsp70 gene families in maize[J].Gene,2021,770:145348.
[19] SUN X B,ZHU J F,LI X,et al.AsHSP26.8a,a creeping bentgrass small heat shock protein integrates different signaling pathways to modulate plant abiotic stress response[J].BMC Plant Biology,2020,20(1):184.
[20] UL HAQ S,KHAN A,ALI M,et al.Heat shock proteins:dynamic biomolecules to counter plant biotic and abiotic stresses[J].International Journal of Molecular Sciences,2019,20(21):5321.
[21] YANG C,YU Y Q,HUANG J K,et al.Binding of thechitinase MoChia1 by a rice tetratricopeptide repeat protein allows free chitin to trigger immune responses[J].The Plant Cell,2019,31(1):172–188.
[22] DAS A,PRAMANIK K,SHARMA R,et al.In-silico study of biotic and abiotic stress-related transcription factor binding sites in the promoter regions of rice germin-like protein genes[J].PLoS One,2019,14(2):e0211887.
[23] CAI S L,JIANG G B,YE N H,et al.A key ABA catabolic gene,OsABA8ox3,is involved in drought stress resistance in rice[J].PLoS One,2015,10(2):e0116646.
[24] CHABAN C,WALLER F,FURUYA M,et al.Auxin responsiveness of a novel cytochrome P450 in rice coleoptiles[J].Plant Physiology,2003,133(4):2000– 2009.
[25] WU Y S,HILLWIG M L,WANG Q,et al.Parsing a multifunctional biosynthetic gene cluster from rice:biochemical characterization of CYP71Z6 & 7[J].FEBS Letters,2011,585(21):3446–3451.
[26] YE Z F,YAMAZAKI K,MINODA H,et al.In planta functions of cytochrome P450 monooxygenase genes in the phytocassane biosynthetic gene cluster on rice chromosome 2[J].Bioscience,Biotechnology,and Biochemistry,2018,82(6):1021–1030.
[27] ZHU Y Y,NOMURA T,XU Y H,et al.encodes a cytochrome P450 monooxygenase that epoxidizes gibberellins in a novel deactivation reaction in rice[J].The Plant Cell,2006,18(2):442–456.
[28] WASEEM M,HUANG F Y,WANG Q Y,et al. Identification,methylation profiling,and expression analysis of stress-responsive cytochrome P450 genes in rice under abiotic and phytohormones stresses[J].GM Crops & Food,2021,12(1):551–563.
[29] CHEN G L,ZOU Y,HU J H,et al.Genome-wide analysis of the rice PPR gene family and their expression profiles under different stress treatments[J].BMC Genomics,2018,19(1):720.
[30] HICKS J L,LASSADI I,CARPENTER E F,et al.An essential pentatricopeptide repeat protein in the api complexan remnant chloroplast[J].Cellular Microbiology,2019,21(12):e13108.
[31] KIM S R,YANG J I,MOON S,et al.Rice OGR1 encodes a pentatricopeptide repeat-DYW protein and is essential for RNA editing in mitochondria[J].The Plant Journal:for Cell and Molecular Biology,2009,59(5):738–749.
Analysis of differentially expressed genes in rice varieties with different heat tolerance under high temperature stress
ZHOU Jia1,2,PENG Yan2,CHEN Xinbo1,2*
(1.College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.Crop Gene Engineering Key Laboratory of Hunan Province, Changsha, Hunan 410128, China)
In this study, using heat tolerance line 996 and heat sensitive line 4628 as materials, we performed microarray analysis on the RNA extracted from the 5-6 stage young panicles of the two rice varieties treated with 40 ℃ for 0 min, 10 min, 20 min, 60 min and 2 h. The results showed that the differentially expressed genes of the two varieties were significantly enriched in phenylpropane biosynthesis, heat shock protein, tetratricopeptide repeat, and processes related to abiotic stress. In addition, heat tolerance line 996 differentially expressed genes were also significantly enriched in cytochrome P450. The heat sensitive rice 4628 differentially expressed genes were significantly enriched to pentatricopeptide repeat. With the results from this study, we could conclude that heat tolerance rice 996 may improve its own heat tolerance due to the differential expression of cytochrome P450 family genes, and heat sensitive rice 4628 may be due to the existence ofgene to affect its own stress resistance. The differentially expressed genes in the heat tolerance line 996 and heat sensitive line 4628 provided information for further heat resistant gene identification and clarification of the heat resistant mechanism.
rice; high temperature stress; heat tolerance; heat sensitive; differentially expressed genes
周佳,彭艳,陈信波.高温胁迫下不同耐热性水稻品种的差异表达基因分析[J].湖南农业大学学报(自然科学版),2022,48(5):536–542.
ZHOU J,PENG Y,CHEN X B.Analysis of differentially expressed genes in rice varieties with different heat tolerance under high temperature stress[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(5):536–542.
http://xb.hunau.edu.cn

S511; Q786
A
1007-1032(2022)05-0536-07
10.13331/j.cnki.jhau.2022.05.005
2021–12–01
2022–09–27
湖南省自然科学基金项目(2015JJ-3081);湖南省研究生科研创新项目(CX2015B241)
周佳(1996—),女,湖南邵阳人,硕士研究生,主要从事植物分子生物学研究,1010964041@qq.com;*通信作者,陈信波,博士,教授,主要从事植物分子生物学研究,xinbochen@live.cn
责任编辑:毛友纯
英文编辑:柳正
