HPLC法同时测定乳酸中L-乳酸及6种有机酸杂质的含量
2022-11-16谢莹莹张悦刘雁鸣赵勇郑金凤蒋贇周颖湖南省药品检验检测研究院长沙410001国家药品监督管理局药用辅料工程技术研究重点实验室长沙410001
谢莹莹,张悦*,刘雁鸣,赵勇,郑金凤,蒋贇,周颖(1.湖南省药品检验检测研究院,长沙 410001;2.国家药品监督管理局药用辅料工程技术研究重点实验室,长沙 410001)
乳酸又名2-羟基丙酸,是一种天然存在的重要有机酸,作为消毒防腐剂、pH 调节剂、助溶剂等,可用于肌内注射、静脉注射、皮下注射、口服糖浆、片剂、外用和阴道用制剂[1-2]。乳酸按其旋光性通常可以分为D-乳酸、L-乳酸以及外消旋型DL-乳酸3 种,因人体内只有L-乳酸脱氢酶可分解自身产生或摄入的L-乳酸,如过量摄入D型、DL型乳酸会产生酸中毒等代谢紊乱症状,故医药行业原辅料只用L-乳酸[3-4]。乳酸在发酵过程时,伴随产物乳酸生成的同时还有其他一些有机酸副产物,有机酸的含量是评价发酵工艺的重要指标[5-6]。其中《中国药典》2020年版乳酸品种项下采用化学反应控制枸橼酸、草酸、磷酸或酒石酸项[7];日本药典(JP17.0)对挥发性脂肪酸进行了控制[8]。为明确乳酸中可能含有的有机酸类型,参考相关文献[9-10],建立了HPLC-UV 法测定乳酸中其他有机酸,并采用液质联用确认L-乳酸二聚体的结构,确定该方法可有效排除影响有机酸分离因素的干扰,具有检测限低、重现性好的特点,可以用于乳酸的质量控制,现报道如下。
1 材料
LC-20A 岛津高效液相色谱仪(日本岛津);MS105DU 电子天平(瑞士Mettler-Toledo 公司)。草酸(批号:101097-201702,纯度:100.0%)、柠檬酸(批号:111679-201602,纯度:97.0%)、冰醋酸(批号:190079-202002,纯度:99.9%)对照品(中国食品药品检定研究院);酒石酸(批号:20180923)、己二酸(批号:20190407)、磷酸(批号:20200108)对照品(均为优级纯,国药集团化学试剂有限公司);L-乳酸对照品(批号:LRAC 7354,纯度:93.3%,Sigma-Alorich 公司);水为实验室自制超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Bio-Rad Aminex HPX-87H(300 mm×7.8 mm,9 μm);流动相:5 mmol·L-1H2SO4;流速:0.6 mL·min-1;检测波长:210 nm;柱温:55℃;进样量:10 μL。
2.2 溶液的制备
2.2.1 供试品溶液制备 取本品0.25 g,精密称定,置50 mL 量瓶中,加流动相稀释至刻度,摇匀,即得。
2.2.2 对照品溶液制备 精密称取磷酸、草酸、柠檬酸、酒石酸、L-乳酸、冰醋酸、己二酸对照品各适量,加流动相溶解,并逐步稀释得到系列标准工作溶液(STD1~STD5)(见表1)。
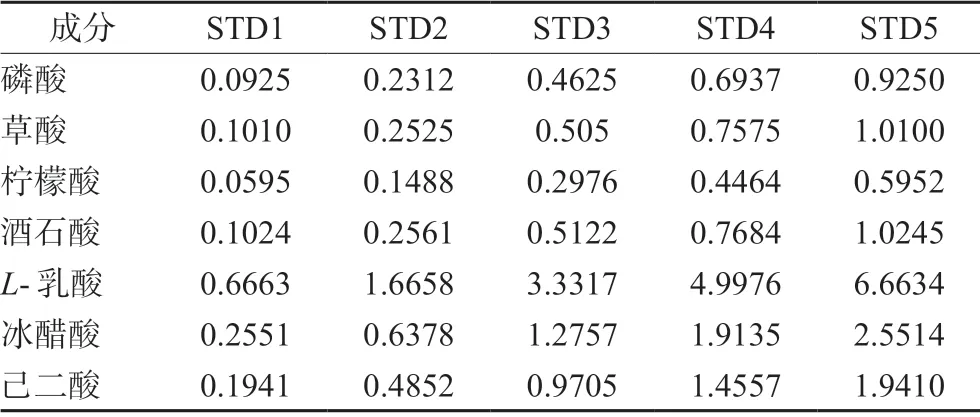
表1 7 种物质的标准工作溶液(mg·mL-1)Tab 1 Standard working solution of 7 substances (mg·mL-1)
2.3 系统适用性试验
取空白溶液(流动相)、供试品溶液、对照品溶液(STD3),进样测定,记录色谱图,结果显示,空白溶液对样品测定无干扰,各成分之间分离度均能达到药典要求[11]。典型图谱见图1。

图1 对照品溶液(A)、空白溶液(B)和供试品溶液(C)色谱图Fig 1 HPLC chromatogram of reference solution(A),blank solution(B)and test solution(C)
2.4 线性关系的考察
取“2.2.2”项下的系列标准工作溶液,进样测定,记录色谱图,以质量浓度对相应的峰面积进行回归,结果见表2。
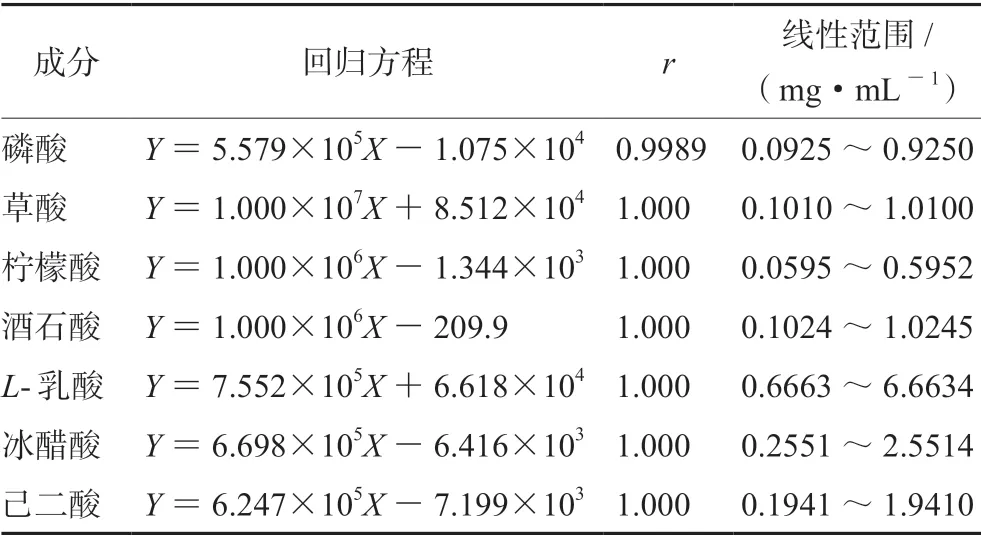
表2 各成分线性关系Tab 2 Linearity of various constituents
2.5 精密度试验
取“2.2.2”项下STD3 标准工作溶液,连续进样6 次,结果磷酸、草酸、柠檬酸、酒石酸、L-乳酸、冰醋酸、己二酸峰面积RSD分别为0.23%、0.036%、0.14%、0.11%、0.064%、0.13%、0.52%。
2.6 重复性试验
取本品(批号:CD190602C)按“2.2.1”项下方法平行制备6 份供试品溶液,进样测定,计算含量,结果杂质仅检出己二酸,含量为0.22%,RSD为4.7%,L-乳酸含量为64.5%,RSD为0.86%。
2.7 稳定性试验
取“2.6”项下供试品溶液和“2.2.2”项下的STD3 溶液在室温(25℃)放置0、2、4、6、8、12、24 h 后测定,结果各成分峰面积的RSD均小于5%,说明供试品及对照品溶液在24 h 内稳定。
2.8 定量限、检测限
取“2.2.2”项下STD1 溶液适量,逐级稀释,并进样测定,以信噪比S/N=10 和S/N=3 时各对照品的量为定量限和检测限,结果除主峰(L-乳酸)外,各杂质磷酸、草酸、柠檬酸、酒石酸、冰醋酸、己二酸检测限分别为2.7、0.15、2.0、5.2、5.4、7.6 μg·mL-1;定量限分别为9.1、0.50、6.9、17.6、18.2、25.5 μg·mL-1。
2.9 回收试验
分别称取本品(批号:CD190602C)适量,精密称定,置50 mL 量瓶中,分别依次加入磷酸、草酸、柠檬酸、酒石酸、L-乳酸、冰醋酸、己二酸对照品各适量,用流动相稀释并定容至刻度,平行制备6 份;分别精密量取上述溶液各10 µL 进样测定,并计算回收率,结果磷酸、草酸、柠檬酸、酒石酸、L-乳酸、冰醋酸、己二酸的平均回收率分别为103.1%、102.5%、101.5%、100.5%、99.8%、96.2%、101.1%,RSD分别为1.4%、0.80%、1.1%、0.26%、0.59%、0.23%、0.36%。
2.10 耐用性考察
改变柱温(±5℃)、流速(±0.2 mL·min-1)和不同品牌的液相色谱仪,结果不同品牌的仪器对结果无影响;柱温和流速会影响各组分间的分离,但各组分间的最低分离度均大于1,能够基本分离,对结果无明显影响,表明该方法耐用性较好。
2.11 样品测定
取33 批乳酸样品各适量,分别按“2.2.1”项下方法制备,再进样测定,计算样品中有机酸含量,结果见表3。

表3 样品中的L-乳酸单体及 6 种有机酸杂质检验结果(%)Tab 3 Test results of L-lactic acid monomer and 6 organic acid impurities (%)
2.12 液质联用确认主峰附近峰的结构
2.12.1 液相色谱条件 色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm);流速:0.3 mL·min-1;柱温:30℃;流动相:0.1%甲酸水溶液(A)-乙腈(B)梯度洗脱,程序见表4。

表4 梯度洗脱表Tab 4 Gradient elution
2.12.2 质谱条件 离子源:电喷雾离子源(ESI);源电压4 kV;氮气流速:3 L·min-1;加热气流速:10 L·min-1;干燥器气流速:10 L·min-1;接口温度:300℃;离子传输管温度:250℃;加热模块温度:400 ℃,负离子模式;一级质谱扫描范围50~1000;二级质谱碰撞电压:15 eV。
2.12.3 供试品的制备 单独收集图1中供试品溶液的峰8 组分,作为供试品溶液。
2.12.4L-乳酸对照品溶液 取L-乳酸对照品10 mg,加水溶解并稀释成1 μg·mL-1的溶液,即得。
2.12.5 碎片离子确认 精密量取供试品溶液、L-乳酸对照品溶液各3 μL,注入液质联用色谱仪,记录质谱图。结果显示,峰8 母离子一级质谱图中出现了m/z161.15,推测峰8 可能为两个乳酸分子聚合,脱去一分子水,生成乳酸二聚体,分子量为162,在负离子模式下[M-H]-为161。峰8 母离子经碰撞室碰撞后生成了m/z89.45 的碎片离子,即为L-乳酸的碎片离子,证实峰8 为乳酸二聚体。
3 讨论
3.1 检测器的选择
有文献[12]提出有机酸的检测可采用示差检测器,故课题组对该文献方法进行优化,使各成分分离能基本达到《中国药典》2020年版四部通则0512分离度的要求后,采用同一混合标准溶液在示差检测器和紫外检测器上进行测定,结果7 个成分在示差检测器上的检测限明显高于紫外检测器,且示差检测器影响因素多,所以选择紫外检测器进行检测。
3.2 检测波长的选择
对6 种有机酸杂质及L-乳酸的标准溶液进行波长全扫描,发现各成分在210 nm 附近均有最大吸收,所以选取210 nm 作为检测波长。
3.3 结论
该方法不仅可检测出乳酸中6 种有机酸杂质,还可将L-乳酸单体及L-乳酸二聚体区分开来,而《中国药典》2020年版乳酸品种项下[7]的含量测定采用滴定法,其原理是用过量氢氧化钠将乳酸中聚合体水解成乳酸单体后,再用硫酸滴定液返滴定,测定的是样品中乳酸及其聚合体的总和,不能反映样品中乳酸单体的含量;乳酸在高浓度下会发生聚合反应,生成乳酸聚合体[13],与现行标准对乳酸的定义相吻合,因此该方法测定L-乳酸单体含量相比于滴定法专属性更强。
4 小结
本研究建立了一种可有效检测乳酸中L-乳酸单体及6 种有机酸杂质的高效液相色谱法,该方法简便、准确,可有效分离各有机酸杂质并应用于乳酸中L-乳酸单体的批量检测,为乳酸标准的科学性和质量可控性提供参考。
