甘草药渣发酵工艺优化及成分分析、抗氧化活性的研究
2022-11-16吕丽静屈青松周晴盛梦柯李智勋石艳双卢建秋史新元北京中医药大学中药学院北京0488北京中医药大学生命科学学院北京0488
吕丽静,屈青松,周晴,盛梦柯,李智勋,石艳双,卢建秋*,史新元*(.北京中医药大学中药学院,北京 0488;.北京中医药大学生命科学学院,北京 0488)
随着中医药事业的蓬勃发展,中药制造业产生了大量中药药渣。中药提取后的药渣大多被作为废弃物处理,造成环境污染和资源浪费,药渣的处理成为目前中药制药企业面临的难题[1-2]。药渣中除了残留的药用成分外,还含有许多有价值的成分,可通过不同的方法将其充分利用。研究表明,药渣可作为饲料添加剂用于养殖业[3-4]。但药渣中纤维含量较高,将其直接作为饲料添加剂,活性成分的吸收利用率低,且适口性差[4],在一定程度上限制了其在养殖业中的应用。
现代微生物发酵技术因其安全、无毒、简单、效果理想等诸多优点,被广泛用于农业、医药、食品、化工等领域[5]。采用微生物发酵技术对药渣进行发酵,微生物产生的多种酶系可降低药渣中纤维素的含量,促进有效成分的析出,提高药渣利用率[6]。益生菌具有改善或维持健康的功能,可抑制有害细菌增殖,调节肠道菌群平衡,从而发挥机体调节、预防疾病等功效[7]。有研究发现益生菌发酵蒲公英可以提高其抗氧化活性[8]。鉴于上述特点,益生菌可被用作中药药渣发酵的菌种。
甘草是常用大宗药材,有“十方九草”“国老”之美誉。现代研究表明,甘草主要活性成分是三萜皂苷、黄酮和多糖类,具有抗氧化、调节免疫、保肝、抗炎抑菌等多种药理活性[9-10]。每年有大量甘草被用于生产,随之产生了大量的甘草固体废弃物[11]。本文以农业部发布的第2045号公告中规定的可用于饲料微生物添加剂的两种益生菌(植物乳杆菌和酿酒酵母)作为发酵菌种进行混合发酵,以甘草药渣作为发酵基质,以甘草总黄酮含量为检测指标,采用响应面法优化最佳发酵条件,并分析发酵前后成分含量的变化及抗氧化活性,为甘草药渣开发利用提供依据,使药渣的利用更加高效、环保。
1 材料
1.1 仪器
FW-100 型高速粉碎机(天津市泰斯特仪器有限公司),Synergy-2 型多功能酶标仪(美国 BIOTEK 公司),PB303-S 型电子天平(北京赛多利斯科学仪器有限公司),KQ-250E 型超声波清洗器(昆山市超声仪器有限公司),2695 型高效液相色谱仪(Waters 美国公司),BBS-DDC 型超净工作台(北京哈东联仪器制造有限公司)。
1.2 试药
甘草药渣(北京康仁堂药业有限公司)。植物乳杆菌(批号:cf201109,江苏菌钥生命科技发展有限公司),酿酒酵母(批号:ky2008613,中国典型培养物保藏中心)。对照品甘草酸、甘草苷、甘草素、异甘草素(批号分别为B20417、B20414、B20416、B21525,纯度≥98%,上海源叶生物科技有限公司);甲醇、乙腈(Fisher,色谱级)。
2 方法与结果
2.1 菌种活化及种子液制备
将植物乳杆菌、酿酒酵母菌菌悬液分别划线于MRS、YM 固体培养基中,并分别于37℃、30℃静置培养36 h,分离得到单一菌落。挑取单一菌落接种于MRS、YM 液体培养基中,37℃、160 r·min-1培养2 d,获得发酵用种子液,冷藏备用。
2.2 发酵甘草药渣培养基的制备
将甘草药渣粉碎并过40 目筛,称定10.00 g置于250 mL 锥形瓶中,加去离子水调整料水比为1∶1,121℃、20 min 高压蒸汽灭菌备用。
2.3 甘草总黄酮含量测定
采用70%的乙醇超声提取样品中的总黄酮[12],利用NaNO2-A1(NO3)3比色法测定总黄酮含量[13]。建立回归方程:A=6.5C+0.0186,R2=0.9996,利用回归方程计算总黄酮含量。
2.4 发酵条件优化

图1 单因素优化试验结果Fig 1 Single-factor optimization experiment results
2.4.2 响应面优化 依据单因素试验结果,对接种比例、接种量、发酵温度、发酵时间4 个因素,各选3 个水平,分别以-1、0、1 进行编码。采用 Box-Behnken 响应面设计模型,设计4 因素3水平中心组合试验条件,以总黄酮含量为评价指标,优化复合益生菌发酵甘草药渣工艺条件。试验因素水平及编码见表1,结果见表2。
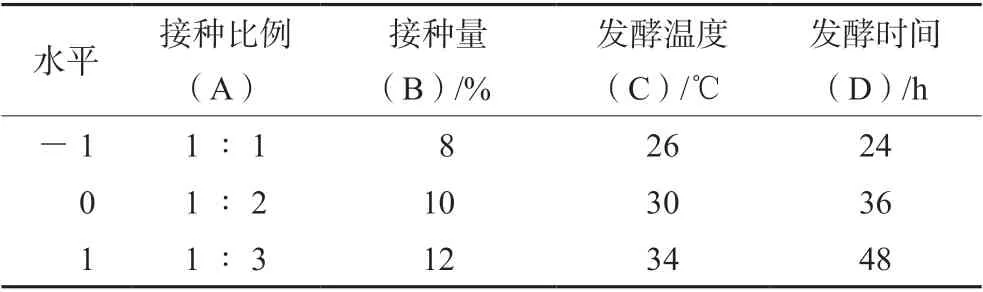
表1 Box-Behnken 的中心组合因素水平表Tab 1 Factor and level of the central composition of Box-Behnken

表2 Box-Behnken 试验设计方案及结果Tab 2 Box-Benhnken experiment design and results
应用Design-expert 8.0.6 软件对试验数据进行二次多元回归拟合,得到二次多项回归方程为:
Y=1.81+0.046A+0.078B+0.061C+0.046D+0.041AB- 0.055AC+0.01AD+0.14BC-0.11BD-0.2CD+0.047A2-0.17B2-0.14C2-0.13D2。
由表3可知,回归模型F值为 19.63,P值<0.0001,表明回归模型极显著。方程的相关系数R2=0.9515,R2>0.95,说明此模型拟合度较好,能很好地反映真实的实验情况。失拟项P=0.0960 >0.05,模型失拟项不显著。模型的调整复相关系数Radj2=0.9030,说明该模型能解释约90.30%响应值的变化。

表3 方差分析Tab 3 Variance analysis
根据F值的大小,得出总黄酮含量受各因素的影响次序为:发酵时间(B)>发酵温度(C)>接种比例(A)>接种量(D)。各因素之间两两交互作用对甘草总黄酮含量的影响见图2。由软件分析得到,益生菌发酵甘草药渣最优发酵工艺条件是接种比例酿酒酵母与植物乳杆菌为1∶3、发酵时间48 h、发酵温度34 ℃、接种量8%,在此条件下甘草总黄酮含量的预测值为1.99%。

图2 不同因素对甘草总黄酮含量影响的响应面分析图Fig 2 Response surface analysis of the effect of different factors on the total flavonoid content of licorice
2.4.3 回归模型的验证 为验证模型的可靠性及有效性,对优化后的最佳条件进行3 次重复试验,得到总黄酮含量为(1.98±0.02)%,与预测值相比无显著差异,表明预测值和实际值相吻合,优化模型可靠,对实际生产具有一定的指导意义。
对工程实践能力而言,深入企业顶岗锻炼与虚拟仿真实习,参与企业技术攻关与承担企业科研课题,企业挂职与企业调研相结合,促进工科新教师熟悉工程发展动态,丰富工程实践经验,发展解决实际工程问题的能力。
此外,试验测得发酵前总黄酮含量为(1.46±0.09)%,发酵后比发酵前增加了35.62%,说明优化方案设计合理有效,所获得的培养条件能够显著提高总黄酮含量。
2.5 HPLC 测定甘草酸及3 种黄酮类成分含量
2.5.1 色谱条件 采用高效液相色谱法测定甘草酸及3 种黄酮类成分的含量[14]。安捷伦C18色谱柱ZORBAX SB-C18(4.6 mm×250 mm,5 μm)的色谱柱,流动相:0.1%磷酸水(A)-乙腈(B),洗脱梯度(0~10 min,14%~26%B;10~24 min,26%~30%B;24~30 min,30%~34%B;30~35 min,34%~36%B;35~42 min,36%~42%B;42~45 min,42%~50%B;45~60 min,50%~45%B);流速:1 mL·min-1,柱温:35℃,检测波长:254、276、376 nm,进样体积:20 μL。
2.5.2 对照品溶液的制备 称定甘草酸对照品7.97 mg、甘草素对照品2.05 mg、异甘草素对照品2.03 mg、甘草苷对照品2.03 mg,精密加入50%甲醇溶液2 mL 溶解,配制成对照品储备液。
2.5.3 供试品溶液的制备 称定未发酵甘草药渣及发酵甘草药渣0.50 g,加入25 mL50%甲醇溶液,称重,超声处理(功率250 W,频率40 kHz)30 min,放冷,再称重,用50%甲醇补足减失的重量,离心,取上清液,经 0.45 μm 微孔滤膜滤过,取续滤液,得供试品溶液。
2.5.4 样品成分测定分析 精密吸取对照品溶液和供试品溶液进行测定,记录峰面积,计算各成分的含量,色谱图见图3,含量结果见表4,可见经过发酵后各成分的含量发生了变化。甘草苷及甘草酸含量有所下降,分别下降了63.79%、2.361%;而甘草素和异甘草素的含量有显著增加,分别增加了855.9%、86.21%。

表4 发酵前后4 种成分的含量变化Tab 4 Content changes of 4 components before and after the fermentation

图3 混合对照品(A)、未发酵甘草药渣(B)、发酵甘草药渣(C)中4 种成分HPLC 图Fig 3 HPLC of 4 components of mixed reference substance(A),unfermented licorice residue(B),and fermented licorice residue(C)1.甘草苷(liquiritin);2.甘草素(liquiritingenin);3.异甘草素(isoliquiritingenin);4.甘草酸(glycyrrhizic acid)
2.6 抗氧化活性测定
分别称取一定量的甘草药渣及发酵产物,加入20 倍去离子水,回流提取2 h,抽滤,滤液冷冻干燥。将冷冻干燥样品用去离子水制备成不同质量浓度的样品溶液进行抗氧化活性测定。
2.6.1 DPPH 自由基清除能力 参照申梦娜等[15]的方法,取DPPH 溶液2 mL,加入不同浓度的样品溶液2 mL,摇匀,在25℃避光放置30 min,在517 nm 波长处测定其吸光度(A1)。以无水乙醇作为空白对照测定其吸光度(A0),以无水乙醇代替DPPH 测定吸光度(A2),计算DPPH 清除率。
DPPH 清除率(%)=[1-(A1-A2)/A0]×100%。
2.6.2 羟自由基清除能力 参照沈明花等[16]的方法,依次加入9 mmol·L-1FeSO4溶液500 μL,9 mmol·L-1水杨酸-乙醇溶液500 μL,8.8 mmol·L-1H2O2溶液,37 ℃水浴15 min 后取出,测定510 nm 下吸光度。清除率计算同“2.6.1”项下。数据以平均值±标准差表示,并采用t检验进行分析。P<0.05 认为差异具有统计学意义。
由图4可知,在一定的浓度范围内,随着药物浓度的增加,其对DPPH、羟自由基的清除率呈上升趋势,且发酵后甘草药渣的DPPH、羟自由基清除能力比同浓度的发酵前清除能力显著提高。说明经过益生菌发酵,甘草药渣的DPPH 自由基清除能力显著提升,抗氧化活性增强。

图4 甘草药渣发酵前后对 DPPH 和羟自由基清除能力Fig 4 Scavenging effect of licorice residue before and after the fermentation on DPPH and hydroxyl radicals
3 讨论
黄酮类成分具有抗氧化、增强免疫功能、抗肿瘤等药效作用[17]。中药发酵具有提高药物有效成分含量,增强药效的作用。经过复合益生菌发酵,甘草药渣中总黄酮含量增加,通过对发酵工艺的优化,提取液中总黄酮含量得以提升。根据微生物的生长代谢特点,推测造成总黄酮含量提升可能是由于发酵过程中微生物分泌的酶类破坏了植物细胞壁,从而提高了提取率。利用微生物发酵甘草药渣,提高药渣中活性物质的溶出,可促进药渣的吸收利用,为生产药渣饲料添加剂提供参考,实现资源再利用。
发酵应用于中药,能利用微生物分解转化能力,增强或产生新的功效,使得中药更适应于临床用药的需要。马超等[18]研究用酵母发酵大黄使结合型蒽醌分解或者转化成游离型蒽醌,从而减轻大黄的峻烈泻下作用。杜静[19]研究发现冠突散囊菌可使中药三七皂苷类成分发生转化作用。甘草药渣发酵前后物质成分发生变化,可能是由于益生菌生物使这几种物质成分之间发生了相互转化。
甘草中的黄酮类物质分为游离苷元和结合型糖苷两大类。为进一步研究益生菌发酵过程对甘草渣中黄酮类成分的转化作用,本文通过高效液相色谱分析发现,经发酵后3 种黄酮类成分含量均有一定的变化。糖苷类成分甘草苷含量降低,苷元类成分甘草素和异甘草素含量增加。造成这种现象的原因可能是益生菌分泌的纤维素酶等酶分解了糖苷类成分,转化为更易被吸收的游离性苷元,从而使甘草素和异甘草素含量增加。大分子的黄酮糖苷类被分解成小分子苷元更容易被机体吸收[20],可进一步提高饲料利用率。
研究表明,氧化应激与疾病有直接关系,氧化与抗氧化机制失衡会造成动物抗病能力下降,从而引起疾病的发生[21]。因此增强机体抗氧化能力,可提高动物健康水平。陈学红等[22]发现乳酸菌发酵能提高金银花的抗氧化活性。本研究发现复合益生菌发酵后的甘草药渣对DPPH 自由基、羟自由基有一定的清除能力,且在相同浓度下都强于未发酵组。可能是由于益生菌的生物转化作用,物质成分发生变化并产生初级、次级代谢产物,从而发挥抗氧化作用[23];同时益生菌产生SOD 酶等酶类发挥作用,从而增强抗氧化活性[24]。
但不同企业之间产生的药渣在成分方面是否有差异尚未知。关于益生菌发酵药渣的应用范围需进一步深入研究。
综上所述,复合益生菌发酵甘草药渣具有较大的应用价值,为甘草药渣的再利用提供了可能。本研究也可以为企业的药渣资源再利用提供新思路,提高中药资源的综合利用价值。
