两种外泌体提取方法的比较以及外泌体对低氧肺动脉高压肺血管重构的作用
2022-11-16郭峰黄宁胡长平郑州大学第一附属医院药学部郑州450052中南大学湘雅药学院药理学系长沙40078
郭峰,黄宁,,胡长平(.郑州大学第一附属医院药学部,郑州 450052;2.中南大学湘雅药学院药理学系,长沙 40078)
外泌体(exosomes,Exos)是细胞膜向内凹陷形成包含管腔小体的多泡体,并通过与细胞膜融合释放到细胞外的异质性细胞外囊泡,异质性体现在其细胞起源、大小、内容物和对靶细胞的作用[1]。细胞膜向内凹陷时的不均一性导致了外泌体大小的异质性,通常认为外泌体是直径为40~160 nm 的膜性囊泡[1]。提取高纯度外泌体是外泌体相关研究的首要环节,而外泌体大小的异质性是导致提取外泌体纯度不足的主要原因。目前,常用的外泌体提取方法包括超高速差速离心法、试剂盒法、蔗糖密度梯度离心法和免疫磁珠捕获法等,其中超高速差速离心法和试剂盒法在基础性研究中应用最为广泛。本研究对比了超高速差速离心法和试剂盒法对外泌体的提取效果,以期为后续外泌体相关研究奠定基础。
肺动脉高压(pulmonary hypertension,PH)是一种静息状态下平均肺动脉压力>20 mmHg,肺血管阻力≥3 Wood 单位的进行性疾病[2]。肺血管重构是PH 的典型病理特征,是引起肺血管压力和阻力升高的主要原因,其潜在机制尚未完全阐明[3]。肺动脉内皮细胞(pulmonary artery endothelial cells,PAECs)和肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)在PH 肺血管重构中均发挥重要作用。PH 时,内膜损伤可致PAECs 发生内皮间质转化(endothelialmesenchymal transition,EndMT),发生EndMT 后的PAECs 肿胀变大且失去紧密连接,增殖和促炎能力增强,最终导致内皮屏障破坏和内皮功能紊乱[4-5];PASMCs 由收缩型转化为合成型,获得增殖、迁移、分泌活性物质和胞外基质等特点,从而促进中膜肥厚[6-7]。本课题组前期研究表明,PAECs-EndMT 和PASMCs 表型转化均可促进低氧PH 肺血管重构[8-9]。据文献报道,外泌体通过直接作用于肺血管细胞或介导肺血管细胞相互作用而参与PH 肺血管重构[10-14]。然而,外泌体是否通过调控PAECs-EndMT 和PASMCs 表型转化从而促进PH 肺血管重构,目前尚未见报道。本研究提取低氧PH 大鼠血浆源性外泌体并分别作用于PASMCs和PAECs,检测其对PASMCs 表型转化和PAECs-EndMT 的作用,以期进一步阐明PH 的发病机制,为PH 的防治提供参考和新思路。
1 材料
1.1 仪器与试药
胎牛血清、DMEM 高糖培养基(以色列Bioind公司),EGM2 内皮培养基(瑞士LonZa 公司),Exo-Quick-TC 试剂盒(美国SBI 公司),CD63 抗体、PCNA 抗体(武汉Proteintech 公司),CD9 抗体、TSG101 抗体、CD31 抗体(美国Abcam 公司),PKH67(美国Sigma 公司),α-SMA 抗体(美国CST公司),SM22α(武汉ABclonal 公司)。
小动物超声影像系统(Vevo2100)、超高速离心机(美国Beckman 公司),IJ-6A 台式冷冻离心机(美国Beckman-Coulter 公司),激光共聚焦显微镜、倒置显微镜(德国蔡司公司),生物型透射电子显微镜(美国FEI 公司),Zatasizer 粒径分析仪(英国Malvern 公司),低氧舱(长沙长锦科技有限公司),ChemiDoc XRS+成像系统(美国Bio-Rad 公司),细胞培养箱(美国Thermo 公司)。
1.2 动物
SPF 级SD 大鼠,雄性,180~220 g(动物许可证号:No.CSU2017009,中南大学实验动物学部),常规饲养1 周。
2 方法
2.1 低氧诱导PH 大鼠模型
SD 大鼠按照体质量随机分为常氧对照组和低氧模型组,每组10 只。校准并设置低氧仓氧含量为10%,低氧3 周以建立低氧PH 大鼠模型[8,15]。模型建立期间,将钠石灰和无水氯化钙置于低氧舱底部以吸收二氧化碳和水分,并及时更换。常氧对照组大鼠以氧含量21%处理3 周。实验期间,大鼠自由进食、饮水。
2.2 大鼠右心室收缩压测定方法
称量大鼠体质量,2%戊巴比妥钠(60 mg·kg-1,腹腔注射)麻醉,固定麻醉大鼠于解剖板上。右心导管法测定右心室收缩压(right ventricular systolic pressure,RVSP)。大鼠颈正中偏右找到并钝性分离右颈总静脉,丝线结扎静脉远心端,用眼科镊挑起右颈总静脉并用显微剪刀剪出V 型切口,将PE 软导管(外径为0.96 mm,内径为0.58 mm)从V 型切口插入,并缓慢推进,用成都泰盟BL410 系统记录波形。导管首先到达右心房并出现心房波,此时轻微地上下、旋转导管以进入右心室,直至出现心室波,待波形稳定1 min 左右后,记录RVSP。
2.3 原代大鼠PASMCs 的培养
采用贴壁法培养常氧大鼠原代PASMCs。雄性SD 大鼠,180~220 g,称重,麻醉,取出肺动脉置于磷酸盐缓冲液(PBS)溶液中;快速去除肺动脉纤维外膜,转移至干净培养皿,加入适量含20%血清的高糖培养基;沿主干和分支轻柔地剪开肺血管,小心刮落内皮层细胞,用剪刀将处理后的肺血管剪碎;利用牙科探针将剪碎的肺血管碎块快速在培养瓶底部铺开;加入含20%血清的高糖培养基,置于培养箱中培养约5 d;牙科探针小心去除组织块,加入20%血清的高糖培养基,置于培养箱中培养1~2 d;胰酶消化,使用第3~6 代PASMCs 进行后续实验。
2.4 原代大鼠PAECs 的培养
采用免疫磁珠分选法培养常氧大鼠原代PAECs。雄性大鼠,250~300 g,称重,麻醉,取出肺动脉置于PBS 中;快速去除肺动脉纤维外膜,转移至干净培养皿,加入适量胶原酶,剪碎肺动脉,37℃消化1 h,每5 min 振荡混匀一次;加入适量5% EGM2 内皮培养基终止消化,200 目筛网过滤以去除未完全消化的组织块;加入CD31-FITC 内皮细胞标志蛋白抗体,室温避光孵育15 min;加入10 μL 免疫磁珠,室温避光孵育15 min;2500 r·min-1离心10 min,弃上清液,500 μL buffer 重悬;约3 mL buffer 润洗分选柱,将buffer 重悬的细胞悬液加入分选柱,自由留下,3 mL buffer 清洗分选柱3 次;加入5 mL 5%EGM2 内皮培养基,使用活塞快速推出细胞;将推出的细胞悬液置于培养箱中培养。胰酶消化,使用第1~6 代PAECs 进行后续实验。
2.5 试剂盒法提取PASMCs 源性外泌体
收集PASMCs 细胞培养上清液,4℃300 g 离心10 min;3000 g 离心15 min;12 000 g 离心45 min;0.22 μm Millipore 过滤器过滤;将上清液转移至超滤管,3000 g 离心20 min,浓缩细胞上清液;将浓缩后的细胞上清液转移至1.5 mL EP 管,加入Exo-Quick-TC 试剂,翻转混匀,4℃过夜;1500 g 离心30 min,沉淀外泌体;100 μL PBS 重悬外泌体,4℃冰箱备用。为避免引入杂质,本课题中凡涉及外泌体所使用的PBS,均用0.22 μm Millipore 过滤器过滤。
2.6 超高速差速离心法提取外泌体
2.6.1 超高速差速离心法提取PASMCs 源性外泌体 收集PASMCs 细胞培养上清液,4℃300 g 离心10 min;3000 g 离心15 min;12 000 g 离心45 min;120 000 g 离心2 h;移液枪小心移除废弃上清,PBS 重悬外泌体;0.22 μm Millipore 过滤器过滤外泌体重悬溶液;吸取过滤后的外泌体重悬溶液于干净超速离心管中,PBS 配平,4 ℃120 000 g 离心70 min;100 μL PBS 重悬外泌体,4℃冰箱备用。
2.6.2 超高速差速离心法提取PAECs 源性外泌体 收集PAECs 细胞培养上清液,提取方法同“2.6.1”项下PASMCs 源性外泌体。
2.6.3 超高速差速离心法提取血浆源性外泌体收集常氧和低氧大鼠血浆于含抗凝剂EDTA 的采血管,4 ℃,2000 g 离心10 min 获得血浆;提取方法同“2.6.1”项下PASMCs 源性外泌体。
2.7 透射电子显微镜观察外泌体形态
外泌体悬液和2%多聚甲醛按1∶1 混合,滴于干净塑料薄膜上,将正面电镜碳网扣在液滴上,4℃静置20 min,去离子水洗涤;1%戊二醛处理2 min,去离子水洗涤;醋酸双氧铀负染90 s,烤干碳网,上机检测。
2.8 Western blot 分析检测外泌体标志蛋白的表达
用50 μL 蛋白裂解液重悬外泌体,冰上涡旋裂解30 min;12 000 r·min-1,4℃离心15 min,将上清液吸取至干净的200 μL EP 管。按照BCA试剂盒法测定蛋白质浓度。配制SDS-PAGE,电泳,转膜,孵育一抗CD9(1∶2000)、CD63(1∶2000)、TSG101(1∶2000)过夜,孵育二抗,显影,成像。
2.9 粒径分析仪检测外泌体粒径
将超高速差速离心得到的外泌体重悬于PBS溶液,4℃保存;选择一次性干净的样品池,对光使用无尘纸擦拭确保光路上无颗粒附着外管壁;缓慢注入外泌体并避免气泡,盖子封住样品池;将样品池放入仪器,按照标准操作规程进行仪器检测。
2.10 激光共聚焦检测PASMCs 和PAECs 对外泌体的摄取
超高速差速离心法得到外泌体后,小心去除上清液,用0.5 mL Diluent C 重悬外泌体;加入4 μL PKH67 至重悬了外泌体的Diluent C 溶液中,混匀,常温避光孵育4 min;2 mL 1% BSA 溶液终止染色;转移染色后的外泌体溶液于干净的超离管中,PBS 配平,4℃120 000 g 离心70 min,以去除残余染料;小心移除废弃上清液,100 μL PBS 重悬外泌体;将PKH67 标记的外泌体加入激光共聚焦培养皿培养的PASMCs 或PAECs 中,培养箱中孵育12 h;加入500 μL 4%多聚甲醛固定液,室温固定20 min;加入500 μL DAPI 染色液,室温染色5 min;激光共聚焦拍照,记录。
2.11 免疫荧光检测PASMCs 表型转化和PAECs-EndMT 标志蛋白的表达
从培养箱中取出处理完成的96 孔细胞培养板,弃培养基,PBS 洗涤;每孔加入100 μL 4%多聚甲醛,室温固定20 min,PBS 洗涤;每孔加入100 μL TritonX-100,室温透化10 min,PBS洗涤;每孔加入100 μL 1% BSA,室温封闭1 h;4℃孵育一抗CD31(1∶200)、α-SMA(1∶200)、PCNA(1∶400)过夜,PBS 洗涤;室温孵育相应二抗1 h,PBS 洗涤;每孔加入50 μL DAPI 染液,室温染色5 min,PBS 洗涤;显微镜拍照、记录。
2.12 统计学分析
所有数据均以平均值±标准误表示。两组均数比较采用独立样本的Student’st检验。统计分析采用SPSS 19.0 软件,双侧P<0.05 认为差异有统计学意义。
3 结果
3.1 试剂盒法提取PASMCs 源性外泌体的鉴定
透射电子显微镜结果显示,提取的PASMCs外泌体样本中仅观察到直径约10 nm 的囊泡,而未观察到直径为40~160 nm 的膜性囊泡(见图1A)。Western blot 结果显示,提取的外泌体样本中检测不到外泌体标志蛋白CD63 和TSG101 的表达(见图1B)。纳米微粒示踪分析结果显示,粒径40~160 nm 的颗粒仅占33%,其余颗粒粒径分布于3~10 nm 或160~600 nm(见图1C)。综上,试剂盒法提取的PASMCs 源性外泌体纯度不高。
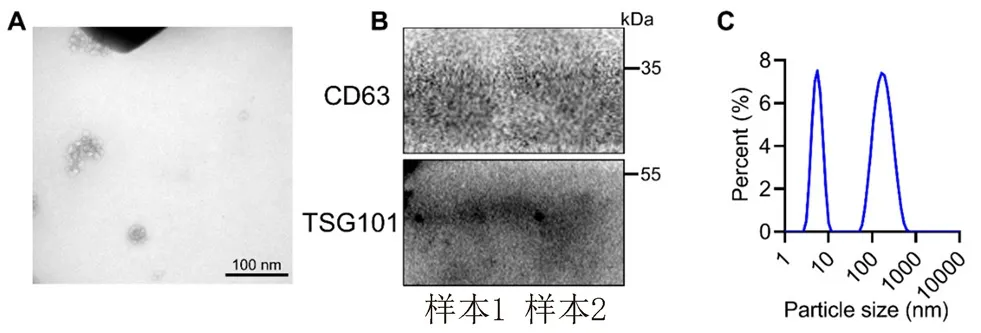
图1 透射电子显微镜(A)、蛋白质免疫印迹(B)和纳米微粒示踪分析(C)鉴定试剂盒法提取的PASMCs 源性外泌体Fig 1 Transmission electron microscope(A),Western blot(B)and nanoparticle tracing analysis(C)to identify PASMCs-derived exosomes by the kit method
3.2 超高速差速离心法提取PASMCs 源性外泌体的鉴定
透射电子显微镜结果显示,外泌体呈典型的“杯状”结构,粒径约为100 nm(见图2A)。Western blot 检测外泌体标志蛋白CD63 和TSG101,发现CD63 和TSG101 在外泌体中呈高表达(见图2B)。纳米微粒示踪分析结果显示,粒径40~160 nm 的颗粒所占百分比大于98%(见图2C)。综上所述,超高速差速离心法提取的PASMCs 源性外泌体纯度较高,优于试剂盒法。

图2 透射电子显微镜(A)、蛋白质免疫印迹(B)和纳米微粒示踪分析(C)鉴定超高速差速离心法提取的PASMCs 源性外泌体Fig 2 Transmission electron microscope(A),Western blot(B)and nanoparticle tracing analysis(C)to identify PASMCs-derived exosomes by the ultra-high speed differential centrifugation
3.3 超高速差速离心法提取PAECs 源性外泌体的鉴定
Western blot 检测外泌体标志蛋白CD9,发现CD9 在提取的外泌体中呈高表达,而在PAECs 细胞碎片中基本不表达(见图3A)。纳米微粒示踪分析结果显示,粒径40~160 nm 的颗粒所占百分比大于99%(见图3B)。综上所述,超高速差速离心法提取的PAECs 源性外泌体纯度较高。

图3 蛋白质免疫印迹(A)和纳米微粒示踪分析(B)鉴定超高速差速离心法提取的PAECs 源性外泌体Fig 3 Western blot(A)and nanoparticle tracing analysis(B)to identify PAECs-derived exosomes by the ultra-high speed differential centrifugation
3.4 超高速差速离心法提取血浆源性外泌体鉴定
以常氧为例,透射电子显微镜结果显示,外泌体呈典型的“杯状”结构,粒径约为100 nm(见图4A)。Western blot 检测外泌体标志蛋白CD9,发现CD9 在血浆源性外泌体中呈高表达(见图4B)。纳米微粒示踪分析结果显示,粒径40~160 nm 的颗粒所占百分比大于98%(见图4C)。综上所述,超高速差速离心法提取的血浆源性外泌体纯度较高。

图4 透射电子显微镜(A)、Western blot(B)和纳米微粒示踪分析(C)鉴定超高速差速离心法提取的大鼠血浆源性外泌体Fig 4 Transmission electron microscope(A),Western blot(B)and nanoparticle tracing analysis(C)to identify plasma-derived exosomes by the ultra-high speed differential centrifugation
3.5 低氧构建PH 大鼠模型
与常氧对照组(21%O2,21 d)相比,低氧模型组(10%O2,21 d)大鼠体质量显著降低,RVSP显著升高,右心室重量/(左心室+室间隔)重量RV/(LV+S)、右心室重量/胫骨长度(RV/tibial length)显著升高(见图5A~E)。同时,多普勒超声检测结果显示,与常氧对照组相比,低氧模型组大鼠肺动脉壁厚度(PAWT)与右心室壁厚度(RVWT)显著升高,而肺动脉血流加速时间/肺动脉血流射血时间(PAT/PET)与三尖瓣环收缩期位移(TAPSE)显著降低(见图5F~M)。HE 染色结果显示,与常氧对照组相比,低氧模型组大鼠肺血管明显增厚,管腔狭窄(见图5N~P)。综上,低氧诱导PH 大鼠模型成功。

图5 体质量(A)、右心室收缩压(B~C)、右心室重构指数(D~E)、超声心动图指标(F~M)及肺血管重构指标(N~P)确认低氧(10%O2,21 d)诱导PH 大鼠模型构建成功(**P<0.01)Fig 5 Body weight(A),right ventricular systolic pressure(B~C),indexes of right heart remodeling(D~E),indexes of echocardiography(F~M) and indexes of pulmonary arterial remodeling(N~P) to confirm the successful construction of PH rat model induced by hypoxia(10%O2,21 d)(**P<0.01)
3.6 血浆源性外泌体对PASMCs 表型转化的作用
首先,用PKH67 标记的血浆源性外泌体孵育SD 大鼠原代PASMCs 12 h,激光共聚焦实验证明外泌体可进入原代大鼠PASMCs(见图6A)。接下来,分别用常氧大鼠血浆源性外泌体(Exos-Normoxia)和低氧大鼠血浆源性外泌体(Exos-Hypoxia)孵育常氧培养的大鼠PASMCs 24 h。免疫荧光结果显示,相对于Exos-Normoxia,Exos-Hypoxia 处理的PASMCs 中收缩型标志蛋白α-SMA 表达显著降低,而增殖型标志蛋白PCNA表达显著升高(见图6B~C)。由此认为,Exos-Hypoxia 可诱导PASMCs 发生表型转化。
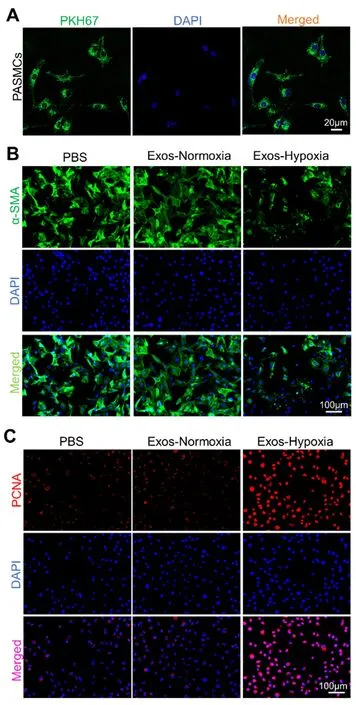
图6 激光共聚焦和免疫荧光分别检测PASMCs 对PKH67 标记外泌体的摄取(A)和低氧大鼠血浆源性外泌体对PASMCs 表型转化标志蛋白α-SMA 和PCNA 表达的影响(B~C)Fig 6 Laser confocal microscopy for the uptake of PKH67-labeled exosomes by PASMCs(A)and immunofluorescence for the expression of phenotypic transformation biomarkers α-SMA and PCNA in PASMCs(B~C)
3.7 血浆源性外泌体对PAECs-EndMT 的作用
首先,用PKH67 标记的血浆源性外泌体孵育SD 大鼠原代PAECs 12 h,激光共聚焦实验证明外泌体可进入原代大鼠PAECs(见图7A)。接下来,分别用Exos-Normoxia 和Exos-Hypoxia 孵育常氧培养的大鼠PAECs 24 h。免疫荧光结果显示,相对于Exos-Normoxia,Exos-Hypoxia 处理的PAECs 中内皮细胞标志蛋白CD31 表达显著降低,而间质样细胞标志蛋白α-SMA 表达显著升高(见图7B~C)。由此认为,Exos-Hypoxia 可诱导PAECs 发生EndMT。

图7 激光共聚焦和免疫荧光分别检测PAECs 对PKH67 标记外泌体的摄取(A)和低氧大鼠血浆源性外泌体对PAECs 间质转化标志蛋白CD31 和α-SMA 表达的影响(B~C)Fig 7 Laser confocal microscopy for the uptake of PKH67-labeled exosomes by PAECs(A)and immunofluorescence for the expression of EndMT biomarkers CD31 and α-SMA in PAECs(B~C)
4 讨论
本研究旨在比较试剂盒法和超高速差速离心法提取外泌体的纯度,并探究血浆源性外泌体在PH 发病机制中的作用,揭示外泌体调控PH 肺血管重构的潜在机制,结果发现:① 相较于试剂盒法,超高速差速离心法提取外泌体的纯度显著升高;② 超高速差速离心法可提取高纯度的PASMCs、PAECs 和血浆源性外泌体,适用性强;③ Exos-Hypoxia 可进入PASMCs,诱导PASMCs发生表型转化;④ Exos-Hypoxia 可进入PAECs,诱导PAECs 发生EndMT。
外泌体相关研究的首要环节是提取高纯度外泌体。目前,常用的外泌体提取方法有超高速差速离心法、试剂盒法、蔗糖密度梯度离心法和免疫磁珠捕获法等。现将上述几种方法进行如下对比(见表1)。虽然蔗糖密度梯度离心法和免疫磁珠捕获法能够得到更高纯度外泌体,但耗时长、费用高且操作复杂,不适于大规模开展实验。本研究比较了超高速差速离心法和试剂盒法,通过透射电子显微镜观察外泌体形态、纳米微粒示踪分析检测外泌体粒径分布、蛋白质免疫印迹检测外泌体标志蛋白表达,提示超高速差速离心法提取的外泌体纯度显著优于试剂盒法。此外,本研究也利用超高速差速离心法分别提取PASMCs、PAECs 和血浆源性外泌体,发现均能得到较高纯度的外泌体。提示超高速差速离心法实验方法稳定,适用性强,操作性高,提取外泌体的纯度理想,可用于各项外泌体相关基础性研究中。

表1 几种常用外泌体提取方法的对比Tab 1 Several extraction methods for exosomes
外泌体作为一种40~160 nm 的膜性囊泡,通过其丰富的蛋白质、脂质及核酸内容物对毗邻或远端的靶细胞发挥多样的生物学作用如炎症反应、免疫应答、细胞分化、细胞死亡、细胞增殖与迁移、血管新生等,从而参与高血压、糖尿病、动脉粥样硬化、心肌梗死、心肌肥大等心血管疾病的进程[16-19]。研究表明,外泌体也参与介导PH 的发生、发展,这可能与外泌体中的微小RNA 和蛋白质内容物相关。外泌体可调控多种细胞的表型转化进程,包括间质细胞上皮化、上皮间质转化、EndMT 和平滑肌细胞表型转化等[20-22]。但目前外泌体与平滑肌细胞表型转化和EndMT 间的相关报道较少。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)源性外泌体可上调人主动脉平滑肌细胞(human aortic smooth muscle cells,HASMCs)中收缩型标志蛋白(α-SMA、Smoothelin、Calponin)的表达[23];miR143/145 可通过HUVECs 源性细胞外囊泡传递至HASMCs,从而调控HASMCs 表型转化[24];外泌体可促进血管平滑肌细胞向钙化表型转化[25-26]。视网膜上皮细胞源性外泌体抑制高糖诱导的HUVECs 发生EndMT,这可能是因为外泌体中的miR-202-5p 传递至HUVECs 并调控TGF/Smad 信号通路[27]。黑色素瘤细胞源性外泌体可促进HUVECs 发生EndMT[28]。MSC 源性外泌体可抑制PAECs 和视网膜微血管内皮细胞发生EndMT[20,29]。在上述研究基础上,本课题构建了低氧PH 大鼠模型,并提取Exos-Normoxia 和Exos-Hypoxia。将Exos-Normoxia 和Exos-Hypoxia孵育常氧培养的大鼠PASMCs 和PAECs,通过免疫荧光检测PASMCs 和PAECs 中表型转化和EndMT 标志蛋白表达变化,证明Exos-Hypoxia 可促进PASMCs 表型转化,也可促进PAECs 发生EndMT。
综上所述,超高速差速离心法虽然需要配备超高速离心机,但获得的外泌体纯度显著优于试剂盒法。试剂盒法提取外泌体的纯度不理想,且价格昂贵,研究者应斟酌使用。此外,超高速差速离心法提取的低氧大鼠血浆源性外泌体可进入PASMCs 和PAECs,促进PASMCs 表型转化和PAECs 发生EndMT,从而促进PH 肺血管重构。此研究进一步阐明了PH 的发病机制,为防治PH提供参考和新思路。
