设施连作枯萎病黄瓜根际亚硝酸盐氧化细菌群落特征*
2022-11-16郑晨萌任秀娟陈碧华申长卫吴大付
郑晨萌,刘 星**,张 影,任秀娟,陈碧华,王 菲,申长卫,吴大付
(1.河南科技学院资源与环境学院/河南省生物药肥研发与协同应用工程研究中心 新乡 453003;2.河南科技学院园艺园林学院 新乡 453003)
中国是全世界最大的设施蔬菜生产国,设施蔬菜栽培是农民增收的主渠道之一,确保设施蔬菜行业的可持续发展对于促进农户持续增收和实现乡村振兴战略目标具有重要意义。然而,随着设施蔬菜生产区域集中化和种植规模扩大,长期集约化连作种植带来的土传病害问题已成为限制行业健康发展的重要瓶颈[1-2]。土壤是土传致病菌栖居的大本营,病原菌在条件适宜时以土壤为媒介浸染作物根系导致病害发生。阐明发病土壤理化、生化和生物学性质与健康土壤的差异是切断病害发生链条和实现障碍土壤修复改良的前提。
根际是作物-土壤-微生物互作的热区,这里既是土传病害发生发展的主要场所,也是作物抵御土传病原菌侵袭的关键防线[3]。连作条件下作物根际微生物组退化被认为是土传病害发生的重要原因[4-5]。大量研究证实,与健康植株相比,病株根际土壤微生物多样性更低、群落结构失衡,有益(生防)微生物比例减少而土传致病菌比例增加,且微生物种间互作强度和群落稳定性(抵抗力)变差,这些都利于致病菌的入侵[6-11]。然而,已有研究多是围绕根际土壤总的微生物群落(即细菌和真菌)变化展开,对功能微生物(组)关注较少。土壤微生物具有高度的功能多样性,不同的土壤生物学过程(生态功能)常常由专一或少数的功能(组)微生物驱动,目前尚不清楚发病植株根际土壤一些关键的功能微生物群落的多样性和结构是否也与健康植株存在差别。
硝化过程是土壤氮循环的核心环节,决定着土壤氮素有效性,对氮素高效利用和作物高产优质至关重要[12-13]。硝化过程经由两步完成:NH3首先经氨氧化细菌(ammonia-oxidizing bacteria,AOB)和氨氧化古菌(ammonia-oxidizing archaea,AOA)氧化为NO2—,而后亚硝酸盐氧化细菌(nitrite-oxidizing bacteria,NOB)将NO2
—氧化为NO3—[14]。我们前期发现,设施连作枯萎病黄瓜根际土壤氨氧化能力显著低于健株,这是由于病株根际AOB 群落中Nitrosospira briensisClade 相对丰度降低导致[15-16]。但病株根际土壤亚硝酸盐氧化能力和NOB 群落特征仍不明确,这限制了对病害土壤硝化过程通路和相关微生物生态学机制的理解。目前已知的NOB 隶属于7 个细菌属,其硝化杆菌属(Nitrobacter)和硝化螺菌属(Nitrospira)在土壤亚硝酸盐氧化中起着主导作用[17-19]。鉴于此,我们以设施连作枯萎病黄瓜(Cucumis sativus)为研究对象,以同一地块的健康植株为对照,结合荧光定量PCR 和高通量扩增子测序方法,评估病株和健株间根际土壤Nitrobacter和Nitrospira丰度和群落多样性及结构差异,旨在增加对连作发病土壤关键生物学功能及其微生态过程的认识,为障碍土壤修复改良提供理论依据。
1 材料与方法
1.1 研究区域概况
研究区域位于河南省新乡市牧野区牧野镇(35°21′12″N,113°55′2″E,平均海拔约56 m)。供试土壤为壤质潮土。牧野镇是河南省设施蔬菜种植面积最大的乡镇,也是豫北地区重要的设施蔬菜种植基地,主要栽培黄瓜、番茄(Lycopersicum esculentum)、辣椒(Capsicum annuum)和茄子(Solanum melongena)等作物,种植结构相对单一,且大多处于长期连续种植状态,连作障碍问题突出,枯萎病、黄萎病和青枯病等土传病害较为普遍。该区地处黄河中下游,水资源丰富,土层深厚,土壤肥沃,属于温带大陆性季风气候,四季分明。年平均降雨量约573.4 mm,多集中在7、8月,平均气温约14.1 ℃,全年无霜期约220 d,年均日照时数约2400 h。
1.2 样品采集
在试验区随机选取一个具有代表性的设施黄瓜种植地块,该地块在2011年以前的种植制度为冬小麦(Triticum aestivum)和夏玉米(Zea mays)轮作,此后转换为设施黄瓜栽培并延续至今,已出现明显的连作障碍问题,枯萎病发病严重且感病植株在大棚内表现出典型的斑块性分布特征。随机选择了4 个枯萎病发病严重的斑块(样方),在每个斑块内随机选取6 株枯萎病黄瓜植株,用铁锹将根部挖出,抖土法采集根际土壤样品,每株获得土样约30 g,6 株病株的根际土壤去除杂物、混合均匀作为一个混合土样;另外,在每个发病斑块周围随机选取6 株黄瓜健株利用同样方法采集根际土样,并制作混合土壤样品。最终,本试验获得同一地块内的病株和健株根际混合土壤样品各4 个,分别代表4 次重复。样品采集时间为2019年4月20日(春茬黄瓜),此时正处在黄瓜结果期,是植株养分积累和产量形成的关键时期,也是当地枯萎病主要发生时期。区内黄瓜每年种植两茬(春茬和秋茬),详细的栽培、管理和施肥细节见本课题组早前报道[16]。每个新鲜的混合土壤样品置于冰盒带回实验室后过1 mm 筛,等分成3 份:一份保存在—80 ℃冰箱用于后续的分子生物学分析,一份置于室内风干用于测定土壤理化性质,一份立即用于测定土壤矿质氮含量和生化性质。部分土壤理化和生化性质数据已在他刊发表[15],为避免数据重复使用,本文不再单独展示和叙述,仅用于相关性分析。
1.3 土壤亚硝态氮含量和亚硝酸盐氧化能力测定
土壤亚硝态氮采用2 mol·L—1KCl 溶液浸提(水土比5∶1),连续流动注射分析仪测定含量。土壤亚硝酸盐氧化潜势(potential nitrite oxidation rate,PNOR)测定参考Han 等[20]的方法并略有改进:将6 g 的新鲜土样加入到50 mL 含1 mmol·L—1NaNO2的磷酸盐缓冲液(Na2HPO40.2 g·L—1,NaH2PO40.2 g·L—1,pH 为7.4),而后于25 ℃下在震荡培养箱中暗培养24 h,转速为180 r·min—1。在培养0 h、6 h、12 h、18 h 和24 h 分别取2 mL 土壤悬液,离心(2000 r·min—1)后以N-(1-萘基)-乙二胺作显色剂,在520 nm 波长下测定NO2—-N浓度。拟合培养液中NO2—-N 消耗量和培养时间的线性关系,土壤PNOR 采用拟合得到的线性方程斜率表示。
1.4 土壤DNA 提取和荧光定量PCR
称取0.50 g 混匀土壤,采用MOBIO PowerSoil DNA 分离试剂盒,按照产品说明书上的步骤,提取土壤微生物总DNA。DNA 提取质量和纯度采用1%琼脂糖凝胶电泳和分光光度法检测。提取的微生物总DNA 溶解在50 μL 洗脱缓冲液中并保存于—20 ℃冰箱备用。
采用荧光定量PCR 方法测定土壤中Nitrobacter和Nitrospira的丰度,二者的扩增靶标分别为nxrA(编码亚硝酸盐氧化还原酶蛋白A 亚基)和nxrB(编码亚硝酸盐氧化还原酶蛋白B 亚基)基因,相应的引物对分别为F1norA/R2norA[21]和nxrB169F/nxrB-638R[22]。实时定量采用ABI 7500 仪器进行,每个土样重复3 次。PCR 扩增体系(20 μL)如下:16.4 μL ChamQ SYBR Color qPCR Master Mix,正、反引物各0.8 μL(5 μmol·L—1),2 μL DNA 模板。扩增条件如下:预变性95 ℃ 3 min,95 ℃ 5 s,58 ℃ 30 s,72 ℃ 1 min,40 个循环。扩增产物专一性验证和标准曲线制备参考Liu 等[18]的方法。nxrA和nxrB基因的扩增效率分别为95.81%和96.68%,标准曲线R2分别为0.9994和0.9998。Nitrobacter和Nitrospira的丰度分别采用每克干土中nxrA和nxrB基因拷贝数表示。
1.5 高通量扩增子测序和生物信息学分析
采用高通量扩增子测序方法评估黄瓜根际土壤Nitrobacter和Nitrospira的群落结构(Illumina Miseq PE300 平台)。以土壤微生物总DNA 为模板进行PCR 扩增,扩增靶标分别为nxrA和nxrB基因,所用引物对与荧光定量PCR 相同。采用随机选取的DNA 模板和不含DNA 模板的阴性对照进行初步试验以探索最佳的PCR 扩增条件。正式试验时PCR扩增体系(20 μL)为:4 μL FastPfu Buffer(5×),2 μL dNTPs(2.5 mmol·L—1),0.4 μL TransStart FastPfu DNA Polymerase,0.2 μL Bovine serum albumin,引物各 0.8 μL(5 μmol·L—1),10 ng 模板DNA 和11.2 μL ddH2O。PCR 扩增条件为:95℃预变性3 min,95 ℃ 30 s,55 ℃30 s,72 ℃ 45 s,37 个循环,最后72 ℃延伸10 min,10 ℃保温。每个样本均扩增3 次,经琼脂糖凝胶电泳验证后将3 次的扩增产物均匀混合,采用Agarose Gel DNA 试剂盒纯化,并使用NanoDrop2000 进行定量,最后将各样本等量的PCR 产物编码并送上海美吉生物医药科技有限公司进行高通量测序。测序获得的原始序列已全部上传至NCBI SRA 数据库(登录号PRJNA557592)。
参照Lu 等[23]的方法,对高通量测序下机原始序列进行质控过滤和双端拼接,而后采用QIIME 软件的标准流程进行生物信息学分析[24]。本研究共获得183 794 条nxrA基因高质量序列和154 226 条nxrB基因高质量序列,平均到每个土壤样本分别为22 974和19 278 条序列,序列平均长度分别为283 bp 和453 bp。对获得的这些高质量序列按照97%的相似度进行可操作分类单元(Operational Taxonomic Units,OTU)聚类,每个OTU 中数量最多的序列被挑选为代表性序列。利用MEGA 6.0 软件,将各OTU 代表性序列和早前文献已报道的参考序列按照最大似然法构建系统发育进化树(Bootstrap 重复抽样1000 次),根据进化树分枝(即基因序列不同的聚类)确定群落组成。nxrA基因参考序列和群落成员命名参照Wertz 等[25]、Poly 等[26]和Attard 等[21]的报道;nxrB基因参考序列和群落成员命名参照Pester 等[22]和Luo 等[27]的报道。所有高质量序列按最小样本序列数抽平后进行α 多样性和β 多样性分析。应用MOTHUR 软件计算群落α 多样性指数;利用Bray-Curtis 距离主坐标分析(PCoA)比较病株和健株间微生物群落结构差异;通过相似度分析(ANOSIM)检验处理间微生物群落结构差异的显著性;采用CANOCO 5.0 软件对土壤理化性质和微生物群落结构的关系进行冗余分析(RDA),各理化因子的显著性采用Monte Carlo 检验[15]。
1.6 数据处理
试验数据计算和图表绘制在Microsoft Excel 2016 和Sigmaplot 12.0 软件上进行,处理间差异显著性比较采用独立样本T检验(P<0.05)。图表中试验结果采用平均值±标准差来表示(n=4)。不同数据间的相关性分析采用常见的一元回归模型进行(斯皮尔曼线性相关)。微生物丰度采用常用对数转换表示。
2 结果与分析
2.1 土壤亚硝态氮含量、亚硝酸盐氧化潜势和亚硝酸盐氧化微生物丰度
如表1所示,健株和病株根际土壤亚硝态氮含量无显著差别,但病株根际亚硝酸盐硝化潜势较健株高出约1 倍(P<0.001)。就不同亚硝酸盐氧化微生物(nitrite-oxidizing bacteria,NOB)的丰度而言,病株根际Nitrobacter丰度显著高于健株(P=0.020),但二者的Nitrospira丰度无显著差异。
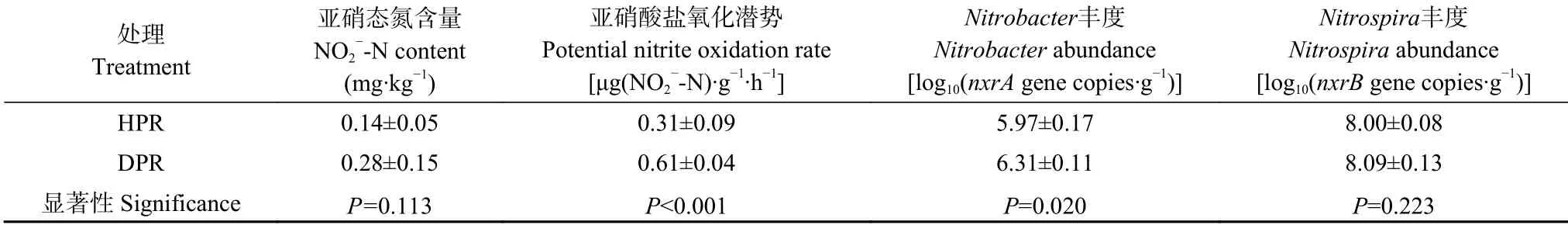
表1 黄瓜健康植株(HPR)和感染枯萎病植株(DPR)根际土壤亚硝态氮含量、亚硝酸盐氧化潜势和亚硝酸盐氧化微生物(NOB)丰度Table 1 Soil NO2—-N contents,potential nitrite-oxidizing rates and nitrite-oxidizing bacteria(NOB)abundances in rhizosphere soil of healthy plants(HPR)and Fusarium wilt-diseased plants(DPR)of cucumber
2.2 土壤Nitrobacter 的群落多样性和组成结构
如表2所示,健株和病株根际间Nitrobacter群落α多样性无显著差异。然而,健株和病株Nitrobacter群落组成差异明显,各有39 个非共享OTU(图1a)。PCoA 分析和ANOSIM 测试进一步证明,二者间Nitrobacter群落结构呈现显著差异(P<0.05)(图1c)。
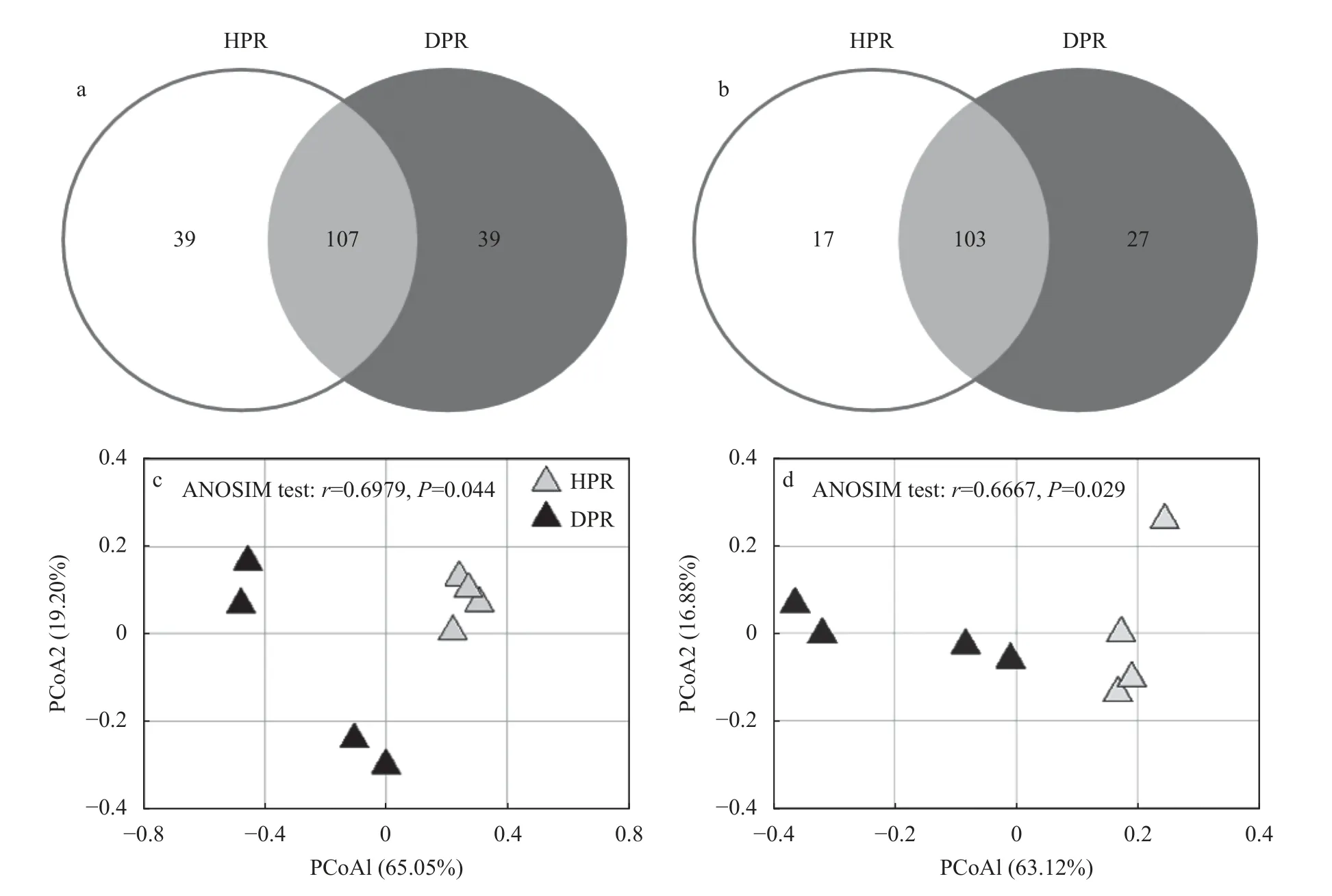
图1 黄瓜健康植株(HPR)和感染枯萎病植株(DPR)根际土壤硝化杆菌(Nitrobacter)群落组成(a)和结构(c)以及硝化螺菌(Nitrospira)群落组成(b)和结构(d)Fig.1 Community composition(a)and structure(c)of Nitrobacter as well as community composition(b)and structure(d)of Nitrospira in rhizosphere soil of healthy plants(HPR)and Fusarium wilt-diseased plants(DPR)of cucumber
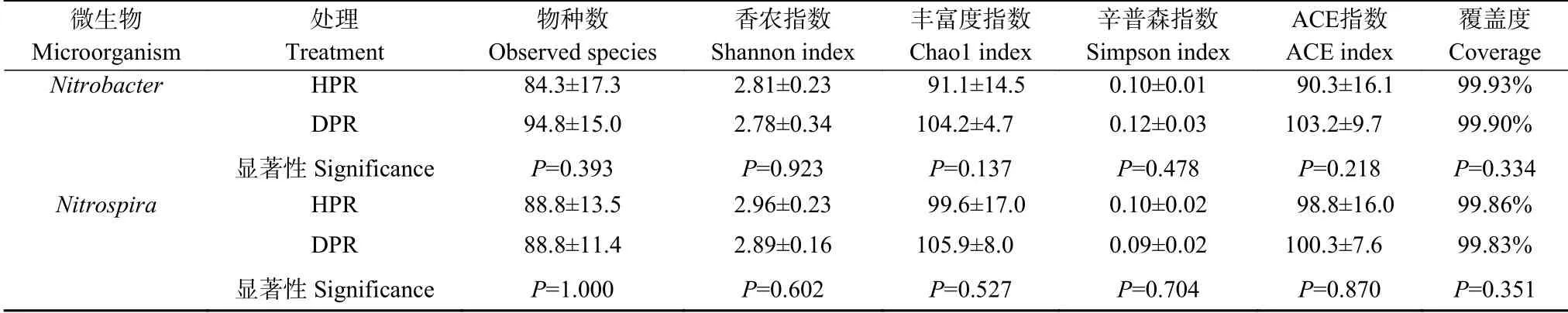
表2 黄瓜健康植株(HPR)和感染枯萎病植株(DPR)根际土壤硝化杆菌(Nitrobacter)和硝化螺菌(Nitrospira)群落α 多样性指数Table 2 The α diversity indexes of Nitrobacter and Nitrospira communities in rhizosphere soil of healthy plants(HPR)and Fusarium wilt-diseased plants(DPR)of cucumber
通过序列聚类,Nitrobacter群落中共获得185 个OTU,其中有34 个OTU 的平均相对丰度超过1%,这34 个OTU 共占据约95%的总回收序列。将这些优势OTU 的代表性序列和前人已验证报道的Nitrobacter nxrA基因参考序列一起构建系统发育进化树(图2),发现黄瓜根际Nitrobacter群落成员包括
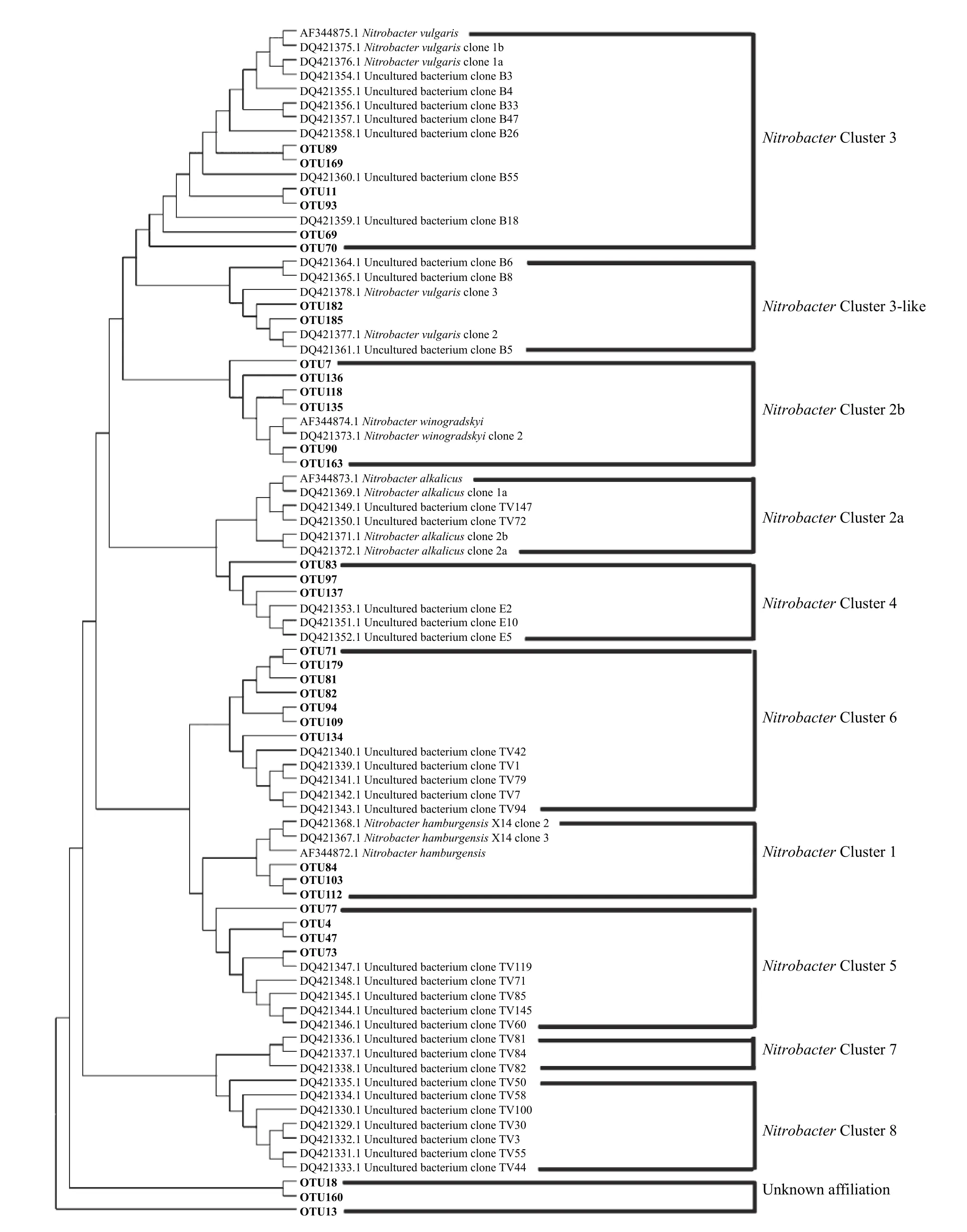
图2 基于OTU 代表性序列和参考序列的Nitrobacter nxrA 基因系统进化树Fig.2 Phylogenetic tree of Nitrobacter nxrA genes based on representatives of OTUs detected in this study and representative sequences of major Clades
NitrobacterCluster 3、NitrobacterCluster 3-like、NitrobacterCluster 2b、NitrobacterCluster 4、NitrobacterCluster 6、NitrobacterCluster 1 和NitrobacterCluster 5。对这些群落成员统计分析发现,Nitrobac- terCluster 2b 平均相对丰度在健株根际显著高于病株根际,而NitrobacterCluster 6 和NitrobacterCluster 5 则与之相反(P<0.05)(图3a)。
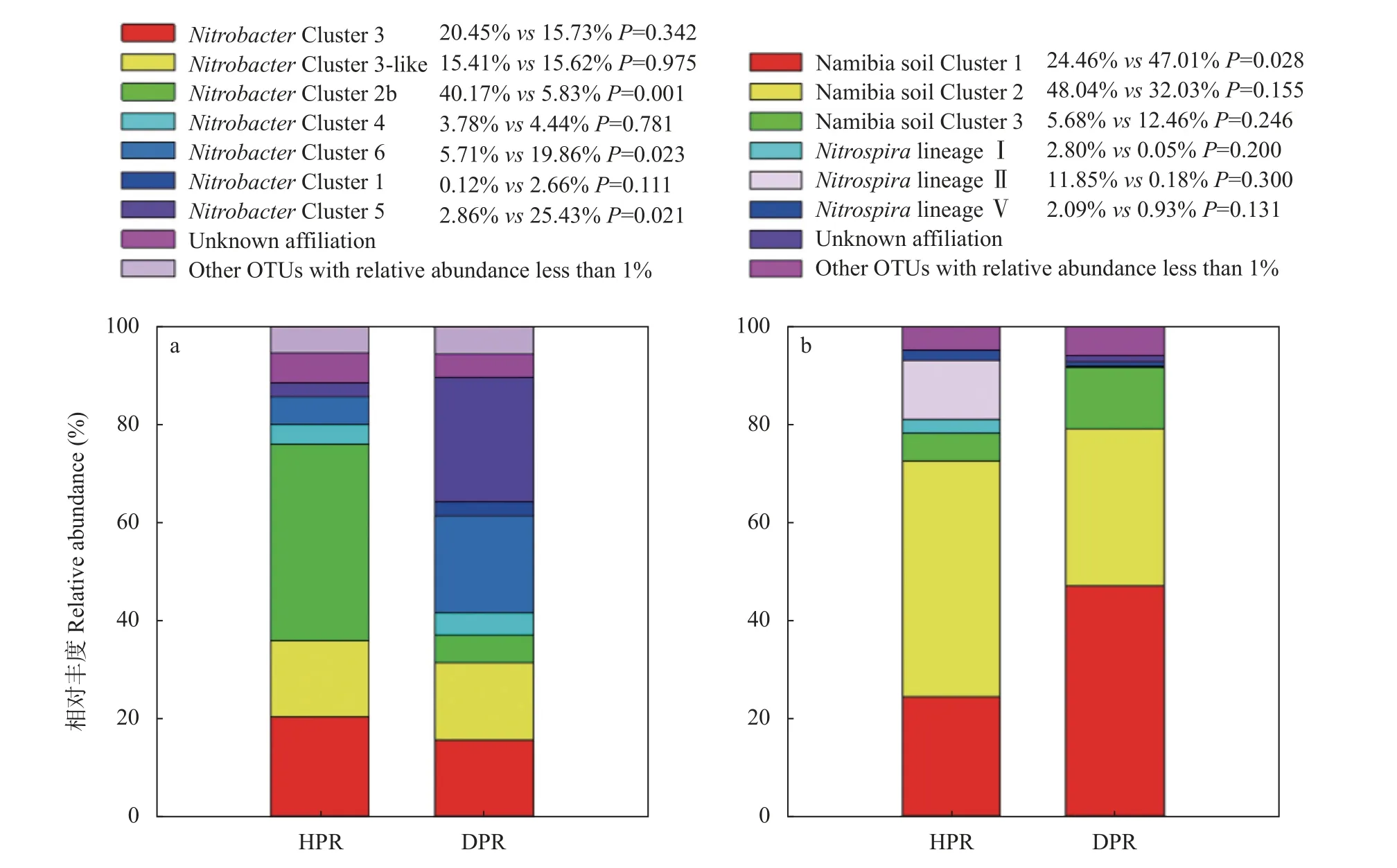
图3 黄瓜健康植株(HPR)和感染枯萎病植株(DPR)根际土壤硝化杆菌(Nitrobacter,a)和硝化螺菌(Nitrospira,b)群落成员平均相对丰度比较Fig.3 Comparisons on the relative abundances of phylogenetic Nitrobacter(a)and Nitrospira(b)groups in rhizosphere soil of healthy plants(HPR)and Fusarium wilt-diseased plants(DPR)of cucumber
2.3 土壤Nitrospira 的群落多样性和组成结构
健株和病株根际间Nitrospira群落α 多样性无显著差异(表2)。然而,病株根际Nitrospira群落中存在更多的特有OTU(图1b)。PCoA 分析和ANOSIM测试显示健株和病株根际间Nitrospira群落结构差异显著(P<0.05)(图1d)。
对于Nitrospira群落,通过序列聚类共得到147个OTU,其中33 个OTU 平均相对丰度超过1%,合计占据总回收序列约95%。这些优势OTU 的代表性序列和已有的Nitrospira nxrB基因参考序列的系统发育进化树如图4所示,黄瓜根际Nitrospira群落成员包括Namibia soil Cluster 1、Namibia soil Cluster 2、Namibia soil Cluster 3、NitrospiralineageⅠ、NitrospiralineageⅡ和NitrospiralineageⅤ。其中,Namibia soil Cluster 1 和Namibia soil Cluster 2 为优势群落成员。经计算发现,病株根际Namibia soil Cluster 1的平均相对丰度显著超出健株根际约92.19%,但健株根际NitrospiralineageⅡ平均相对丰度约为病株根际的66 倍(P<0.05)(图3b)。
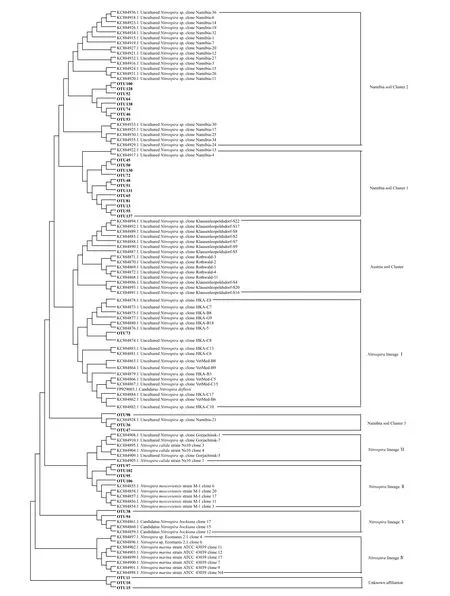
图4 基于OTU 代表性序列和参考序列的Nitrospira nxrB 基因系统进化树Fig.4 Phylogenetic tree of Nitrospira nxrB genes based on representatives of OTUs detected in the study and representative sequences of major Clades
2.4 冗余分析和相关分析
冗余分析表明,土壤理化因子共解释了约84.37%的处理间Nitrobacter群落结构差异,RDA1和RDA2 的解释量分别为64.85%和19.52%(图5a)。土壤亚硝态氮含量是影响Nitrobacter群落结构最重要的理化指标(r=0.912,P=0.037),其次是硝态氮含量(r=0.853,P=0.016),且二者均达到统计显著水平;而其余土壤理化因子对Nitrobacter群落结构影响不显著。同时,土壤理化因子共解释约81.34%的处理间Nitrospira群落结构差异,RDA1 和RDA2 的解释量分别为65.63%和15.71%(图5b)。在所有供试的土壤理化因子中,亚硝态氮含量是影响Nitrospira群落结构的最重要指标(r=0.887,P=0.019),其次是pH(r=0.771,P=0.027),且二者均达统计显著水平;而其余土壤理化因子并不能显著影响Nitrospira群落结构。
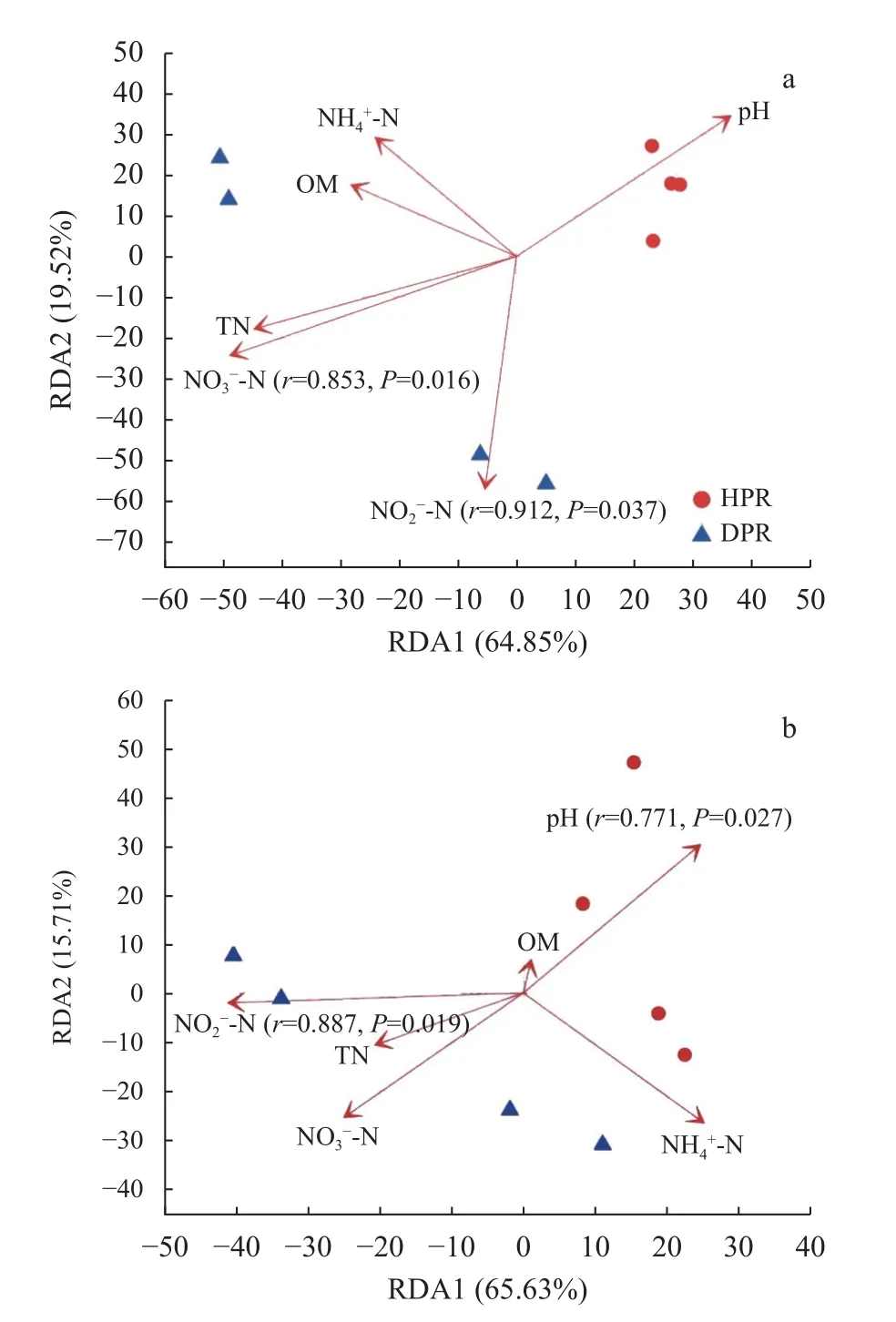
图5 黄瓜健康植株(HPR)和感染枯萎病植株(DPR)根际土壤硝化杆菌(Nitrobacter,a)和硝化螺菌(Nitrospira,b)群落结构与土壤理化性质的冗余分析Fig.5 Redundancy analyses between community structures of Nitrobacter(a)and Nitrospira(b)and soil physicochemical properties of healthy plants(HPR)and Fusarium wilt-diseased plants(DPR)of cucumber
线性回归分析证明,Nitrobacter丰度与土壤硝态氮含量和亚硝酸盐氧化潜势显著正相关(P<0.05),而与土壤基础呼吸量显著负相关(P<0.05);而Nitrospira丰度与所有供试土壤的理化和生化性质均无显著关系(图6)。就Nitrobacter的各群落成员而言,NitrobacterCluster 2b 的平均相对丰度与土壤硝态氮含量、亚硝酸盐氧化潜势和全氮含量显著负相关(P<0.05),而与土壤基础呼吸量和pH 显著正相关(P<0.05);NitrobacterCluster 6 的平均相对丰度与土壤硝态氮含量和亚硝酸盐氧化潜势显著正相关(P<0.05),而与土壤基础呼吸量显著负相关(P<0.05);NitrobacterCluster 5 的平均相对丰度与土壤基础呼吸量和pH 显著负相关(P<0.05)。Nitrospira的各群落成员中,Namibia soil Cluster 1 的平均相对丰度仅与土壤硝态氮含量显著正相关(P<0.05);NitrospiralineageⅡ的平均相对丰度仅与土壤pH 显著正相关(P<0.05)。
3 讨论
作为土壤生态系统的核心成员,微生物是众多关键土壤生物学过程的直接执行者,阐明土壤功能微生物组的变化特征有助于预测不同管理实践下土壤生态功能(服务)的响应模式[28-29]。在作物连作障碍机理研究中,早前学者将注意力更多地集中在土壤总的微生物群落特征变化,而功能微生物组的研究常被忽视。传统的两步硝化理论认为氨氧化过程是土壤氮素转换的限速步骤,但越来越多的研究已经证实,在土壤氮素周转过程中亚硝酸盐氧化与氨氧化具有同等功能重要性[30-32]。在前期研究的基础上[15-16],本研究聚焦于Nitrobacter和Nitrospira这两种陆地生态系统中主导型NOB,结合设施连作生产系统土传病害滋生这一热点问题,比较了病株和健株根际间两种NOB 丰度和群落多样性及结构差异。功能评估显示,病株根际具有更高的亚硝酸盐氧化潜势,这应归因于更高的Nitrobacter丰度(表1)。我们也确实发现,亚硝酸盐氧化潜势与Nitrobacter而非Nitrospira的丰度具有显著的正相关关系(图6),说明Nitrobacter是土壤亚硝酸盐氧化的主要功能执行者。前人研究[33-34]揭示Nitrobacter和Nitrospira具有典型的生态位分异和截然不同的生活史对策,Nitrobacter是r-对策者,偏好富营养环境和高碳、氮供应,对底物的亲和力相对较低;而Nitrospira为k-对策者,底物亲和力较高,在寡营养环境中扮演更强的功能角色。集约化设施连作生产系统中,长期高氮肥投入可能驱使Nitrobacter功能性支配着亚硝酸盐氧化过程[35]。此外,病株较健株根际富集更多Nitrobacter的原因可能是发病植株生长受阻,对养分的吸收能力变差,根际范围累积更多的养分,形成了局部的富营养环境[8,36],有利于Nitrobacter的生长,也带来了更高的亚硝酸盐氧化潜势。
Nitrobacter和Nitrospira的群落结构在病株和健株根际土壤间存在显著差异(表1 和图1),说明NOB的群落结构关联着土壤亚硝酸盐氧化性能。微生物群落内部常常具有功能冗余,单一或特定条件下功能的发挥更多依赖于少数的群落内部成员,即活性群落成员[29],对亚硝酸盐氧化细菌而言同样如此[37]。对于Nitrobacter群落,NitrobacterCluster 6 和NitrobacterCluster 5 的平均相对丰度在病株根际均显著高于健株根际,特别是NitrobacterCluster 6 的相对丰度与土壤亚硝酸氧化潜势表现出显著的正相关关系(图6),预示其为潜在的功能活性成员。由于迄今为止对NitrobacterCluster 6 这一Nitrobacter nxrA基因聚类尚无任何经富集、纯化得到的代表性菌株,因此依然限制了对其环境关联性和行为特征的认识。在Nitrospira群落中,尽管Namibia soil Cluster 1 的平均相对丰度在病株根际更高,但并未观察到其与亚硝酸盐氧化潜势具有显著相关性,这一定程度上支持了早前学者的报道,即Namibia soil Cluster 1 在旱地土壤亚硝酸盐氧化过程中可能并非是一个关键的功能执行者[18]。此外,健株根际中NitrospiralineageⅡ平均相对丰度较病株根际大幅度降低,可能与病株根际具有更低的pH 有关(图6)[15]。Zhang 等[30]报道证明NitrospiralineageⅡ的代表性菌株Nitrospira mo-scoviensis的相对丰度与土壤pH 呈显著正相关关系,暗示偏酸环境不利于NitrospiralineageⅡ的生长。
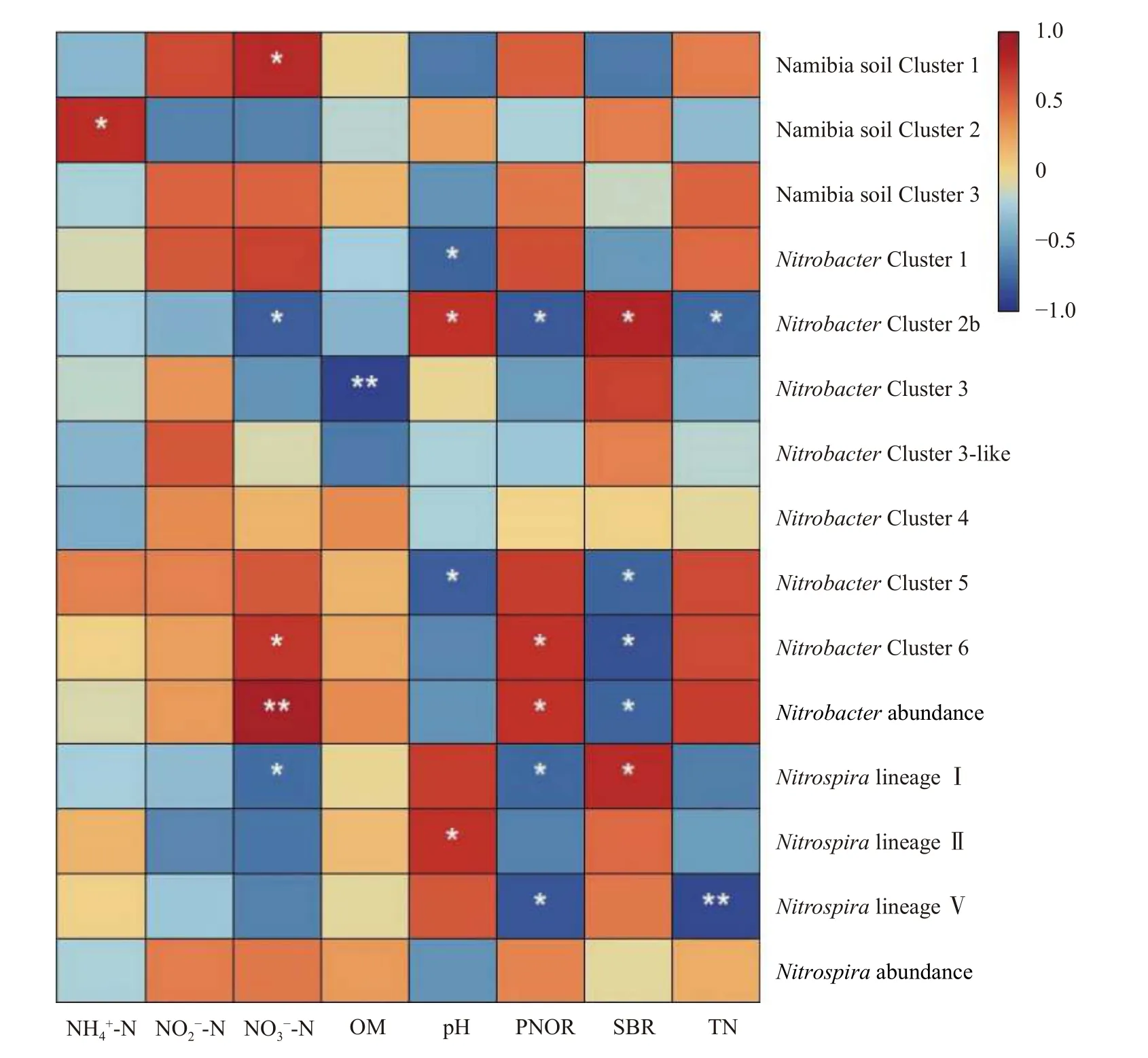
图6 土壤硝化杆菌(Nitrobacter)和硝化螺菌(Nitrospira)及其群落成员相对丰度与土壤性质的相关分析Fig.6 Correlations between the abundances of Nitrobacter and Nitrospira and average relative abundances of their community members and soil properties
冗余分析证实,土壤亚硝态氮含量是影响Nitrobacter和Nitrospira群落结构最重要的土壤因子(图5)。这也符合我们的预期,因为亚硝态氮是亚硝酸盐氧化微生物功能执行的底物(通过氧化亚硝态氮获取能量),而不同的群落成员由于自身的生理和代谢差别对底物有效性存在不同的适应性和功能差异[18]。本研究中,尽管病株和健株根际亚硝态氮含量并无统计学差异(P=0.113),但病株根际亚硝态氮含量确实相对高于健株根际(表1)。结合前期研究结果,有两点必须要指出的是:1)病株和健株根际土壤微生物氨氧化能力和亚硝酸盐氧化能力表现出“倒挂”现象,即病株根际具有低的氨氧化潜势,但有高的亚硝酸盐氧化潜势,而健株恰好与之相反,这种现象的内在机制仍需进一步研究。相较于经典的两步硝化理论,已有学者报道[38-39]了全程氨氧化细菌(complete ammonia-oxidizing bacteria,CAOB)的存在,此类细菌可以同时执行氨氧化和亚硝酸盐氧化两个步骤。由于目前已知的CAOB 均隶属于NitrospiralineageⅡ[40-41],特别是本研究中我们也观察到NitrospiralineageⅡ的平均相对丰度在处理间存在显著差异(图3),因此需要探索CAOB 在设施连作土壤硝化过程中的功能角色。2)Wei 等[42]研究发现,随着土传致病菌青枯劳尔氏菌(Ralstonia solanacearum)的入侵,盆栽番茄根际细菌群落发生明显改变,其中与土壤硝化过程相关的微生物(Nitrospirae)相对丰度也发生变化。相似的现象在露地和设施番茄种植中也被发现[7]。组合前期数据[15]和本研究相关测定结果,同样观察到黄瓜根际尖孢镰刀菌(Fusariumoxysporum)和Nitrobacter丰度存在极显著正相关关系(r=0.905,P=0.002,n=8)。这些结果暗示土传病原菌富集可能通过改变相关功能微生物群落影响了作物根际土壤硝化过程和强度,但其内在机制尚需进一步研究。
4 结论
设施连作枯萎病黄瓜植株和健康植株在根际亚硝酸盐氧化微生物(Nitrobacter和Nitrospira)丰度和群落结构上存在显著差异,这直接导致了病株和健株根际土壤亚硝酸盐氧化能力的不同,表明集约化设施蔬菜连作生产中病害土壤的功能属性变化,其微生物生态学机制须予以更多关注。
