折耳根提取液对番茄灰霉病菌的抑菌活性分析
2022-11-15胡永静叶欣悦
胡永静,叶欣悦,须 文
(贵州大学农学院园艺系,贵州 贵阳 550025)
番茄是主要的设施栽培蔬菜作物之一,果实中含有大量的矿质元素、维生素C、番茄红素等营养物质,具有抗衰老、防止动脉硬化、减少癌症的发生等作用[1]。灰霉病由灰葡萄孢菌(Botrytis cinerea)所致,是露地、保护地蔬菜作物上常见且比较难防治的一种真菌性病害,属于低温高湿型病害,其病原菌适宜的生长温度为25 ℃左右,湿度持续90%以上时为病害的高发期[2]。同时也是一种典型的气传病害,可随着空气、水流以及农事作业传播,且传播的速度比较快。灰霉病在番茄幼苗期和成株期均可发生,表现在叶、花、果实、茎等部位,花期是其发生的高峰期,同时也是防治的最佳时期。近几年来,灰霉病成为保护地栽培较重的病害之一。番茄在低温高湿条件下极易患灰霉病,不管在苗期还是成株期均可发病,在成株期主要为害番茄果实,发生时间早,持续时间长,易造成烂果[3];苗期主要为害番茄植株的叶片、茎、叶柄等,易造成叶片和茎的腐烂。因此,番茄灰霉病是造成保护地番茄减产的主要原因之一[4],一般导致番茄减产20%~30%,严重时减产50%以上[5]。目前生产上番茄灰霉病主要以农药防治为主,但存在着农药残留及环境污染的问题。在防治上多采用速克灵等化学药剂喷雾,在连续使用的情况下,病菌逐渐产生了抗药性,防效逐年下降,成本增加。因此,近年来国内大量学者在番茄品种选育、栽培技术管理、化学防治、生物防治等领域进行大量研究,但因为缺乏抗病品种和病原菌抗药性增强等原因,导致番茄灰霉病的防治还是没有得到更好的解决。因此,开展生物防治相关研究将成为灰霉病防治的趋势和方向。
折耳根(蕺菜)是一种重要的药食兼用蔬菜,在贵州各地均有种植。折耳根提取液中的多种活性成分具有较强的抗菌特性[6]。折耳根提取液中抑菌物质主要为折耳根素及月桂醛等挥发油成分, 医学研究表明,折耳根素对卡他球菌、金黄色葡萄球菌、白色葡萄球菌、肺炎球菌、流感杆菌等具有明显的抑制作用,对伤寒杆菌、钩端螺旋体也有较强的抑制作用[7-8],折耳根素与甲氧苄胺嘧啶(TMP )配伍还有协同作用,抑菌效果显著增强[9]。
目前鲜少有文献报道折耳根提取液对番茄灰霉病的应用及防治情况。本试验以番茄幼苗为活体接种试材,通过喷施折耳根提取液及接种灰霉病菌,观察幼苗表型和测定番茄叶片的灰霉生长量等指标,为进一步分析折耳根提取物对番茄灰霉病的抑制作用及提高番茄产量和品质提供科学依据,也为进一步研究折耳根的有效利用和增强生产上番茄对灰霉病的抗性提供一定的理论依据。
1 材料和方法
1.1 试验材料
供试材料为番茄(Solanum lycopersicum L. cv.浙杂809),种子购于浙江浙农种业有限公司。供试番茄灰霉菌菌种由浙江大学蔬菜研究所师恺教授惠赠。
1.2 试验设计
试验在贵州大学农学院园艺专业基础实验室进行。试验分为2部分:第一部分是在番茄植株上进行抑菌活性鉴定试验,即当番茄长到4叶1心时在番茄幼苗上进行抑菌活性鉴定试验,设4个处理,每处理20株番茄幼苗,各处理详见表1。第二部分是体外抑菌试验,即采用培养基平板接种方法,设2个处理,每处理9个培养皿,试验设计如表2所示。各部分试验每个处理重复3次。

表1 番茄植株抑菌活性鉴定试验设计

表2 折耳根提取液的体外抑菌试验设计
1.3 试验方法
1.3.1 折耳根提取液配制方法
折耳根提取液配制方法:选取新鲜折耳根的地下茎,先用自来水洗净,再用蒸馏水冲洗3次,然后用吸水纸吸干茎段外面附着的水分。准确称取折耳根地下茎10.0 g,置于研钵中研磨,研磨时可加入少量的石英砂,有助于研磨,随后加入浓度为70%的乙醇200 mL,倒入250 mL的烧瓶中,于80 ℃水浴锅中回流浸提6 h,然后于4 000 r/min条件下离心20 min,取上清液置于250 mL烧瓶中,利用旋转蒸发仪将乙醇全部蒸发掉,最后剩下10 mL提取液用蒸馏水稀释定容至300 mL并置于4 ℃的冰箱中保存备用。
1.3.2 番茄灰霉病菌培养及病菌悬浮液配制
番茄灰霉病菌的培养采用V8培养基(含体积比为36% V8蔬菜汁、2%琼脂、0.2% CaCO3)在20~25 ℃避光条件下培养。待灰霉孢子长满培养皿中的培养基后约10 d,将培养基上的菌丝块用组培刀刮下后放入悬浮液(Tpeptonel 2%,Maltose 4%)中并剧烈涡旋以释放孢子,再用4层纱布过滤,取含有灰霉菌孢子的滤液用血球计数板在光学显微镜下进行计数,并用悬浮液调节孢子浓度到2×105spores/mL。
1.3.3 在番茄植株上进行抑菌活性鉴定试验
用稀释500倍的折耳根提取液,于植株叶面均匀喷施,每处理20株番茄。24 h后,用浓度为2×105spores/mL的番茄灰霉病菌孢子悬浮液均匀喷施叶面,即接种于番茄植株上。
1.3.4 番茄灰霉病菌的体外抑菌活性鉴定方法
首先在超净工作台上配制培养基,采用V8培养基在直径9 cm的培养皿中倒板,待培养基冷却后在一半培养基的正中位置放入1片直径1 cm的无菌滤纸片,然后在滤纸片上按照试验设计分别滴加10 µL的蒸馏水和折耳根提取液(未用滤膜器过滤),然后在培养基的另一半正中位置放入1片直径1 cm的无菌滤纸片,无菌滤纸片的下表面预先轻轻蘸取灰霉菌的菌丝体,保证下表面被均匀覆盖1层薄薄的灰霉菌孢子,而且下表面朝上置于培养基的另一半正中位置。将培养基在20~25 ℃避光条件下培养5 d后观察体外抑菌试验效果。
1.4 调查项目及方法
1.4.1 灰霉病发病率和病情指数分析
番茄植株接种灰霉病菌3 d后,观察不同处理的番茄叶片灰霉病的发病情况,记录发病叶片数和发病症状。发病症状按严重程度由轻到重依次记为0、I、II、III、IV 5个等级,分级标准为:0级,叶片正常;I级,叶片主叶尖处可见少数病斑;II级,叶片叶尖及主叶脉处分布病斑;III级,叶片叶尖有皱缩,叶片多部位分布病斑;IV级,叶片叶尖等部分有明显皱缩,叶片全片叶可见病斑分布。每个处理至少统计50片番茄小叶,计算发病率和病情指数,计算方法:发病率=(染病叶片数/调查总叶片数)×100%;病情指数=∑(各级叶片数×该级指数)/(总叶片数×最高级别数);相对防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.4.2 番茄叶片中灰霉生长量测定
PCR反应条件为:95 ℃ 3 min预变性;95 ℃变性10 s,58 ℃退火45 s,40个循环。在PCR循环反应完成之后,熔解曲线表明生成的P C R产物均为单一物质。以灰霉菌(B.cinerea)的Actin基因表达水平为指标,采用qRT-PCR测定接种后番茄叶片中灰霉生长量的变化情况。B. cinerea的Actin基因前引物序列为:ACTCATATGTTGGAGATGAAGCGCAA,后引物序列为:AATGTTACCATACAAATCCTTACGGACA。以番茄Actin基因表达水平作为内参。内参基因Actin的荧光值作为计算时的内标,相对基因表达水平的计算参照Livak[10]的方法计算。
1.4.3 叶片叶绿素含量测定
番茄植株接种灰霉病菌3 d后剪取叶片样品测定叶绿素含量,参照Arnon等[11]的方法测定。用直径为1 cm的打孔器取0.3 g叶圆片加10 mL 80%丙酮遮光浸泡提取,直至肉眼观察叶片完全变白为止。浸提液4 000 g离心10 min,取上清液1 mL,再加入2 mL 80%丙酮稀释后,用岛津紫外可见分光光度仪(SHIMADZU UV-2401PC)分别于663、645 nm和445.5 nm处测定吸光值,且吸光值为0.2~0.8时测定值有效。
1.4.4 脂氧合酶LOX活性测定
脂氧合酶(LOX)活性的测定参照陈昆松等[12]和姚先锋等[13]的方法进行。
1.4.5 灰霉病菌体外抑菌试验中菌丝生长情况测定
从番茄灰霉菌在培养基中的长势及扩散半径大小来判断菌丝生长情况。
1.5 数据分析
利用Excel 2010、DPS和Origin软件进行试验数据的统计、整理、分析和作图。
2 结果与分析
2.1 番茄叶片表型
在番茄植株上进行的抑菌试验中,接种病害3 d后,叶片表型显示:番茄植株接种灰霉菌后叶片尖端有部分萎蔫的表现,叶背面可见分散的病斑,但较少。折耳根提取液预处理的叶片发病比蒸馏水预处理的对照叶片发病病状轻一些。
2.2 灰霉病发病率和病情指数
如图1A所示,在接种灰霉病菌3 d后,折耳根提取液预处理并接种灰霉菌处理组(H.houttuyniae+B. cinerea)的叶片灰霉病发病率为81.5%,显著低于蒸馏水预处理并接种灰霉菌处理组(H2O+B. cinerea),表明折耳根提取液对番茄灰霉病的发生具有一定的防效。病情指数如图1B所示,折耳根提取液预处理并接种灰霉菌处理组(H. houttuyniae+B. cinerea)的病情指数为3.0,显著低于蒸馏水预处理并接种灰霉菌处理组(H2O+B. cinerea)的4.2病情指数,相对防治效果达到28.6%。
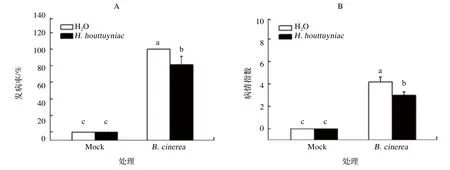
图1 灰霉菌接种处理第3天的番茄发病情况
2.3 叶片灰霉病菌生长量
灰霉Actin的相对表达量可以准确迅速地反映出番茄叶片中灰霉病菌相对含量的多少,可作为番茄发病轻重的标志。如图2所示,在接种病菌3 d后,“H. houttuyniae+B. cinerea”处理组的番茄叶片与“H2O+B. cinerea”间的灰霉生长量差异显著,当“H2O+B. cinerea”处理组叶片灰霉Actin的相对表达量为1.000时,“H. houttuyniae+B. cinerea”处理组的降为0.575左右,显著低于“H2O+B. cinerea”处理组,即灰霉生长量比对照几乎减少了一半。由此表明,折耳根提取液对番茄灰霉病菌的生长有抑制作用、叶片发病程度减轻。
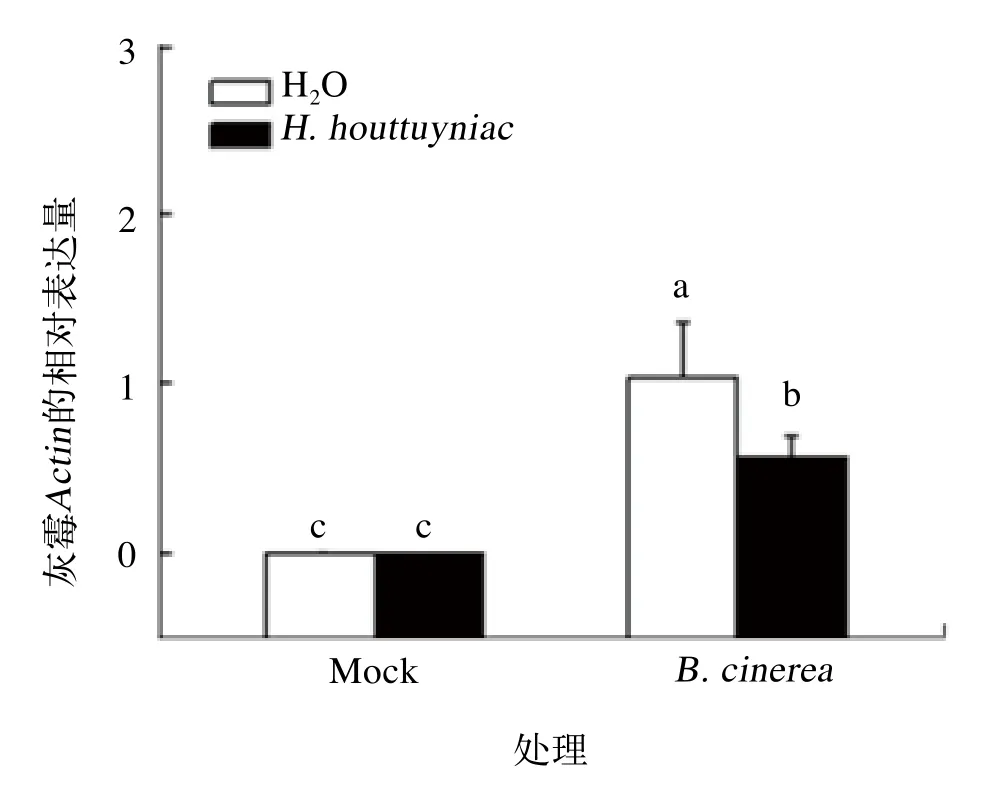
图2 折耳根提取液预处理后番茄灰霉菌接种处理第3天的番茄叶片灰霉生长量的变化
2.4 叶片叶绿素含量
灰霉病菌侵染后叶片细胞逐渐发病乃至死亡,在此过程中伴随着叶绿素的降解。如图3所示,在接种灰霉病菌3 d 后,“H. houttuyniae+B. cinerea”处理组与“H2O+B. cinerea”处理组间的番茄叶片叶绿素a含量分别为4.96、 3.97 mg/L(图3A),叶绿素b的含量分别为2.23、1.71 mg/L(图3B),叶绿素a含量均显著低于没有接种病原菌的对照组“H2O+Mock”和“H. houttuyniae+Mock”,而叶绿素b含量显著低于对照组“H2O+Mock”。说明灰霉病菌侵染会导致叶片的叶绿素降解、含量下降,折耳根提取液的应用有利于缓解发病番茄叶片的叶绿素降解。
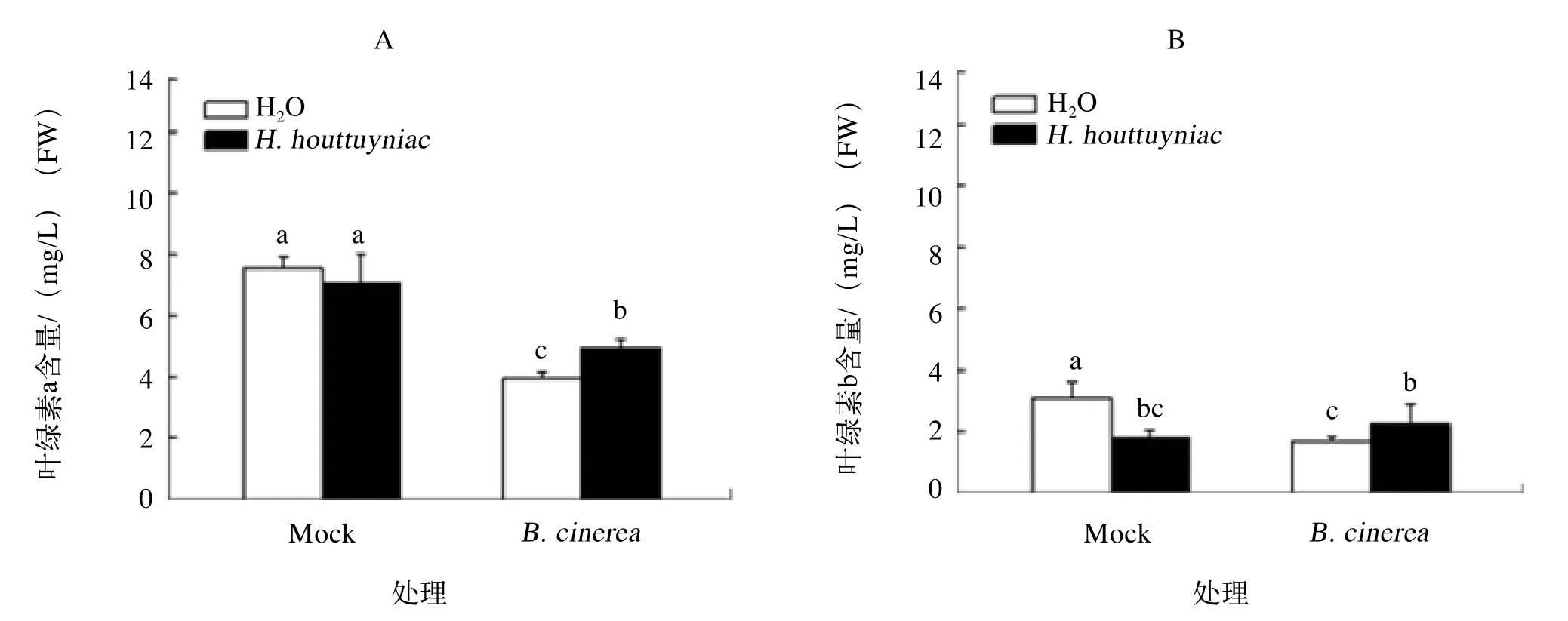
图3 番茄灰霉菌接种处理第3天的番茄叶片叶绿素含量的变化
2.5 脂氧合酶LOX活性
脂氧合酶LOX为茉莉酸(JA)抗性信号路径中的一个关键酶,可表征JA信号路径抗性因子的活性。如图4所示,不管是番茄叶片接种还是不接种灰霉病菌,折耳根提取液处理均导致叶片LOX酶活力显著上升。“H. houttuyniae+B. cinerea”处理组的叶片LOX活性为13.52 OD/g(FW),显著高于“H2O+B. cinerea”处理组的10.92 OD/g(FW),表明折耳根提取液处理有助于激活JA抗性信号路径,从而增强番茄对灰霉病的抗性。
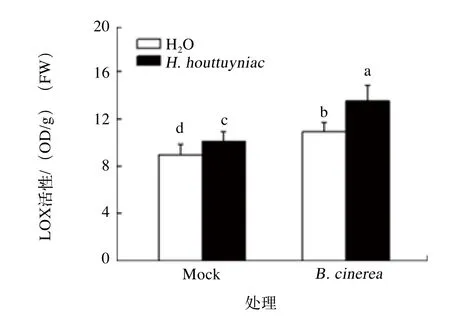
图4 番茄接种灰霉病原菌后叶片LOX活性变化
2.6 折耳根提取液对番茄灰霉病菌的体外抑菌活性的影响
如图5所示,接种了同样大小灰霉菌菌丝体的培养基上灰霉菌都有所生长,从番茄灰霉菌的长势及扩散程度来看,在接种灰霉病菌的培养基中滴加折耳根提取液后灰霉病菌菌丝生长范围小于滴加蒸馏水的对照,表明折耳根提取液对体外培养的番茄灰霉病菌生长有抑制作用。
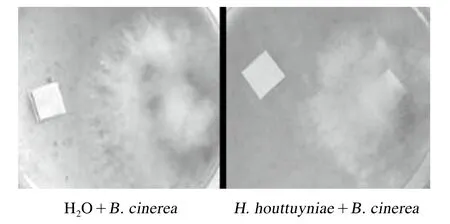
图5 折耳根提取液对番茄灰霉菌的体外抑菌活性鉴定
3 结论与讨论
本文探讨了折耳根提取液预处理对番茄叶片灰霉菌的生长和体外培养的灰霉菌生长的影响。在接种病害3 d后,折耳根提取液处理的叶片发病比蒸馏水处理的叶片轻,发病率和病情指数分别为81.5%和3.0左右,相对防治效果达到28.6%;而且番茄叶片中的灰霉Actin相对表达量仅为0.575;折耳根提取液处理的叶片叶绿素a、b含量分别为4.96、2.23 mg/L,分别为蒸馏水处理的1.25倍和1.30倍;接种灰霉菌后,折耳根提取液处理的叶片LOX活性为13.52 OD/g(FW),而蒸馏水处理的仅为10.92 OD/g(FW);体外抑菌圈试验表明,折耳根提取液处理后灰霉菌的长势及扩散程度小于蒸馏水对照的处理,表明折耳根提取液对体外培养的灰霉病菌也有抑制作用。但是,折耳根提取液对番茄灰霉菌的抑菌作用机制是什么,番茄对灰霉病的基础抗性的提高是否与JA抗性路径的增强有关。本试验结果有待进一步验证,相关研究有待进一步开展。
