基于高效液相色谱法对淡豆豉发酵过程中6种异黄酮含量的动态分析
2022-11-15曹冬英谢思静曾思婷隋利强徐伟福建中医药大学药学院福建省中药炮制技术传承基地福州350122
曹冬英,谢思静,曾思婷,隋利强,徐伟(福建中医药大学药学院,福建省中药炮制技术传承基地,福州350122)
淡豆豉,又名“香豉”“豆豉”“豉”,为豆科植物大豆Glycine max(L.)Merr.的干燥成熟种子(黑豆)的发酵加工品[1]。其味苦、辛,性凉,归肺、胃经,有解表、除烦、宣发郁热的作用,在临床上主要用于感冒、寒热头痛、烦躁胸闷、虚烦不眠等症[2]。
淡豆豉历代炮制方法有烧制、熬制、炒制、清酒制、醋蒸制、炒焦法、盐醋拌蒸法以及清蒸法等[3-6]。2020年版的《中国药典》收载的淡豆豉发酵方法为青蒿、桑叶加水煎煮,煎液拌入大豆,大豆吸汁后蒸透,晾凉,再用青蒿、桑叶渣闷制使发酵至黄衣上遍,除去药渣之后再进行闷制直到香气溢出,再略蒸,干燥即得淡豆豉成品[1]。
淡豆豉在不同地区炮制方法略有差异,《全国中药炮制经验与规范集成》(2017年版增修本)[7]中一共收载了42 种关于淡豆豉的炮制方法,其中24 种方法是直接发酵不经过闷制,18 种方法经过发酵后再闷制。《全国中药饮片炮制规范辑要》(2016年版)[8]中则收载了20 种淡豆豉的炮制方法,其中,直接发酵和经过发酵后再闷制的方法各10 种。关于淡豆豉发酵过程中再闷制工艺合理性与否也存在争议。
淡豆豉中含有黄酮类、多糖类、豆豉纤溶酶、大豆皂苷、蛋白质等成分,其中异黄酮具有预防更年期、乳腺癌以及改善骨质疏松,预防心血管疾病、阿尔茨海默病等药理活性[9],并且在淡豆豉中主要以游离型的苷元和结合型的糖苷存在,故本文主要通过收集淡豆豉不同发酵阶段的样品,通过HPLC 法测定6 种异黄酮的含量,分析不同发酵阶段6 种异黄酮含量动态变化,探讨发酵过程中再闷制环节的必要性,为淡豆豉的工艺和原理研究提供理论参考。
1 材料
LC-20A 型高效液相色谱仪(日本岛津公司);SQP 型十万分之一分析天平(赛多利斯科学仪器有限公司);大豆苷(批号:P14M10F83057)、大豆苷元(批号:C06N6Y5504)、黄豆黄苷(批号:P06J9F65073)、黄豆黄素(批号:G16J9C65571)、染料木苷(批号:P09M8F31018)、染料木素(批号:H30A9Z69019)(上海源叶生物科技有限公司,以上对照品纯度均大于98%);甲醇为色谱纯(德国Merck 公司);甲酸为色谱纯(上海阿拉丁试剂有限公司)。
黑豆(市售),经福建中医药大学车苏容副教授鉴定为豆科植物黑大豆Glycine max(L.)Merr.的成熟种子。桑叶(北京本草方源药业集团有限公司,批号:20170508)经福建中医药大学车苏容副教授鉴定为桑科植物桑Morus alba(L.)的叶。青蒿(安徽顺和堂中药饮片有限公司,批号:171201)经福建中医药大学车苏容副教授鉴定为菊科植物黄花蒿Artemisia annua(L.)的干燥地上部分。
2 方法与结果
2.1 淡豆豉样品的制备[1]
黑大豆洗净,取青蒿、桑叶加水煎煮,纱布过滤,滤渣备用,煎液浓缩,冷却拌入净大豆,药汁吸尽后蒸透,取出,晾凉。置容器内,纱布覆盖,滤过的青蒿、桑叶渣均匀覆盖于纱布上,置于室温,闷制发酵,于发酵第2日、第4日、第6日、第13日分别取出部分黑豆留作淡豆豉样品,并标记为Y-2、Y-4、Y-6、Y-13。
取发酵后的淡豆豉清洗稍晾,置于密闭容器内水浴50 ~60℃,保温,进行第二次闷制发酵,分别在第二次发酵的第3日、第9日和第15日分别取出部分黑豆留作淡豆豉样品,并标记为Y闷-3、Y闷-9、Y闷-15。
取Y-2、Y-4、Y-6、Y-13、Y闷-3、Y闷-9、Y闷-15 共7 份样品,干燥,粉碎,过二号筛。
2.2 色谱条件[10-11]
采用Welch Ultimate XB-C18色谱柱(4.6 mm×250 mm,5 μm),以甲醇(A)-甲酸0.1%(B)为流动相,梯度洗脱(0 ~7 min,25%~30%A;7 ~12 min,30% ~45%A;12 ~20 min,45%A;20 ~27 min,45% ~60%A;27 ~33 min,60% ~75%A;33 ~35 min,75%~25%A;35 ~40 min,25%A),流速为0.8 mL·min-1,柱温为30℃,检测波长为254 nm。理论塔板数均不低于5000。样品和对照品HPLC色谱图见图1。

图1 对照品及淡豆豉样品HPLC 色谱图Fig 1 HPLC chromatogram of reference substance and Sojae Seman Praeparatum sample
2.3 混合对照品溶液的制备
取对照品大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素适量,精密称定,置50 mL 量瓶中,加入70%甲醇超声溶解,制成质量浓度分别为730、1200、916、608、892 和564 μg·mL-1的单一对照品储备液,备用。分别精密量取上述对照品储备液各1 mL,置同一10 mL 量瓶中,加70%甲醇至刻度混匀,得到质量浓度为大豆苷73 μg·mL-1、大豆苷元120 μg·mL-1、黄豆黄苷91.6 μg·mL-1、黄豆黄素60.8 μg·mL-1、染料木苷89.2 μg·mL-1、染料木素56.4 μg·mL-1的混合对照品溶液。
2.4 供试品溶液的制备
依次取样品粉末(过二号筛)约1 g,精密称定,分别置于50 mL 锥形瓶中,精密加入70%甲醇25 mL,称重,加热回流30 min,放冷,再称重,用70%色谱甲醇补足减失的重量,摇匀,用0.22 μm 微孔滤膜过滤,取续滤液至进样瓶中备用。
2.5 标准曲线的制备
精密称取大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素、染料木素各对照品,加入70%甲醇超声溶解,定容至5 mL 量瓶,再用70%甲醇稀释为不同梯度质量浓度的混合对照品溶液。按“2.2”项下的色谱条件测定。以大豆苷、大豆苷元、黄豆黄苷、黄豆黄素、染料木苷、染料木素的质量浓度(X)为横坐标,以峰面积(Y)为纵坐标绘制标准曲线,见表1。
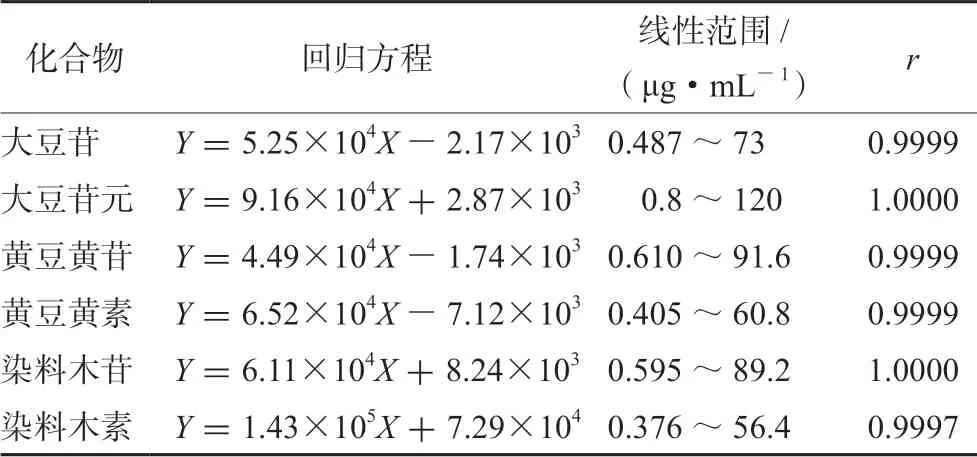
表1 淡豆豉中6 种异黄酮的线性范围考察结果Tab 1 Linear range of 6 isoflavones in Sojae Seman Praeparatum
2.6 精密度试验
精密吸取“2.3”项下的混合对照品溶液10 μL,按照“2.2”项下的色谱条件连续进样6 次测定,测得大豆苷元、大豆苷、黄豆黄素、黄豆黄苷、染料木素、染料木苷的峰面积RSD分别为0.078%、0.062%、0.042%、0.23%、0.039%、2.5%。说明精密度良好。
2.7 重复性试验
称取淡豆豉粉末,按“2.4”项下的方法制备成供试品溶液,按照“2.2”项下的色谱条件进样6 次,计算得大豆苷、大豆苷元、黄豆黄苷、黄豆黄素、染料木苷、染料木素峰面积的RSD分别为3.0%、0.47%、2.6%、1.2%、2.8%、2.4%,结果表明方法重复性良好。
2.8 稳定性试验
精密称取编号为Y闷-15 的淡豆豉粉末,按“2.4”项下的方法制备成供试品溶液,分别在0、2、4、8、12、24 h 按照“2.2”项下的色谱条件进样测定,计算大豆苷、大豆苷元、黄豆黄苷、黄豆黄素、染料木苷、染料木素峰面积的RSD值分别为2.8%、1.9%、1.2%、0.71%、1.4%、1.2%。表明供试品溶液在24 h 内稳定。
2.9 加样回收试验
取编号为Y闷-15 的淡豆豉粉末,精密称定约1 g,每份加入等量的6 份混合对照品溶液,按照“2.4”项下的方法制备供试品溶液,再按照“2.2”项下的色谱条件进样测定,计算大豆苷、大豆苷元、黄豆黄苷、黄豆黄素、染料木苷、染料木素的平均加样回收率为103.66%、99.51%、101.40%、99.44%、103.89%、101.76%;RSD分别为3.7%、2.5%、3.7%、3.6%、3.3%、3.3%。
2.10 样品的含量测定
取编号为Y-2、Y-4、Y-6、Y-13、Y闷-3、Y闷-9、Y闷-15 的淡豆豉粉末样品,精密称取1 g,分别置于50 mL 锥形瓶中,再分别精密加入70%色谱甲醇25 mL,加热回流30 min,放冷,再称重,用70%色谱甲醇补足减失的重量,摇匀,用0.22 μm 微孔滤膜过滤,取续滤液至进样瓶中,按照“2.2”项下的方法进样测定,代入回归方程计算出每份样品中6 种异黄酮的浓度以及6 种异黄酮的含量,结果见表2,用折线统计图表示6 种异黄酮含量动态变化,见图2。

表2 淡豆豉不同发酵阶段6 种异黄酮的含量(n =3)Tab 2 Content of 6 isoflavones in different fermentation stages of Sojae Seman Praeparatum (n =3)

图2 淡豆豉不同发酵阶段6 种异黄酮含量动态变化趋势图Fig 2 Dynamic change of 6 isoflavones in different fermentation stages of Sojae Seman Praeparatum
3 讨论
3.1 闷制过程中主要成分含量变化
由图2 可直观看出,淡豆豉发酵过程中,大豆苷元、染料木素和黄豆黄素3 种苷元含量总体呈上升趋势,以大豆苷元的变化趋势最显著;染料木苷、大豆苷和黄豆黄苷3 种苷含量总体呈下降趋势,以染料木苷的下降趋势最显著。
大豆苷元从发酵开始,含量变化上升显著,第二次闷制的第3日含量上升最显著;染料木素在第一次闷制发酵阶段前6 d 含量变化不大,第13日含量有明显上升趋势;黄豆黄素在第一次闷制发酵的前4 d 含量增加最为显著,此3 种苷元都是第二次闷制发酵阶段第9日含量达到峰值,到第二次闷制发酵阶段第15日含量有所下降,提示第二次闷制发酵阶段对于苷元含量的积累有显著影响,可尝试缩短闷制时间。染料木苷从发酵开始,含量持续下降,并且下降幅度最大;大豆苷在发酵第4日含量下降幅度最大,此后含量呈较缓下降趋势;黄豆黄苷在发酵前6 d 含量下降不大,第13日有明显下降趋势。此3 种苷类成分的含量都是第二次闷制发酵阶段第9日达到最低值,但在第15日都有所上升。结果提示,在淡豆豉发酵过程中存在苷到苷元的转化并且第二次闷制发酵的过程中苷和苷元会持续转化。
大豆苷具有良好的降血压和改善脑循环的作用;大豆苷元具有类雌激素样作用[12],对于治疗妇女更年期综合征等具有良好效果;黄豆黄苷具有抗病毒、抗菌的作用[13],可以防止骨质疏松和心脑血管疾病;黄豆黄素除了能够降低胃癌细胞的存活率[14],还可以诱发细胞程序性死亡;染料木苷具有抗增殖、抗肿瘤血管生成,以及诱导细胞周期阻滞和细胞凋亡等作用[15];染料木素具有抗炎、抗菌、抗氧化、抗肿瘤、抗凋亡等活性[16]。再闷制阶段有利于苷向苷元转化,该过程主要由于葡萄糖苷酶作用于糖苷型异黄酮的氧苷键,使其葡萄糖基团脱掉,供微生物代谢,使糖苷型异黄酮转化为异黄酮苷元。因大豆苷元、染料木素等异黄酮苷元较糖苷型异黄酮具有更高的生物活性[17],所以淡豆豉发酵后解表、除烦功效增强。
3.2 提取溶剂的优化
在前期试验的基础上,结合参考文献,对淡豆豉中6 种异黄酮的提取溶剂进行了优化,比较了甲醇、50%甲醇、70%甲醇、90%甲醇的提取效果。结果显示,70%甲醇提取效果较好,且杂质相对较少,故本试验采用70%甲醇作为提取溶剂。
3.3 小结
淡豆豉在不同地区炮制方法略有差异,对于发酵过程的闷制环节是否必要,不同学者也持有不同见解,本试验收集淡豆豉不同发酵阶段的样品,分析6 种异黄酮含量动态变化,结果显示,淡豆豉发酵过程中存在苷到苷元的转化现象,再闷制环节有利于苷转化成苷元,并且大豆苷元、染料木素等异黄酮苷元较糖苷型异黄酮具有更高的生物活性。该结果提示,淡豆豉发酵过程再闷制是必要过程,是有利于药效成分转化的发酵阶段。后期试验可结合不同阶段解表、除烦作用的研究,对再闷制过程的必要性进一步分析探讨,结合淡豆豉发酵过程中药理作用的变化,为淡豆豉炮制工艺和炮制原理研究提供参考。
