子宫血管平滑肌脂肪瘤1例及文献复习
2022-11-15芮佳敏黄彩虹姜舟崔树娜李士华
芮佳敏 黄彩虹 姜舟 崔树娜, 李士华
1扬州大学医学院,扬州 225000;2扬州大学附属医院病理科,扬州 225000;3扬州大学附属医院妇产科,扬州 225000
病例资料
患者,女,50 岁,已婚,无业。因“发现子宫肌瘤5 年,渐增大”于2021-11-29 就诊于扬州大学附属医院妇产科。患者5 年前体检发现子宫肌瘤,具体不详,后定期复查,子宫肌瘤逐渐增大,2021-11-15海安市人民医院复查B超:子宫肌层见大小约48 mm×41 mm的稍高回声区,境界清,内部回声不均。患者无腹痛腹胀,无恶心呕吐,无阴道流血,无尿频尿急尿痛,无便秘,拟“子宫肌瘤”收入院。既往史无特殊。生育史:1-0-2-1,28 年前曾于当地医院行子宫下段剖宫产术。月经史:自然绝经2 年,绝经后无异常阴道流血流液。家族史无特殊。入院时生命体征正常。妇科检查:外阴、阴道、宫颈未见明显异常;宫体:前位,如孕两月余,形态不规则,质中,活动可,无压痛;双侧附件区:未扪及明显包块,无压痛。入院后完善相关检查,血常规、肝肾功能、凝血功能、甲状腺功能、糖化血红蛋白、肿瘤标志物、心电图等未见明显异常。肝胆胰脾彩超:轻度脂肪肝。双肾输尿管膀胱彩超未见明显异常。阴超(图1):子宫前位,大小57 mm×57 mm×63 mm,轮廓清晰,形态欠规则,肌层回声欠均匀,宫内膜厚11 mm,内见稍强回声13 mm×5 mm,后壁强回声44 mm×34 mm。故术前诊断:子宫肌瘤变性?子宫内膜息肉?因患者已绝经,建议行全子宫+双侧输卵管卵巢切除术,患者表示拒绝,要求仅行全子宫切除术,故于2021-11-30 在全身麻醉下行腹腔镜下全子宫切除术。手术指征:子宫肌瘤变性?术中见:子宫孕60 d 大小,右后壁稍隆起,双附件外观正常,卵巢偏小。术后剖视子宫,见子宫右后壁直径4+cm 肌瘤样组织,组织色黄,宫腔内见息肉1枚,最大径约1 cm。术后诊断:子宫肌瘤变性、子宫内膜息肉。术后病理(图2):肿瘤组织由多少不等的厚壁血管、平滑肌及成熟的脂肪组织3 种成分构成,其中平滑肌细胞形态较规则,呈短梭形或长梭形,细胞核呈杆状,两端钝圆,胞浆嗜酸性,透明或颗粒状,核分裂象偶见,未见明确坏死组织。病理诊断:(子宫)血管平滑肌脂肪瘤(angiomyolipoma,AML)、慢性宫颈炎伴纳氏囊肿形成、(宫腔)增生期样子宫内膜伴息肉形成。术后予补液抗炎等对症治疗,患者恢复良好,顺利出院,现随访中。
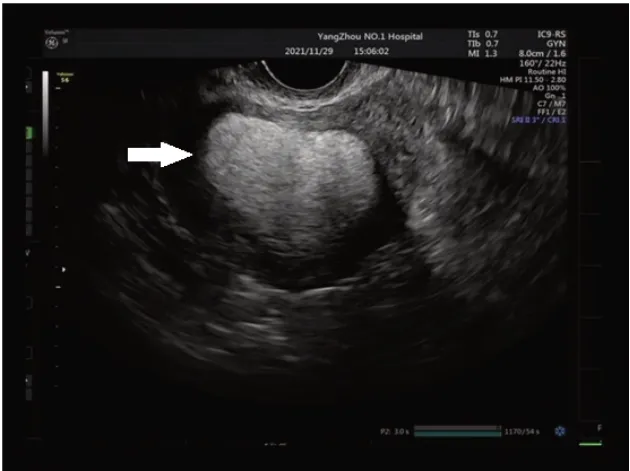
图1 1例子宫血管平滑肌脂肪瘤患者术前阴超图像,子宫后壁可见一强回声光团,内部回声尚均匀,边界尚清晰(箭头)
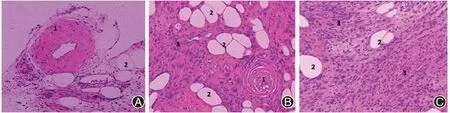
图2 1例子宫血管平滑肌脂肪瘤患者术后病理(HE染色 ×100)。A:肿瘤组织镜下见厚壁血管(1);B:肿瘤组织镜下见丰富成熟脂肪组织(2);C:肿瘤组织镜下见大量平滑肌细胞。A、B、C:肿瘤组织由厚壁血管(1)、成熟脂肪组织(2)及平滑肌细胞(3)3种成分构成。平滑肌细胞形态较规则,呈短梭形或长梭形,边界清楚,胞质丰富,颗粒状或透明状,呈嗜酸性
文献复习
血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)是一种罕见的间叶组织来源肿瘤,世界卫生组织(WHO)将其定义为一种由组织学和免疫表型上不同的血管周上皮样细胞组成的间质肿瘤[1]。PEComa 主要包括AML、肺淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM)、非 特 殊 类 型 PEComa(PEComa-not otherwise specified,PEComa-NOS)[2],可发生于任何部位,最多见于肾脏[3]。Liu等[4]进行的一项妇科PEComa系统评价显示,子宫是最常受累的部位,其次为宫颈、阴道,患者年龄在9~79 岁之间,40 岁左右多见,主要表现为阴道流血、腹痛和压迫症状。
AML 是PEComa 肿瘤的一种,其特征是良性平滑肌细胞、脂肪细胞和血管呈不同比例存在,多见于肾和肝,发生于子宫的报道较少[5]。大多数肾脏AML被认为与结节性硬化(TSC)有关,TSC 是一种由 TSC1 或TSC2 基因种系突变导致蛋白功能失活而引起的常染色体显性遗传性疾病,几乎累及所有器官及系统[6]。然而在子宫AML 患者中,只有7%的患者患有TSC[7],这表明子宫AML 的发病机制可能与肾脏不同。其确切机制尚不明确。
子宫AML 的临床表现及影像学表现无特异性,故其术前诊断十分困难。AML的脂肪瘤成分在超声检查中表现为强回声,CT 及MRI 可辅助确认脂肪瘤成分的存在[8]。但它也可能在超声下表现为具有不均匀回声和丰富血管的小子宫肿块[9]。由于子宫AML 是由3 种成分呈不同比例存在,其任何一种细胞成分占优势都有可能导致误诊或漏诊,常误诊为子宫肌瘤、子宫内膜间质肉瘤、上皮样平滑肌瘤、脂肪平滑肌瘤、血管平滑肌瘤[7]。
子宫PEComa 的诊断主要依靠组织病理学和免疫组织化学。肉眼观肿瘤通常呈棕褐色至灰色,虽然它通常边界清楚,但并不存在明确的包膜。切面一般为白褐色至灰红色,局部有出血和坏死[10]。镜下观可见肿瘤细胞围绕血管周围呈片状、巢状分布,血管丰富,管壁薄,肿瘤细胞形态多变,可呈多边形、圆形、梭形等,边界清楚,胞质丰富,颗粒状,呈嗜酸性,胞核卵圆形或圆形,核仁可见,核分裂象不一,4~5 个/50 个高倍视野(HPF)[10-11]。免疫组织化学上,PEComa 的特点是肌样蛋白[如结蛋白(desmin)、平滑肌肌动蛋白(SMA)、肌肉特异性肌动蛋白、肌肉肌球蛋白和钙调蛋白]和黑素细胞标志物(如HMB-45、Melan-A/MART-1、酪氨酸酶和小眼转录因子MiTF)呈阳性。其中HMB-45 最为敏感,几乎所有子宫PEComa都表达,但染色差异较大,有时仅是局灶或散在阳性[12]。此外,PNL2作为一种黑素细胞标志物,近来被发现在PEComa 中也具有很高的灵敏度,尤其是所取组织数量有限或高度怀疑 PEComa 而 HMB-45 低表达或阴性的情况下[13-14]。
PEComa 的分子机制目前认为主要有3 种:⑴结节性硬化 复 合 体(TSC)异常 ;⑵TFE3 基因重排;⑶RAD51B 基因重排及其他罕见的基因融合[15]。 其 中 ,TSC 突 变 以TSC2 为主,TSC2 的突变激活了哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,导致大部分PEComa及其他肿瘤的发生[16]。TFE3是小眼转录因子MiTF基因家族(MiTF、TFE3、TFEB、TFEC)中成员之一,在PEComa 中,TFE3 基因重排和TSC 基因突变被认为是互斥的[17],这提示TFE3基因重排引起的PEComa可能是PEComa中一种独特的亚型。近来少量子宫PEComa 病例被发现存在RAD51B 基因重排,其与TSC 突变可以同时存在,并不互相排斥[15]。目前为止,无论是哪一种组织学类型的PEComa,一旦具有TFE3 基因重排及RAD51B 基因重排,往往具有侵袭性[15]。
2020 年WHO 将PEComa 重新分类,分为恶性潜能未定型和恶性2 种。当肿瘤存在以下3 个或3 个以上特征时,可认为其生物学行为为恶性:肿瘤直径≥5 cm,高核级别,核分裂象>1 个/50 HPF,存在肿瘤性坏死、存在淋巴管或血管浸润。当肿瘤仅有2个或2个以下特征时,生物学行为为恶性潜能未定型[2]。
子宫PEComa 目前缺乏统一的治疗规范。手术切除仍是主要治疗方法。手术方式应根据病理结果、患者年龄、生育需求等多方面因素综合考量。全子宫双侧输卵管卵巢切除+切缘阴性是目前治疗子宫PEComa的手术方法。对于年轻、肿瘤体积小、有生育需求且病理考虑为良性的患者,可行肿瘤切除,术后密切随访[18]。对于有高危因素的患者,放化疗的疗效尚不确切,PEComa 复发和/或远处转移的最佳治疗方法仍不确定[4,18]。靶向治疗,尤其是 mTOR 抑制剂——西罗莫司似乎为TSC 基因突变的PEComa 的治疗提供了新的思路,部分病例使用西罗莫司后达到了肿瘤缩小、临床缓解的效果,不过仍有待更多的数据支撑[19]。对于TFE3 基因重排及RAD51B 基因重排的病例的药物治疗,仍有待探索。
总之,子宫AML 作为一种PEComa 肿瘤,发病率低,临床表现及影像学缺乏特异性,术前诊断困难,主要通过组织病理学及免疫组化确诊,手术切除是其目前主要的治疗方法。但由于其较罕见、临床病例数少,仍有待进一步研究。
