基于透明质酸的靶向纳米探针的构建及体外抗肿瘤活性
2022-11-12戚筱羽叶雨霏陈雪梅朱晓南张雨婷王晓丽周楠迪
戚筱羽,叶雨霏,陈雪梅,朱晓南,张雨婷,尹 健*,王晓丽**,周楠迪***
(1江南大学生物工程学院糖化学与生物技术教育部重点实验室,无锡 214122;2江南大学食品学院国家保健食品工程研究中心,无锡 214122)
乳腺癌是最常见的恶性肿瘤之一,严重地危害女性健康[1]。在全球范围内,每年有超过1 000万人被新确诊为癌症。目前治疗乳腺癌最常见的方法包括手术切除、放疗、化疗以及联合治疗等[2],但治疗过程中都存在一定的局限性,如手术切除不彻底、放疗缺乏选择性、化疗具有极强不良反应等[3]。因此,迫切需要开发新型有效的方法用于治疗乳腺癌[1,4]。
透明质酸(hyaluronic acid,HA)是一种天然的酸性糖胺聚糖,由二糖的重复单元N-乙酰葡萄糖胺和D-葡萄糖醛酸交替组成,是细胞外基质的主要成分[5],主要存在于关节滑膜流体和细胞外基质中[6]。研究表明,HA 能与多种蛋白受体(如CD44受体)作用,参与细胞信号传导[7]。随着纳米技术的快速发展,HA 与其受体之间的相互作用也被广泛用于药物的递送,从而增强对肿瘤细胞的生物相容性和靶向性[8]。此外,由于肿瘤环境中透明质酸酶(HAase)的存在,以HA 为基础形成的纳米材料可以有效实现药物的可控释放。
阿霉素(doxorubicin,DOX)是一种非常有效的化疗药物,通过抑制拓扑异构酶活性而导致DNA 损伤和细胞周期停滞[9]。随着 DOX 的广泛使用,其存在的耐药性、心脏毒性和缺乏靶向性等不良反应逐渐显现[10]。研究表明,负载在纳米材料中的DOX 靶向后释放治疗效果更好[11]。光动力治疗是一种新型的肿瘤治疗手段,主要依靠光敏剂、光和氧气产生光动力效应[12]。在近红外(near infrared,NIR)光照射后,光敏剂可以将内源性分子氧转化为具有细胞毒性的活性氧,从而抑制肿瘤生长[13]。氧气的存在有利于光动力治疗发挥更大的作用[14]。近年来,各种类型的NIR 光敏剂相继出现,如卟啉、花青素和二吡咯亚硼等[15-16]。其中,IR808是一种天然吲哚花青染料,具有良好的光稳定性、较强的水溶性和较高的荧光强度,因此被认为是一种良好的NIR 光敏剂。IR808 可以同时用于细胞内荧光成像和肿瘤治疗[17-18]。有研究表明,化疗-光动力治疗的协同疗法可以显著提高肿瘤的疗效,并可降低化疗药物的不良反应[19]。
基于此,本研究以HA 为药物递送载体,依次连接DOX、IR808 和过氧化氢酶(catalase,CAT),然后通过自组装构建了一种基于HA 的多功能纳米探针CAT@HA-DOX-IR808 NPs,该纳米探针具有靶向递送、荧光成像以及体外化疗-光动力联合治疗的特性。如图1-A 所示,选择己二酸二酰肼(ADH)作为HA 与DOX 之间的连接臂。首先,HA的羧基和ADH 的肼基通过酰胺反应得到HAADH,在此基础上,ADH 另一端的肼基可与DOX上的酮羰基反应,通过形成酰腙键得到HA-DOX复合物。酰腙键在酸性条件下较敏感易断裂,从而可以释放出DOX。IR808 的羧基可与HA-DOX聚合物上剩余未反应的ADH 上的肼基发生酰胺反应形成HA-DOX-IR808 聚合物。最后,HA-DOXIR808 聚合物与CAT 通过共价连接并自组装得到纳米探针CAT@HA-DOX-IR808 NPs。纳米探针的作用原理如图1-B 所示,CAT@HA-DOX-IR808 NPs可通过HA 靶向CD44 从而进入乳腺癌细胞,进入细胞后,在肿瘤细胞酸性微环境中,纳米探针中酸敏感的酰腙键断裂,释放出DOX 发挥化疗作用。在NIR 光照射下,纳米探针中的IR808 一方面可以实现细胞内NIR 荧光成像,另一方面可以发挥光动力治疗作用。
1 材 料
1.1 药品与试剂

Figure 1 Schematic illustration of (A) the preparation of CAT@HA-DOX-IR808 NPs and (B) therapeutic process of CAT@HA-DOX-IR808 NPs in tumor cellsADH:Adipic dihydrazide;HA:Hyaluronic acid;DOX:Doxorubicin;CAT:Catalase;NP:Nanoparticle;NIR:Near infrared
透明质酸(HA,相对分子质量3 kD ~ 8 kD,山东福瑞达生物医药有限公司);阿霉素(DOX)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)、N-羟基丁二酰亚胺(NHS)和1-羟基苯并三唑(HOBT)(上海阿达玛斯试剂有限公司);过氧化氢酶(CAT)、己二酸二酰肼(ADH)、BCA 试剂盒、9,10-蒽基-双(亚甲基)二丙二酸(ABDA)、蛋白酶K、钼酸铵、3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-溴代四唑(MTT)和2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)(西格玛奥德里奇贸易有限公司);DMEM 培养基(赛默飞世尔科技公司);4',6-二脒基-2-苯基吲哚二盐酸盐(DAPI)和多聚甲醛(上海碧云天生物技术有限公司);其他试剂均为市售分析纯。
1.2 仪 器
ZEN3690 激光粒度仪(英国马尔文公司);透射电子显微镜(TEM)、紫外分光光度计和荧光分光光度计(日本日立集团);激光共聚焦荧光显微镜(徕卡显微系统贸易有限公司);流式细胞仪(美国BD公司)。
1.3 细 胞
人乳腺癌细胞MDA-MB-231 和人胚肾HEK-293 细胞均由江南大学生物工程学院糖化学与生物技术教育部重点实验室提供。
2 方 法
2.1 CAT@HA-DOX-IR808 NPs 及相关材料的制备
2.1.1 HA-DOX 聚合物的合成 HA-DOX 聚合物的合成路线如图2 所示。首先对HA 进行ADH 修饰,将HA 400 mg 和ADH 864 mg 溶于超纯水40 mL 中,室温下搅拌反应20 min。接着向该溶液中加入适量的0.1 mol/L 盐酸使整个溶液pH 达到4.75,然后加入EDC·HCl 570 mg,于室温搅拌反应5 h,并且维持pH为4.75。向反应液中加入适量的0.1 mol/L氢氧化钠调pH至7.0以终止反应。得到的HA-ADH 聚合物溶液用25%乙醇溶液和超纯水透析(截留相对分子质量为3.5 kD)纯化2 d 后,通过冷冻干燥得到HA-ADH聚合物。
将冻干后的HA-ADH 聚合物85 mg 溶于pH 6.5 的磷酸缓冲盐溶液(PBS)30 mL 中,室温搅拌下将1 mg/mL DOX 溶液10 mL 以滴加的方式加入上述溶液,滴加完成后在室温下避光反应24 h。反应结束后HA-DOX 聚合物溶液用25%乙醇溶液和超纯水透析(截留相对分子质量为3.5 kD)纯化2 d,最后通过冷冻干燥得到HA-DOX聚合物。

Figure 2 Synthetic route of HA-DOX polymer
2.1.2 HA-DOX-IR808 聚合物的合成 HA-DOXIR808聚合物的合成路线如图3所示。在室温条件下,将 IR808 39.6 mg 溶于 DMF 4 mL 溶液中,并依次加入EDC·HCl 9.6 mg 和 NHS 2.9 mg,避光反应4 h。然后加入含有50 mg HA-DOX聚合物的DMFH2O(1∶1)溶液5 mL,室温下避光反应24 h,反应结束后用25%乙醇溶液和超纯水透析(截留相对分子质量为3.5 kD)纯化2 d,最后通过冷冻干燥得到HA-DOX-IR808聚合物。

Figure 3 Synthetic route of HA-DOX-IR808 polymer
2.1.3 CAT@HA-DOX-IR808 NPs 的 制 备 将HA-DOX-IR808 聚合物40 mg 溶于超纯水30 mL中,搅拌条件下加入EDC·HCl 7.9 mg,室温下避光反应0.5 h,然后加入HOBT 2.4 mg继续反应0.5 h,接着加入CAT 12 mg,于室温下避光反应18 h。反应结束后,将CAT@HA-DOX-IR808 NPs 溶液装入超滤离心管(截留相对分子质量为100 kD),以5 000 r/min 离心10 min,弃去超滤出的液体,将其重悬于超纯水中,重复上述离心步骤3 次,获得最终的CAT@HA-DOX-IR808 NPs。
2.1.4 其他相关纳米材料的制备 制备了CAT@HA NPs、HA-DOX NPs 和 HA-DOX-IR808 NPs 作为之后的实验对照组。CAT@HA NPs 所需的合成方法与CAT@HA-DOX-IR808 NPs 基本相同,只是用HA 代替HA-DOX-IR808 聚合物制成,其余反应条件一致。HA-DOX NPs 和HA-DOXIR808 NPs 采用直接超声法获得。将HA-DOX 和HA-DOX-IR808 聚合物5 mg 分别溶于超纯水5 mL中,超声15 min 后,溶液装入超滤离心管(截留相对分子质量为10 kD),以5 000 r/min 离心10 min,弃去超滤出的液体,将其重悬于超纯水中,重复上述离心步骤3 次,获得最终的HA-DOX NPs 和HA-DOX-IR808 NPs。
2.2 CAT@HA-DOX-IR808 NPs 及相关材料的表征
2.2.1 DOX/IR808 的测定 将CAT@HA-DOXIR808 NPs 及相关材料用超纯水稀释后,通过紫外分光光度计和荧光分光光度计测定对应的特征峰。
2.2.2 CAT 的测定 将CAT@HA-DOX-IR808 NPs及相关材料用超纯水稀释后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)实验。
2.2.3 平均粒径及形貌分析的测定 将CAT@HA-DOX-IR808 NPs 及相关材料用超纯水稀释后,通过激光粒度仪和TEM进行测定分析。
2.3 阿霉素体外释放实验
经过检测,DOX 在486 nm 处有独特的紫外特征峰(A486)。根据测定DOX 溶液在不同质量浓度(0,0.001,0.4,0.8,2,4,8,10 和 20 µg/mL)时的A486,绘制出DOX 质量浓度与A486的标准曲线。检测 CAT@HA-DOX-IR808 NPs 溶液的 A486,带入标准曲线,即可得到CAT@HA-DOX-IR808 NPs 溶液中DOX 的含量。根据公式(1)计算载药率(loading content,LC),公式(2)计算包封率(entrapment efficiency,EE):

其 中 ,ma、m0、mc分 别 代 表 CAT@HA-DOX-IR808 NPs溶液中所含DOX 的质量、整个CAT@HA-DOXIR808 NPs的质量、参与反应的DOX质量。
计算得到溶液中DOX 的含量后,将CAT@HADOX-IR808 NPs 溶液进行稀释或浓缩至溶液中DOX 质量浓度为100 µg/mL,取出4 mL,每毫升装入1 个透析袋(截留相对分子质量为10 kD),两端用线固定确保其中的液体不会溢出。将它们分别装入载有 PBS(pH 5.0)、PBS(pH 5.0)+ HAase(120 unit/mL)、PBS(pH 7.4)、PBS(pH 7.4)+HAase(120 unit/mL)19 mL 的 4 种离心管中。离心管在37 ℃以120 r/min连续振荡并在固定的时间点(1,2,3,4,5,6,7,8,9,10,12,24,30,36 和48 h)收集PBS 外液1 mL,并加入上述相同参数的PBS 作为替换。最后,检测上述收集到的溶液A486。根据公式(3)计算DOX 的释放率(release ratio,RR),整个实验重复3次进行。

式(3)中,cn代表第n 次取出溶液时DOX 的质量浓度(mg/mL);V1代表整个体系中溶液的总体积(mL);V2代表每次取出溶液的体积(mL);m代表加入该体系的总DOX质量(mg)。
2.4 过氧化氢酶的含量和活性的测定
2.4.1 过氧化氢酶的含量测定 采用BCA 试剂盒测定CAT@HA-DOX-IR808 NPs 中CAT 的含量。所有步骤均按照BCA 试剂盒说明书操作。先将试剂盒中A液8 mL和B液0.16 mL混合均匀,并将标准蛋白溶液白蛋白(BSA)稀释成0,100,200,400,600,800 和 1 000 µg/mL。上述溶液准备完成后,将样品、BSA 标准品 25 µL 分别加入 96 孔板中,并且每孔继续加入A 和B 的混合液200 µL,摇晃30 s,密封盖住后在37 ℃培养30 min,冷却至室温后,用酶标仪检测上述溶液的A562。将不同浓度的BCA 与其相对应的A562制成标准曲线,检测样品的A562,带入上述标准曲线,计算CAT@HA-DOXIR808 NPs中CAT的浓度。
2.4.2 过氧化氢酶活性测定 将CAT、CAT@HA NPs和CAT@HA-DOX-IR808 NPs(CAT质量浓度为600 µg/mL)溶液 0.2 mL 分别与蛋白酶 K(60 µg/mL)于37 ℃孵育,在预定时间点(0,0.5,1,2,3,4和 5 h)取 出 0.2 mL 加 入 50 mmol/L 过 氧 化 氢(H2O2)溶液1 mL,在37 ℃继续孵育1 min 后,加入32.4 mmol/L 钼酸铵溶液1 mL 使反应终止,用酶标仪测定上述溶液的A405。
2.5 纳米探针的稳定性评价
将CAT@HA-DOX-IR808 NPs 溶于超纯水、0.01 mol/L PBS(pH 7.4)、DMEM 3 种溶液中,于37 ℃条件下连续避光静置孵育5 d,每天检测其水合粒径的大小以评价其在模拟生理环境中的稳定性。
2.6 溶血实验
用山羊红细胞进行溶血试验。将不同质量的CAT@HA-DOX-IR808 NPs(1,5,10,20 和50 µg)溶于0.01 mol/L PBS(pH 7.4)500 µL 中,并加入到24孔板中。超纯水为阳性对照,0.01 mol/L PBS(pH 7.4)为阴性对照。所有样品中均加入山羊红细胞500 µL,于37 ℃培养箱中孵育2 h。孵育完成后,将上述混合物以1 000 r/min 离心10 min,结束后,每组吸取上清液50 µL 至96 孔板中,用酶标仪检测上述溶液的A540。根据公式(4)计算溶血率(hemolytic rate,HR):

式(4)中,A1、A2和A3分别代表样品、阳性对照组和阴性组在540 nm处的吸收度。
2.7 单线态氧的检测实验
首先验证了游离IR808产生单线态氧的能力。将不同浓度的 IR808(0,100,200,300,400,500,750 和 1 000 µg/mL)400 µL 与 1.33 g/mL ABDA 100µL 混合后检测0 min 时溶液的荧光强度F0(激发波长为380 nm),然后用808 nm 的NIR 光(0.5 W/cm2)持续照射2 min 后重新检测溶液荧光强度F2。将上述两个荧光数据相减得到的最大差值(F0-F2),表示IR808 在该浓度下产生单线态氧的效果最好。根据前期实验结果,将CAT@HA-DOXIR808 NPs 溶液配制为与上述相同的IR808 浓度,用808 nm 激光照射后,检测不同时间点(0,0.2,0.5,1,2,4,8,10和12 min)的溶液荧光强度。
2.8 细胞内活性氧的检测实验
将MDA-MB-231 和HEK-293 细胞都稀释成细胞浓度为每毫升3.0 × 105个细胞,并在每个激光共聚焦培养皿中加入上述细胞培养液1 mL,于37 ℃5%CO2条件下孵育15 h。孵育结束后,吸出培养液,将每种类型的细胞随机分为4组(n=6)进行实验:(1)IR808、(2)IR808+NIR、(3)CAT@HADOX-IR808 NPs、(4)CAT@HA-DOX-IR808 NPs +NIR。 在每个培养皿中加入含有 IR808 或CAT@HA-DOX-IR808 NPs(两种溶液中IR808 质量浓度均为 0.21 µg/mL,CAT@HA-DOX-IR808 NPs质量浓度为4.277µg/mL)的新鲜DMEM 孵育4 h。结束后,吸出DMEM,用PBS洗涤3次,再在每个培养皿中加入含有20 µmol/L DCFH-DA 的培养基1 mL,孵育 20 min 后使用 808 nm 的激光(1 W/cm2)照射2 min,同时设置不进行光照的组别进行对照,之后继续孵育30 min,吸取上述包含药物的培养基,用PBS 洗涤3 次后,加入4%多聚甲醛固定,加入0.5 mL DAPI 进行细胞核染色。通过激光共聚焦荧光显微镜记录细胞内新生成的2',7'-二氯荧光素(DCF)的荧光强度(激发波长为502 nm,发射波长为520 ~ 540 nm),以考察细胞内活性氧的生成情况。
2.9 细胞摄取和细胞内成像实验
将MDA-MB-231 和HEK-293 细胞在共聚焦激光培养皿(用于激光共聚焦荧光显微镜成像)或12孔板(用于流式细胞仪检测DOX 荧光)中以每个培养皿或孔的密度为每毫升3.0 × 105个细胞于37 ℃5%CO2条件下培养15 h。取出培养液,用PBS洗涤 3 次。将含有 DOX、IR808、CAT@HA-DOXIR808 NPs+HA 和 CAT@HA-DOX-IR808 NPs 的新鲜培养基加入激光共聚焦培养皿或12孔板中孵育4 h,其中 CAT@HA-DOX-IR808 NPs + HA 组先将HA 与细胞共孵育1 h,样品中DOX、IR808和HA 的质量浓度分别为 0.42,0.21 和50 µg/mL。激光共聚焦培养皿和12孔板在以上的操作步骤中保持一致。接着,在激光共聚焦培养皿的处理中,将包含药物的DMEM 吸出后,PBS 洗涤3次,用4%多聚甲醛固定,15 min 后吸出多聚甲醛,PBS 清洗 3 次后加入DAPI0.5 mL 对细胞核进行染色。用激光共聚焦荧光显微镜(63 倍油镜)拍摄细胞在不同通道上的荧光情况。在12 孔板的细胞处理中,将包含药物的 DMEM 吸出后,PBS 洗涤 3 次,使用胰蛋白酶消化后进行离心操作,吸去上清液,将细胞重新溶解于0.01 mol/L PBS(pH 7.4)中,在流式细胞仪中测定DOX的荧光强度。
2.10 体外抗肿瘤活性研究
将MDA-MB-231 和HEK-293 细胞培养液200µL(每毫升1 × 104个细胞)接种于96 孔板中孵育15 h。反应结束后,吸出培养基,用PBS 洗涤3 次。每 6 个小孔为一组,分为DOX、IR808(+ NIR,0.5 W/cm2)、CAT@HA-DOX-IR808 NPs 和 CAT@HADOX-IR808 NPs(+ NIR,0.5 W/cm2)4 组。不加任何样品的DMEM 组为阳性对照组。每孔加入含有DOX、IR808、CAT@HA-DOX-IR808 NPs 的 DMEM 200 µL,设计了 8 个不同的 CAT@HA-DOX-IR808 NPs 浓度梯度,包括 0.102,1.018,5.092,10.183,20.367,40.733,81.466 和 101.833 µg/mL。其中每组对应 DOX 浓度为 1.8×10-5,1.8×10-4,9.2×10-4,1.8×10-3,3.6×10-3,7.3×10-3,1.5×10-2和1.8×10-2µmol/L,IR808 浓度为6.5×10-6,6.5×10-5,3.3×10-4,6.5×10-4,1.3×10-3,2.6×10-3,5.0×10-3和6.5×10-3µmol/L。细胞与上述样品孵育4 h 后,每孔加入5 mg/mL的MTT溶液10µL,继续孵育4 h。然后吸出培养基,每孔加入DMSO 200 µL,继续孵育,10 min 后用酶标仪测定每孔的A570。细胞抑制率(inhibition rate,IR)如式(5)所示:

式(5)中,A1和A2分别代表样品和阳性对照组(纯DMEM组)在570 nm处的吸收度。
3 结果与讨论
3.1 相关材料的表征
3.1.1 CAT@HA-DOX-IR808 NPs 的 表 征 从TEM图像中可观察到CAT@HA-DOX-IR808 NPs呈均匀的类球形,尺寸约为75 nm(图4-A)。由于HA具有很强的亲水性,所以在进行水合粒径的检测时,HA 的大量吸水所导致的溶胀效应使得其测出来的水合粒径远大于TEM 下的粒径,经过检测平均水合粒径约为247 nm(图4-B)。接下来,通过紫外可见光谱和荧光光谱验证DOX 与IR808 成功偶联到 HA 上。如图 4-C 所示,DOX 和 IR808 分别在486 和776 nm 处有紫外特征吸收峰。HA-DOX NPs、HA-DOX-IR808 NPs 和 CAT@HA-DOX-IR808 NPs 均在DOX 和/或IR808 的对应位置出现响应的特征吸收峰,证明了DOX 和IR808 在上述纳米材料中的成功连接。荧光光谱进一步证实了上述结论。从荧光光谱(图4-D 和4-E)中可以观察到DOX 和 IR808 分 别 在 592 和 795 nm 处 有荧 光 特征峰,相关的纳米材料也显示出了DOX 和/或IR808对应的荧光特征峰。然后,用SDS-PAGE 验证CAT的成功连接。如图4-F 所示,CAT 分子的单体蛋白条带约为 60 kD(条带 2),CAT@HA-DOX-IR808 NPs(条带3)中在60 kD 处也出现明显条带,说明CAT@HA-DOX-IR808 NPs 中含有CAT,其中条带1为标准品,用于对照。
3.1.2 相关纳米材料的表征 对HA-DOX NPs、HA-DOX-IR808 NPs 和 CAT@HA NPs 进行了表征。TEM 图像显示,HA-DOX NPs 呈近球形,大小为 50 nm,而 HA-DOX-IR808 和 CAT@HA NPs 则呈现不均匀形态,大小约为50 和75 nm(图5-A ~ 5-C)。HA-DOX、HA-DOX-IR808 和 CAT@HA NPs 的平均水合粒径分别约为175,200 和210 nm(图5-D ~5-F)。
3.2 DOX的体外释放实验
根据DOX 在486 nm 处存在紫外特征吸收峰,得到了DOX 浓度与A486的标准曲线为y =0.009 72x-0.002 48(R2= 0.999)。计算得DOX-载药量为(9.82±0.3)%,DOX-包封率为(59.57±2.1)%。然后,以包含不同的pH 和 HAase 的 PBS为外界刺激,考察了CAT@HA-DOX-IR808 NPs 的药物释放情况。如图6-A 所示,在pH 7.4 和pH 5.0情况下,DOX在48 h内的释放率分别为38%和56%。在pH 5.0 和HAase 同时存在的条件下,DOX 的释放量迅速增加,约80%的DOX 在最初的10 h 内就表现出快速释放,并在48 h 达到近95%的释放率,这主要是由于HAase 对HA 的水解以及对于pH 敏感的酰腙键的断裂从而加速了DOX 的大量释放。以上结果表明,CAT@HA-DOX-IR808 NPs 具有良好的pH 和HAase 响应的药物释放能力。
3.3 过氧化氢酶的含量及稳定性实验
3.3.1 过氧化氢酶的含量测定 根据BSA 溶液在不同浓度条件下的A562获得BCA 标准曲线为y=0.0012x+0.06927(R2=0.994),计算出 CAT 约占整个CAT@HA-DOX-IR808 NPs的(57.6±0.7)%。

Figure 4 Characterization of the CAT@HA-DOX-IR808 NPs and other control NPsA:TEM image of CAT@HA-DOX-IR808 NPs;B:Average hydrated particle size of CAT@HA-DOX-IR808 NPs;C:Ultraviolet-visible spectra;D:Fluorescence spectra;E:Fluorescence spectra;F:SDS-PAGE image(Lane 1:Marker;Lane 2:CAT;Lane 3:CAT@HA-DOX-IR808 NPs)

Figure 5 TEM images of (A) HA-DOX NPs, (B) HA-DOX-IR808 NPs, and (C) CAT@HA NPs and average hydrated particle sizes of (D) HA-DOX NPs,(E)HA-DOX-IR808 NPs,and(F)CAT@HA NPs
3.3.2 过氧化氢酶的稳定性评估 为了测试CAT 的稳定性,通过文献[20]的方法评估了CAT的活性。如图6-B 所示,5 h 后游离CAT 活性降至40%,而CAT@HA-DOX-IR808 NPs 表现出优异的CAT 活性,在5 h 内保持了接近100%的活性,这表明通过修饰和自组装成纳米材料可以提高CAT 的稳定性。此外,CAT@HA NPs 所表现出的CAT 活性远低于CAT@HA-DOX-IR808 NPs,推测主要由两个原因导致:一方面,相比于CAT@HA-DOXIR808 NPs,CAT@HA NPs 本身大小较不均一,即CAT@HA NPs 本身的性质导致了其CAT 的稳定性远低于CAT@HA-DOX-IR808 NPs;另一方面,CAT@HA-DOX-IR808 NPs 中由于引入了富含亲水基团(羟基、氨基和羧基)的DOX 和IR808,更利于形成具有保护作用的亲水层,从而使CAT@HADOX-IR808 NPs具有较好的CAT稳定性[21]。
3.4 CAT@HA-DOX-IR808纳米粒的稳定性实验
如图6-C所示,CAT@HA-DOX-IR808纳米探针在超纯水、0.01 mol/L PBS(pH 7.4)、DMEM 这 3 种介质中孵育5 d 后没有明显的水合粒径尺寸变化,表明纳米探针在上述介质中具有良好的稳定性。
3.5 溶血性评估
溶血率是生物相容性评价的重要指标。当CAT@HA-DOX-IR808 NPs 的质量浓度达到100µg/mL 时,仍然显示出很低的溶血率(2%)(图6-D),远低于会对人体造成伤害的浓度(10%),这说明CAT@HA-DOX-IR808 NPs 具有良好的生物相容性。

Figure 6 In vitro properties of CAT@HA-DOX-IR808 NPs(n=3)A:Release of DOX;B:Relative catalases activity;C:Particle size;D:Hemolytic toxicity
3.6 单线态氧的检测实验
为了检测CAT@HA-DOX-IR808 NPs产生单线态氧的能力,在溶液中使用ABDA 作为荧光探针。当单线态氧存在时,ABDA 会与其反应,从而产生荧光猝灭的现象,荧光强度减弱。根据IR808的浓度及其对应的A776,得标准曲线为y = 0.147 88x +0.007 617(R2= 0.999),计算出加载上的 IR808 约占 整 个 CAT@HA-DOX-IR808 NPs 的(4.73 ±1.3)%。在 NIR 光照射下,IR808 对 ABDA 的荧光抑制作用呈现浓度依赖关系。当IR808 的质量浓度为400µg/mL时,0和2 min之间的荧光强度差异达到最大(图7-A),即选择该浓度作为后续CAT@HA-DOX-IR808 NPs 中 IR808 参 与 反 应 的浓度。
接下来,对CAT@HA-DOX-IR808 NPs 的产生单线态氧的能力进行了评估。结果显示,ABDA 的荧光强度随着照射时间的增加而逐渐降低,表明CAT@HA-DOX-IR808 NPs 的构建并没有破坏IR808 产生单线态氧的能力(图7-B)。此外,氧气的增加有利于发挥光动力作用,在H2O2的存在下,CAT能与H2O2反应生成氧气,ABDA的荧光猝灭效果更加明显(图7-C)。
3.7 细胞内活性氧检测实验
非荧光物质DCFH-DA在参与活性氧反应后可转化为有荧光的DCF。如图8-A所示,在MDA-MB-231 细胞(高表达 CD44)中,IR808 和 CAT@HADOX-IR808 NPs 在NIR 光照射下的荧光强度都明显高于相对应的未经NIR 光照射的组别。在NIR光照射下,DCF 的荧光强度在CAT@HA-DOXIR808 NPs 组中比IR808 组要明显许多,这表明CAT@HA-DOX-IR808 NPs可以通过靶向MDA-MB-231 细胞表面过度表达的CD44 来实现IR808 的高效传递。而在HEK-293 细胞(低表达CD44)中,无论有无NIR 光照射,均未观察到明显的荧光信号(图8-B),CAT@HA-DOX-IR808 NPs 可以以被动扩散的方式进入HEK-293 细胞,但进入细胞的量较低。因此,在HEK-293 细胞中产生的活性氧较少,DCF的荧光信号较弱。
3.8 细胞摄取与细胞内成像实验

Figure 7 Ability of producing singlet oxygen of IR808/CAT@HA-DOX-IR808 NPsA:Changes of fluorescence intensity of ABDA+IR808 after irradiation for 2 min at different concentration of IR808(n=3);B:Fluorescence intensity of different irradiation times of ABDA + CAT@HA-DOX-IR808 NPs; C: Fluorescence intensity of different irradiation times of ABDA + CAT@HADOX-IR808 NPs+H2O2(NIR irradiation:808 nm,0.5 W/cm2)
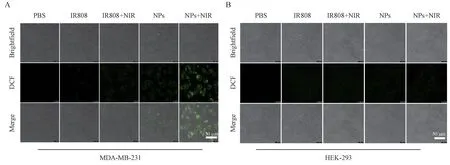
Figure 8 Confocal images of DCF for detection of reactive oxygen species generation in MDA-MB-231 cells(A)and HEK-293 cells(B)NIR irradiation(808 nm,0.5 W/cm2)for 2 min. Green:DCF(Ex was 502 nm and Em was 520-540 nm);Scale bars:50µm
通过激光共聚焦荧光显微镜和流式细胞仪进一步研究了CAT@HA-DOX-IR808 NPs 在MDAMB-231 和HEK-293 细胞内的摄取和成像情况。如图 9-A 所示,MDA-MB-231 细胞(CD44 高表达)与DOX 和IR808 孵育后具有较弱的DOX(绿色)和IR808(红色)荧光信号,而当与CAT@HA-DOXIR808NPs 孵育时,MDA-MB-231 细胞展现出比游离药物更显著的荧光信号,这表明HA 和CD44 之间的靶向作用可以更有效地将药物输送到细胞。与HEK-293 细胞(CD44 低表达)(图9-B)相比,经过 CAT@HA-DOX-IR808 NPs 孵 育 后 ,MDA-MB-231 细胞具有更强的荧光信号,即CAT@HA-DOXIR808 NPs 更容易进入CD44 高表达的细胞。通过在CAT@HA-DOX-IR808 NPs 进行孵育之前HA 的提前孵育,该组的MDA-MB-231 细胞显示出的荧光强度比只进行CAT@HA-DOX-IR808 NPs孵育组的荧光强度弱得多,这是由于游离的HA 先与CD44 受体结合,占据了CAT@HA-DOX-IR808 NPs的结合位点,从而导致了CAT@HA-DOX-IR808 NPs进入细胞的数量明显减少。上述结果也表明,DOX、IR808和CAT 的修饰不会导致HA 靶向CD44的能力失活。
流式细胞仪分析结果进一步证实了上述结果。用DOX 的荧光强度来验证CAT@HA-DOXIR808 NPs进入细胞的情况。DOX在MDA-MB-231细胞(图9-C)中的荧光强度明显高于HEK-293(图9-D)。与其他组相比,CAT@HA-DOX-IR808 NPs组处理的MDA-MB-231 细胞显示出最高的荧光强度。这些结果表明,HA 对CD44 的靶向作用增强了细胞对CAT@HA-DOX-IR808 NPs的摄取。
3.9 体外抗肿瘤活性实验
通过MTT 法评价CAT@HA-DOX-IR808 NPs的抗肿瘤作用。如图10-A 所示,在MDA-MB-231细胞中,在所有测试浓度下,CAT@HA-DOX-IR808 NPs + NIR 组的细胞存活率明显低于DOX 组、IR808+NIR 组和 CAT@HA-DOX-IR808 NPs 组,这表明CAT@HA-DOX-IR808 NPs 的化疗-光动力联合疗法具有比单一疗法更显著的抗肿瘤作用。在NIR 光照射下,只有大约40%的MDA-MB-231细胞在最高浓度的CAT@HA-DOX-IR808 NPs下存活。

Figure 9 Cellular uptake of MDA-MB-231 and HEK-293 cellsConfocal images of MDA-MB-231 cells (A)and HEK-293 cells (B)and flow cytometry analysis of DOX entry of MDA-MB-231 cells (C)and HEK-293 cells (D). Blue:DAPI(Ex was 405 nm and Em was 420-460 nm);Green:DOX (Ex was 486 nm and Em was 575-590 nm);Red:IR808(Ex was 750 nm and Em was 750-780 nm);Scale bars:50µm
HEK-293 细胞作为CD44 低表达细胞,与MDA-MB-231 细胞存在不同的结果。如图10-B 所示,在所有测试浓度下,HEK-293 细胞的活力明显强于MDA-MB-231 细胞。此外,CAT@HA-DOXIR808 NPs 的化疗-光动力联合疗法的抗肿瘤作用甚至不如单纯的DOX 化疗。这些结果表明,CAT@HA-DOX-IR808 NPs 可以通过自身靶向递送、化疗-光动力治疗的协同作用从而达到更强的抗肿瘤活性。

Figure 10 Intracellular anti-tumor activity of CAT@HA-DOX-IR808 NPs in MDA-MB-231 cells(A)and HEK-293 cells(B)(xˉ± x,n = 3)The concentration of CAT@HA-DOX-IR808 NPs of every group were (A) 0.102 µg/mL, (B) 1.018 µg/mL, (C) 5.092 µg/mL, (D) 10.183 µg/mL, (E)20.367µg/mL,(F)40.733µg/mL,(G)81.466µg/mL and(H)101.833µg/mL. NIR irradiation(808 nm,0.5 W/cm2)for 2 min
4 结 论
本研究开发了一种基于HA、DOX、IR808 和CAT 自组装的用于乳腺癌体外荧光成像和治疗的纳米探针CAT@HA-DOX-IR808 NPs。该纳米探针具有良好的稳定性、生物相容性以及在酸性肿瘤微环境中快速释放药物的能力。该纳米探针具有以下4 个优点:(1)通过HA 靶向乳腺癌细胞表面过表达的CD44 受体,可实现高效的靶向药物递送;(2)IR808 可以实现乳腺癌细胞的 NIR 荧光成像;(3)CAT 与 H2O2反应产生氧气,可以提高光动力治疗的效果;(4)在肿瘤微环境(酸性)中,可实现pH 响应性药物释放,快速释放出DOX,在NIR的照射下发挥化疗-光动力治疗的协同作用,具有增强抗肿瘤效果的作用。因此,本研究构建的纳米探针在乳腺癌的体外荧光成像和治疗中具有良好的应用前景。
