土壤含水量驱动土壤病毒和细菌多度及其与土壤异养呼吸关系的变化
2022-11-12黄文文张全国
黄文文,张全国
1 河南科技学院资源与环境学院,新乡 453003 2 北京师范大学生物多样性与生态工程教育部重点实验室,北京 100875
病毒是地球上数量最多的生物类群[1],仅海洋中的病毒样粒子(virus-like particles,VLPs)就超过1030个[2]。有若干研究证实了海洋病毒是海洋藻类和细菌死亡率的主要贡献者、微生物多样性维持的关键影响因素和海洋系统生物地球化学循环的重要驱动因素[2—3]。如海洋生态系统中,光合作用固定的碳约有50%由于“病毒转轨”作用而未能流入更高营养级;病毒转轨过程中新产生的微生物有一半被病毒裂解,因此,约25%的固定碳由于病毒裂解而以CO2形式释放[4]。
人们对陆地生态系统中病毒的认识相对有限[5]。目前,土壤中被鉴定出的病毒种类仅约27000种[6],且大多数土壤病毒粒子被证实为噬菌体[7]。土壤噬菌体与土壤细菌群落组装和功能具有相关性[8]——它们通过捕食或寄生的方式控制细菌的数量,通过转导的方式促进细菌之间的基因转移,改变土壤环境中细菌的种类和多样性[9—11]。然而,也有学者认为,尽管一些针对土壤中特定细菌(如根瘤菌和植物病原菌)的噬菌体的研究证实了噬菌体捕食作用对细菌群落动态的影响,但土壤中90%以上的病毒粒子似乎都被强烈地吸附在土壤表面[3],因此,土壤病毒的捕食作用对土壤细菌群落结构和活性的总体影响仍不明确[12]。
土壤病毒多度因受土地利用方式[13—14]、土壤类型[12]、土壤湿度[15—17]和植被类型[7]等因素的影响而差异显著,如黄土平原土壤中每克干土的VLPs可达1.97×1010个[18],而热带沙漠土壤中仅有2.2×103个[19]。干燥条件下土壤病毒更容易失活[3],土壤病毒多度往往随含水量增加而上升[17], 但水分增加的同时也会导致蒸发加快进而对病毒产生负面影响[3]。因此,尽管土壤含水量是驱动土壤细菌和病毒多度变化的重要因素[15—16],但现有报道展示的数据还不足以明确其与土壤病毒多度的关系[7]。
土壤含水量可通过多种途径影响土壤异养呼吸[20],而病毒对细菌的下行控制作用可能是其中之一,如土壤含水量驱动土壤病毒-细菌多度比发生变化的过程[15—16],会影响病毒裂解细菌时释放的不稳定性碳的含量,进而影响到微生物生物量和土壤呼吸[7]。此前,施加病毒灭活剂的研究发现,由于病毒对细菌下行控制作用的存在,病毒多度的降低可以增加细菌多度进而加速土壤异养呼吸[21];但在另一项碳添加的微宇宙实验中,土壤新病毒的产生只是源于一部分宿主细菌,土壤呼吸速率随病毒多度的增加而增加[22]。因此,病毒既可通过降低细菌数量而减缓土壤异养呼吸,也可通过增加细菌群落的更新速率(活跃状态细菌数量上升)而加速土壤呼吸。然而,长期以来,人们却忽略了土壤微生物(细菌、古菌、真菌、原生动物和线虫)的捕食者和寄生者——病毒——在水分引起土壤异养呼吸变化过程中的作用。本研究比较不同含水量条件下土壤细菌、病毒以及异养呼吸速率的变化规律,推断病毒对细菌的下行控制作用是否受水分条件的影响,从土壤细菌和病毒多度与呼吸速率的关系,推断病毒下行控制影响土壤呼吸速率的机制,以期了解含水量对土壤生态系统中病毒下行控制作用的影响,为陆地生态系统中病毒-细菌关系的相关研究提供理论依据。
1 材料与方法
1.1 土壤采集
以北京师范大学生物园内试验田(39°57′43″ N,116°21′21″ E)的土壤作为供试土壤。于2020年12月6日,将地面0—15 cm处的土壤去除凋落物和较大砂砾后,充分混匀,过2 mm筛,带回实验室。试验田年均温度为11—13℃,年均降水量约644 mm,土壤类型为褐土。生长季所种作物为玉米(Zeamays)。玉米收获后,地上部分有狗尾草(Setariaviridis)、蓟(Cirsiumjaponicum)和牵牛(Pharbitisnil)等零星生长。本研究采集土壤样品时,上述植物均已凋亡。
1.2 土壤培养试验
经烘干法确定土壤含水量后,所采土壤样品被分装至96个250 mL的蓝盖瓶中,每个微宇宙瓶装入相当于200 g干重的鲜土,置于26 ℃的培养箱中预培养12 d,以便土壤微生物有充足的时间在新环境中恢复生长。预培养期间,每2 d校正一次水分,使每个微宇宙瓶的土壤含水量保持在13%(接近原土壤含水量)。预培养结束后,将96个微宇宙瓶随机分为3组,并参考Zhang和Zhang的研究[23]将土壤含水量设置为3个水平:恒定低水分处理(土壤含水量为13%,接近田间持水量的39%);恒定高水分处理(含水量为26%,接近田间持水量的78%)和波动水分处理(土壤含水量在26%—13%之间波动) (图1),设置水分处理的这一天记作培养试验第0天。除测定土壤呼吸的阶段之外(见1.3),微宇宙开放瓶盖培养。整个试验期间,低水分和高水分处理的土壤微宇宙,每2 d校正一次含水量;波动水分处理的微宇宙,在第0天将水分调至26%后,每2 d测定一次,当平均含水量低于13%时,将所有微宇宙含水量调至26%(水分校正时间在第0天和第18天)。试验过程中对微宇宙进行了4次破坏性采样(采样时间在培养试验的第2、16、22天和第34天,对应的波动水分处理的土壤含水量分别为26%、13.33%、26%和17.49%),每次破坏性采样时,3个水分处理各有8个微宇宙被采样。本试验对时间因素的研究采用的是空间代替时间策略,在不同时间点上破坏性取样不同的土壤微宇宙。
1.3 土壤呼吸测定
每个土壤微宇宙在破坏性取样之前进行了土壤呼吸测定。每次测定土壤呼吸时,微宇宙密闭培养2 d或4 d——使用橡胶瓶塞封闭瓶口。注射器针头连接CO2浓度分析仪后,刺透橡胶瓶盖,对闭盖培养前和培养后的土壤微宇宙空气中CO2浓度进行测定。通过向微宇宙中装入已知体积的干土来估计每个土壤微宇宙的气体体积。每次土壤呼吸测定之后,立即进行相应的破坏性采样。
1.4 土壤细菌和病毒提取
每个土壤样品分别提取三份细菌和病毒悬浮液。土壤细菌的提取采用密度梯度离心法[24]。将0.2 g鲜土、0.44 g 聚乙烯吡咯烷酮(Polyvinylpolypyrrolidone, PVPP)和800 μL无菌水加入1.5 mL离心管,高速涡旋1 min,4℃ 100×g离心2 min,吸取350 μL离心后的土壤悬浮液至装有700 μL密度梯度分离液OptiPrep (1.32 g/mL)的2 mL离心管上层,4℃ 13000×g离心30 min后,去除375 μL上层上清液,将剩余的675 μL液体转移至新的2 mL离心管中,加1350 μL无菌水后,将二者轻轻涡旋混匀,4℃ 13000×g离心20 min, 去除1700 μL上层悬浮液,以洗去菌液中的游离DNA碎片,余下的液体在4℃ 13000×g离心10 min,弃除残余液体后,向离心管内加入1.5 mL 1% TE缓冲液,振荡混匀后,将细菌提取液转移至冻存管,并加入50%丙三醇,振荡10 s,使用液氮速冻后储存于- 80 ℃条件下待用。
土壤病毒提取在Ashelford等[25]和 Williamson等[9]方法的基础上略作修改。向盛有5 g鲜土和20颗无菌钢珠的50 mL离心管加入20 mL 1%的柠檬酸钾溶液(每1L柠檬酸钾溶液中,含10 g C6H5K3O7· H2O,1.44 g Na2HPO4· 7H2O,0.24 g KH2PO4,pH=7;溶液配制后储存于4℃条件下),高速涡旋1 min后,在200 rpm的条件下振荡10 min,转移至4℃的黑暗环境中孵育15 min,以实现病毒粒子和土壤团聚体的物理分散。4℃ 2000×g离心30 min后,将此时获取的上清液过0.22 μm孔径的无菌针头式过滤器去除细菌和土壤小颗粒。将滤液转移至冻存管,经液氮速冻后储存于- 80℃冰箱。
1.5 土壤细菌和病毒计数
使用荧光染料SYBR Green I对土壤细菌细胞和病毒样粒子进行染色[26]后,通过荧光显微镜对土壤细菌和病毒进行计数[18]。取200 μL解冻后的土壤细菌提取液,加入1800 μL无菌水稀释;用无菌镊子夹取25 mm直径,0.8 μm孔径的NC膜放在0.45 μm孔径的抽滤承载装置上,用无菌水将NC膜完全湿润后,再夹取直径25 mm,孔径0.2 μm的Isopore滤膜置于NC膜上,使二者紧密贴合,连接过滤柱,将稀释过的细菌提取液加入抽滤装置,打开抽滤泵直至菌液抽滤完成。
取900 μL解冻后的土壤病毒液,加入100 μL 10 × DNase I反应缓冲液和2 μL DNase I(2500 U/mL),颠倒混匀,置于37 ℃条件下,以去除病毒液中的游离DNA,30 min后,加入35 μL 0.5 mol 的EDTA终止反应。取200 μL 经DNase I处理过的土壤病毒液,加入1800 μL无菌水稀释。用无菌镊子夹取NC膜放在抽滤承载装置上,待其完全湿润后,夹取直径25 mm,孔径0.02 μm 的Al2O3Anodisc滤膜置于NC膜上,连接过滤柱,加入稀释过的病毒提取液,打开抽滤泵直至病毒液抽滤完成。
当细菌或病毒样品抽滤完成后,加500 μL 5 × (原液稀释2000倍)的SYBR Green I荧光染料,黑暗中染色20 min,将染料抽滤干净,在抽滤泵开着的情况下,用移液枪吸取1mL无菌水清洗抽滤装置3—5次,细菌或病毒滤膜制作完成。
在干净的载玻片中央加30 μL荧光抗淬灭剂(每1 mL荧光抗淬灭剂含500 μL PBS, 500 μL丙三醇,0.001—0.003 g对苯二胺),用无菌镊子夹取细菌或病毒滤膜置于其上,再加30 μL抗淬灭剂在细菌或病毒滤膜上,盖上盖玻片,轻轻按压至无气泡。细菌和病毒装片制作完成后,立即使用荧光显微镜对其进行拍照,它们在450—490 nm波长的蓝光激发下呈亮绿色。每个玻片至少随机拍摄10个视野。细菌和病毒多度使用ZEISS ZEN 3.0软件计数。
1.6 数据分析
在 R[27]环境下对数据进行分析。本试验在不同时间点对土壤微宇宙进行破坏性取样,因此将不同时间点上的土壤微宇宙视为独立样本进行分析。数据分析前对细菌和病毒多度进行以10为底的对数转化,病毒-细菌多度比(virus-to-bacteria ratio, VBR)做平方根转化。对于波动水分处理的土壤微宇宙,时间可能不是一个有意义的解释变量,因为其作用可能与水分变化的作用相混淆。因此,以采样时间作为随机效应,使用线性混合效应模型(lmer)[28]分析土壤湿度对土壤呼吸速率、细菌多度、病毒多度和VBR值的影响(gaussian family),并使用“lsmeans”包对不同水分处理进行多重比较。用单因素方差分析比较不同时间点土壤微宇宙的呼吸速率、细菌和病毒多度的差异。
土壤含水量、细菌多度、病毒多度和土壤呼吸速率这些变量之间可能存在着相对复杂的影响途径,比如土壤含水量可以通过物理化学过程直接影响土壤呼吸,也可能通过改变细菌多度进而影响呼吸速率。受限于变量数量和实验样本量,本试验的数据无法使用结构方程模型进行分析,因此,本研究使用了三个递进式的广义线性模型(glm)[28]对上述变量进行分析:第一,分析观测含水量如何影响细菌多度;第二,分析观测含水量和细菌多度如何影响病毒多度;第三,分析观测含水量、细菌多度和病毒多度如何影响土壤呼吸。用“car”提供的“Anova”功能(Type II test)来估计解释变量影响的显著性。
2 结果
2.1 土壤细菌多度、病毒多度以及土壤异养呼吸速率对土壤含水量变化的响应
在三种水分处理下,土壤细菌多度皆高于病毒多度。相较于更接近自然状况的低含水量(13%)处理,高水分处理和波动水分处理都未能显著改变细菌多度,但显著增加了病毒多度(P<0.001),也相应地增加了病毒-细菌多度比(P=0.0026) (表1)。在低水分处理下,不同时间点采样的土壤微宇宙的细菌多度无显著差异,但病毒多度显著降低(F3,28=10.74,P<0.001)。在高水分处理下,细菌和病毒多度并非随时间保持恒定,而是表现出了动荡的信号:第16天细菌多度显著高于第2天(P=0.0211),第22天则极显著降低(P<0.001),在第34天恢复到与第2天无显著差异(P=0.9849);病毒多度在第2、16天和第22天之间逐渐增加,而在第34天显著低于第16(P=0.0205)和22天(P=0.0121),病毒-细菌多度比则在第22天为最高(F3,28=7.88,P<0.001)。波动水分处理下,土壤细菌和病毒多度均未随时间推移表现出明显的变化(图1)。
高水分和波动水分处理的土壤呼吸速率皆极显著高于低水分处理(P<0.001) (表1)。随时间推移,低水分处理的土壤微宇宙呼吸速率极显著降低(F3,28=86.18,P<0.001),高水分处理的土壤微宇宙呼吸速率先升高后降低(F3,28=34.97,P<0.001),波动水分处理的土壤微宇宙呼吸速率则与土壤含水量的变化紧密相关(F3,28=64.58,P<0.001)(图1)。
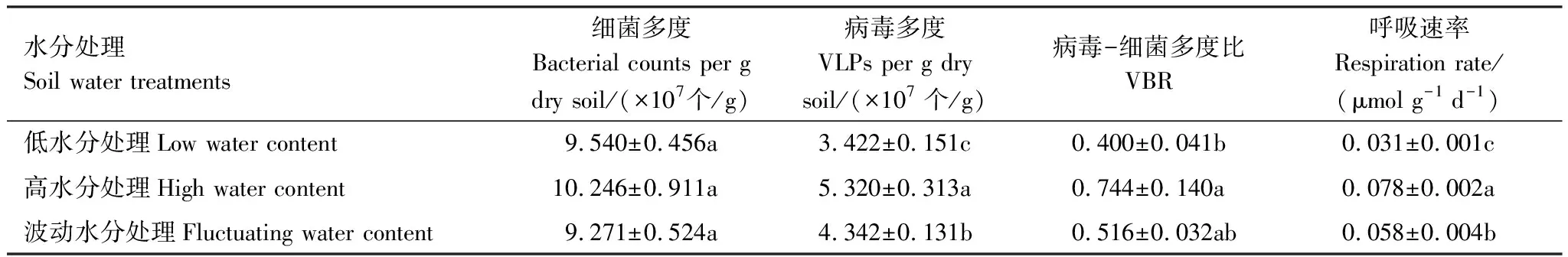
表1 土壤细菌多度、病毒多度、病毒-细菌多度比和呼吸速率对不同水分处理的响应
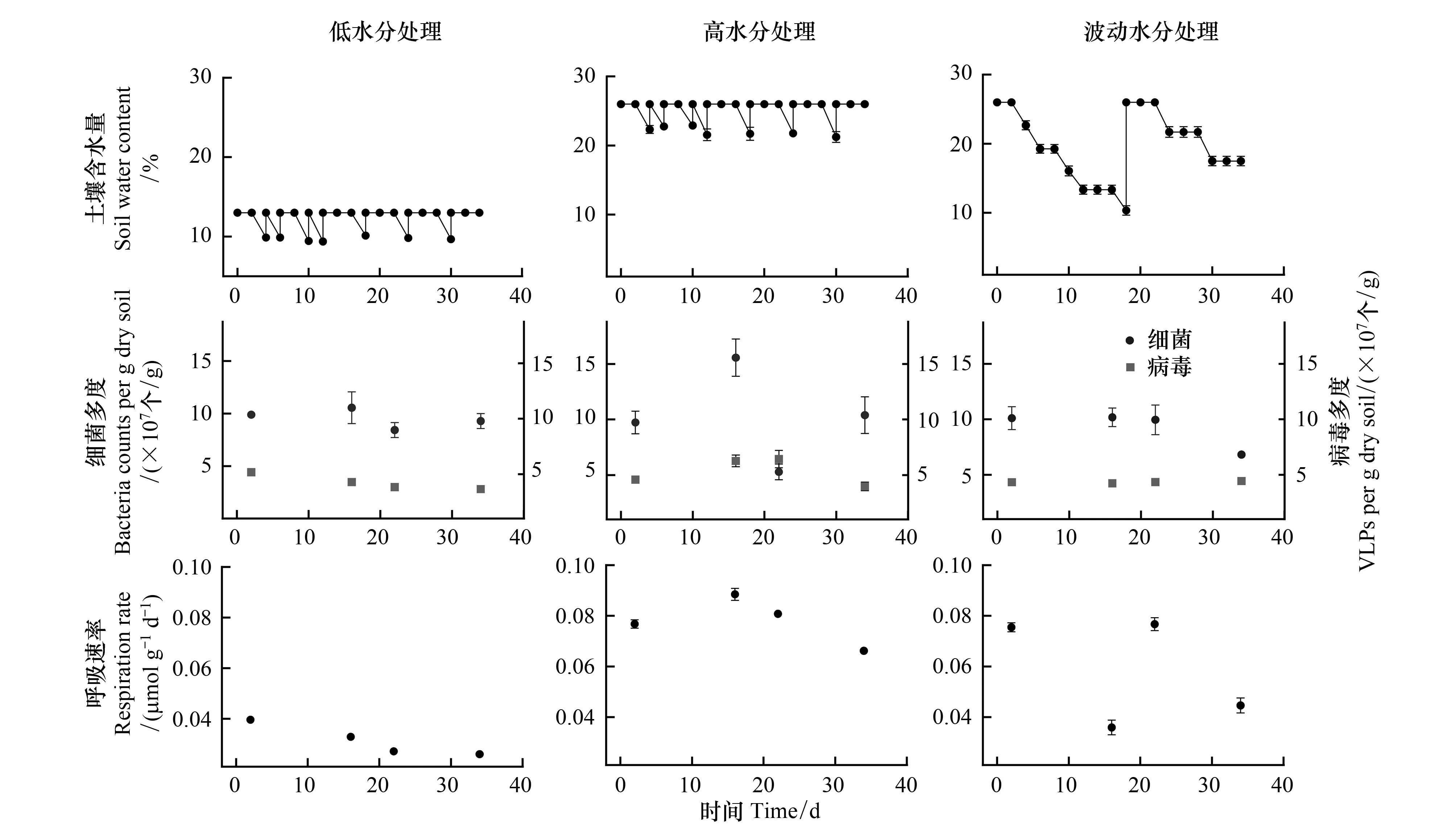
图1 低水分、高水分和波动水分处理土壤微宇宙的细菌多度、病毒多度和呼吸速率随时间的变化(数据为平均值±标准误,n=8)Fig.1 Changes of soil bacterial abundance, viral abundance and respiration rate of the low-, high- and fluctuating-water content microcosms over time (Data show mean±SE, n=8)
2.2 土壤呼吸速率与土壤含水量、细菌多度和病毒多度之间的关系
由表2可知,土壤含水量与病毒多度呈显著正相关(P<0.001),而与细菌多度无显著的相关关系(P=0.9173)。土壤含水量(P<0.001)、细菌多度(P=0.0045)和病毒多度(P<0.001)均与土壤呼吸速率具正相关关系。

表2 土壤呼吸速率、含水量、细菌多度、病毒多度之间的相关性
3 讨论
不同环境中病毒多度存在较大差异,土壤中VBR变幅更大[29],一些关于土壤生态系统的研究发现病毒多度高于细菌多度[9, 18];但也有细菌多度高于病毒多度的情况[10, 16, 19, 25]。本研究的结果与后者相一致(表1),这一结果支持此前学者提出的观点:农田土壤可能受施肥[30]和根际效应[6,10,25,31]的影响,而表现出细菌多度高于病毒多度的现象。
3.1 土壤含水量对细菌多度、病毒多度和异养呼吸速率的影响
土壤病毒是否会对细菌产生明显的下行控制,这一基本问题目前并无明确答案[31]。一般认为,在相对干旱的土壤中(如本研究的供试土壤),含水量上升会促进微生物生长[16,32]。本研究发现土壤水分上升并不会增加细菌多度,与此同时,病毒多度上升,且病毒-细菌比例上升(表1,图1),这暗示着在高水分土壤中病毒造成的下行控制可能会有效地阻止细菌数量上升;而在低水分处理中,更低的病毒-细菌比例暗示着更弱的下行控制。这一结果和资源充足环境中下行控制更重要的主流观点是一致的[2],即病毒造成多么重要的下行控制很可能依赖于环境资源水平[7]。当然,土壤生境中病毒和细菌的关系可能比本文描述的要复杂,特别是温和性噬菌体对细菌是否会造成下行控制[33],以及当这种下行控制作用受到环境因子影响时所表现出的显著差异——如Virginia一处山地土壤中存在着病毒对细菌的下行控制作用,而湿地土壤中则没有[16]。
值得注意的是,土壤水分的改变不一定仅通过改变细菌而间接影响病毒。土壤干燥会影响病毒失活的速率,尤其是干燥程度低于某个临界点时,水分蒸发和土壤湿度过低,会导致病毒失活[3],如I型脊髓灰质炎病毒在18%—2.9%水分含量之间的失活率基本相同,但当水分含量在1.2%—0.6%之间时,病毒的失活率显著增加[34]。本研究中病毒多度的变化和上述研究相似:土壤含水量在26%—13%之间波动时,病毒多度无显著差异;但当土壤湿度持续在13%时(两次校正水分的时间段内,土壤含水量维持在10%—13%),水分蒸发可能会显著影响病毒多度(图1)。
本研究发现,土壤含水量与土壤呼吸速率密切相关(表2):在恒定低水分处理的土壤微宇宙中,随时间推移,土壤呼吸速率显著下降,这可能是因为当土壤干燥到一定程度后,微生物的生理状况以及营养物质在土壤孔隙中的扩散受到限制,土壤微生物的代谢活动降低[35],土壤团聚体和土壤胶体的结合更加紧密,因此,大部分土壤有机质难以被土壤微生物分解[36],从而抑制了土壤呼吸(图1);相较于过高或过低的土壤含水量,适中的含水量会获得最高的土壤呼吸速率[37],在本研究的恒定高水分处理下,土壤呼吸出现先上升后下降的趋势,但总体而言,高水分处理下的土壤呼吸速率要显著高于低水分和波动水分处理(表1,图1)。波动水分处理下(本研究中波动水分的处理与自然界中降水模式对土壤生态系统的影响高度相似)的土壤微宇宙,其呼吸速率与含水量变化趋势一致(图1),这一现象和“Birch效应”[38]高度吻合,即突然的“降水”能增加土壤的呼吸速率[23]。
3.2 病毒-细菌关系对土壤异养呼吸速率的影响
本研究中,土壤含水量、细菌多度和病毒多度都是呼吸速率的正向显著预测变量(表2)。现有研究表明,含水量和细菌多度对呼吸速率的作用比较明确[20],而病毒多度的作用尚无答案。一般认为,病毒多度可能通过两个途径对呼吸速率产生影响:第一,病毒颗粒本身是呼吸过程的底物,但相较于细胞形态的生物质,病毒颗粒具有较低的碳含量[3],因此病毒多度通过此途径影响呼吸速率的作用可能有限;第二,病毒对细菌的下行控制作用影响了土壤呼吸速率。宿主细菌被噬菌体裂解之后,释放出病毒颗粒,并产生细胞碎片,增加了土壤中不稳定性碳的含量,进而增加了土壤微生物生物量和土壤呼吸[7]。本研究中,病毒多度的上升没有造成细菌数量的明显改变(表2),这可能是因为,尽管大多数的环境病毒都是噬菌体,但土壤生态系统中已知的2000多种噬菌体仅感染11个细菌门的宿主[7],且其中85%的噬菌体只感染γ变形菌门、厚壁菌门和放线菌门的细菌[39],因此,噬菌体裂解细菌的过程可能造成细菌群落中那些被病毒感染的种群处于活跃生长阶段(有更高的代谢速率和分解有机物的潜能)[11],而这些活跃着的病毒和细菌种群贡献了大量的CO2流出[40]。当然,更高的病毒多度意味着更高的微生物死亡率[41],亦即更快速的微生物群落更新,而更快的更新可能伴随着群落物种组成的改变[7]。
4 结论
本研究发现,相较于恒定低含水量,波动含水量显著增加了土壤病毒多度和土壤异养呼吸速率。恒定高含水量也显著增加了土壤病毒多度,且病毒对细菌的下行控制作用增强,阻止了土壤细菌多度的上升;此外,病毒多度的增加可能使土壤中受噬菌体影响的那部分细菌处于活跃生长阶段,从而增加了土壤异养呼吸速率。结果表明,土壤含水量对土壤病毒多度的变化产生了重要影响,并对病毒多度和细菌多度与土壤异养呼吸关系驱动的过程做出了潜在贡献。因此,土壤病毒对土壤微生物造成的下行控制可能是碳循环等生态过程的重要决定因素。
与水体病毒生态学的研究进展相比,人们对土壤生态系统中细菌及其噬菌体之间的相互作用知之甚少。本研究初步揭示了不同含水量对土壤中病毒和细菌关系变化的影响,以及生态系统功能对这种关系变化的反馈,扩大了人们对土壤生态系统中细菌-病毒关系的认知,为土壤生态系统中病毒对微生物群落结构影响等相关研究提供了理论支撑。
致谢:感谢圣路易斯华盛顿大学(Washington University in Saint Louis)梁小龙博士在土壤病毒装片过程中给予的帮助。
