p53、p16、细胞周期蛋白D1、E-钙黏蛋白在脂肪肉瘤中的表达及意义
2022-11-12寇天雷朱金磊孙书磊刘继尧郑淑芳
寇天雷, 何 轩, 朱金磊, 孙书磊, 刘继尧, 郑淑芳
(中国人民武装警察部队特色医学中心 病理科, 天津, 300162)
脂肪肉瘤是一种由分化程度及异型程度不同的脂肪细胞组成的常见软组织恶性肿瘤,约占软组织肉瘤的1/5[1]。脂肪肉瘤多发生于下肢深部软组织与腹膜后,无特殊症状和体征,起病隐匿,缓慢性生长,患者往往在发现巨大肿块后才到院诊治。脂肪肉瘤的临床治疗方式主要为手术切除,但手术难以将其完整切除,复发率高,患者常被迫进行多次手术,最终可致死[2]。因此,寻找有效的靶向基因治疗方法对于改善脂肪肉瘤患者的预后极为重要。p53是多种恶性肿瘤的独立预后因素[3], p16是特异的细胞周期抑制剂,细胞周期失控是癌变的重要病因,细胞周期蛋白D1(cyclinD1)作为细胞周期调控因子参与肿瘤的发生与发展,而p53与p16可调控cyclinD1的表达[4]。另外,恶性肿瘤细胞的分化、浸润与转移是肿瘤细胞与外环境相互作用的结果,具体体现在控制细胞移动及细胞转归的E-钙黏蛋白(E-cad)表达与功能异常[5]。本研究采用免疫组织化学法检测p53、p16、cyclinD1、E-cad蛋白在脂肪肉瘤中的表达情况,并探讨这4种蛋白表达与脂肪肉瘤患者临床病理特征及预后的关系,以期为脂肪肉瘤的诊治及预后评估提供参考,现报告如下。
1 对象和方法
1.1 研究对象
将中国人民武装警察部队特色医学中心病理科2009—2016年收治的42例确诊脂肪肉瘤的患者作为研究对象,收集患者手术切除的肉瘤组织及肉瘤旁组织。纳入标准: ① 经病理检查确诊脂肪瘤者; ② 手术前意识清晰,病情稳定,配合治疗者; ③ 无严重心、肝、肾和脑功能障碍者。排除标准: ① 资料不全,不配合治疗,随访信息不完整者; ② 合并其他良恶性肿瘤者; ③ 妊娠期或哺乳期女性。42例脂肪肉瘤患者中,男18例,女24例; 年龄26~80岁,平均(55.57±14.68)岁; 肉瘤最大径3.0~25.0 cm, 平均(11.64±5.39) cm; 肉瘤部位为四肢18例,躯干24例; 临床TNM分期为Ⅱ期11例、Ⅲ期22例、Ⅳ期9例; 病理类型为黏液型17例、多形型15例、去分化型10例; 多发病灶6例,单发病灶36例; 局部复发5例,无复发37例; 远处转移5例,无转移37例。本研究经医院医学伦理委员会审查批准。
1.2 病理检测方法
取手术获得的不同病理类型的脂肪肉瘤组织及肉瘤旁组织,将组织置于10%中性福尔马林固定48 h, 梯度酒精脱水,二甲苯透明,常规石蜡包埋, 4 μm厚度切片,苏木精-伊红(HE)染色,光镜下观察。
1.3 免疫组织化学检测方法
采用免疫组织化学PV-6000两步法染色,取“1.2”项所得切片常规脱蜡水化,微波加热,滴加一抗, 4 ℃过夜,滴加二抗, DAB显色,苏木精复染,脱水透明封固。采用已知阳性切片作为阳性对照,用磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
按阳性染色强度和阳性细胞所占百分比进行评分。染色强度评分: 0分为无色, 1分为浅黄色, 2分为棕黄色, 3分为深棕黄色或褐色。阳性细胞所占百分比评分: 0分为阴性, 1分为1%~25%, 2分为>25%~50%, 3分为>50%~75%, 4分为>75%。积分=染色强度评分+阳性细胞占比评分,积分0~1分为阴性,积分≥2分为阳性。每张切片由2名病理科医师以双盲法独立判断结果。鼠抗人p53、p16、cyclinD1和E-cad单克隆抗体及免疫组织化学试剂盒均购自北京中杉金桥生物技术有限公司。
1.4 统计学分析
采用SPSS 18.0统计学软件分析数据,计数资料进行χ2检验,不同蛋白表达的生存分析采用Log-rank分析,生存曲线采用GraphPad Prism 8.0制作。检验水准α=0.05, 双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 不同病理类型脂肪肉瘤组织的HE染色结果
黏液型脂肪肉瘤: 肉瘤具有明显的黏液背景,可见薄壁的分枝状(鸡爪样)血管,多见脂肪母细胞呈星形或短梭形,少见多核脂肪母细胞,瘤细胞核浓染类似墨水点样(黏液型脂肪肉瘤细胞的典型特征),小血管明显扩张,密集排列,瘤细胞成分显著减少,容易与淋巴管瘤混淆。
多形性脂肪肉瘤: 肉瘤细胞异型性明显,可见瘤巨细胞或多核瘤细胞,胞浆丰富,可见脂肪空泡。去分化型脂肪肉瘤: 大多数瘤细胞核仁不明显或可见小的核仁。肉瘤细胞胞浆少,细胞之间无细胞连接。见图1。
2.2 p53、p16、cyclinD1和E-cad蛋白在脂肪肉瘤组织及肉瘤旁组织中的表达情况
p53、p16、cyclinD1和E-cad蛋白主要位于肉瘤细胞核。与肉瘤旁组织相比,脂肪肉瘤组织p53和E-cad蛋白阳性表达率较低, p16和cyclinD1蛋白阳性表达率较高,差异有统计学意义(P<0.05)。见表1、图2。
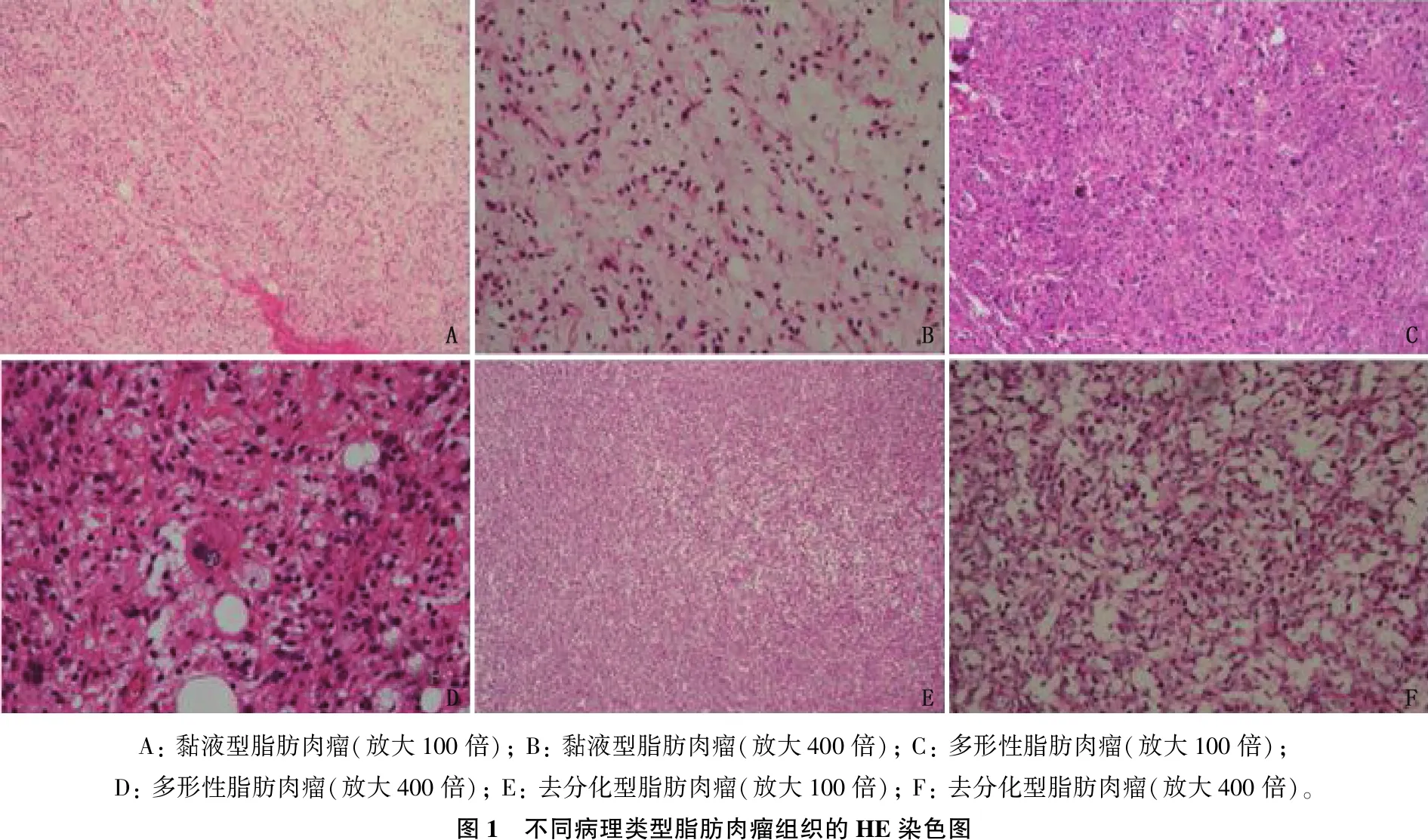
A: 黏液型脂肪肉瘤(放大100倍); B: 黏液型脂肪肉瘤(放大400倍); C: 多形性脂肪肉瘤(放大100倍); D: 多形性脂肪肉瘤(放大400倍); E: 去分化型脂肪肉瘤(放大100倍); F: 去分化型脂肪肉瘤(放大400倍)。图1 不同病理类型脂肪肉瘤组织的HE染色图
2.3 p53、p16、cyclinD1和E-cad蛋白表达与脂肪肉瘤患者临床病理特征的关系
不同性别、年龄、肉瘤直径和是否多发病灶患者的p53、p16、cyclinD1、E-cad蛋白阳性表达情况比较,差异均无统计学意义(P>0.05); 不同肉瘤部位、TNM分期、病理类型和有无局部复发、有无远处转移患者的p53、p16、cyclinD1、E-cad蛋白阳性表达情况比较,差异均有统计学意义(P<0.05)。见表2、表3。
2.4 p53、p16、cyclinD1、E-cad蛋白表达与脂肪肉瘤患者预后的关系
本研究42例患者均获得随访,随访率为100.00%(42/42), 截至2021年随访结束时,生存25例(59.52%), 死亡17例(40.48%, 均由脂肪肉瘤复发或恶化引起)。p53阳性表达患者、E-cad阳性表达患者中死亡人数分别少于p53阴性表达患者、E-cad阴性表达患者,差异均有统计学意义(P<0.05); p16阳性表达患者、cyclinD1 cyclinD1: 细胞周期蛋白D1; E-cad: E-钙黏蛋白。
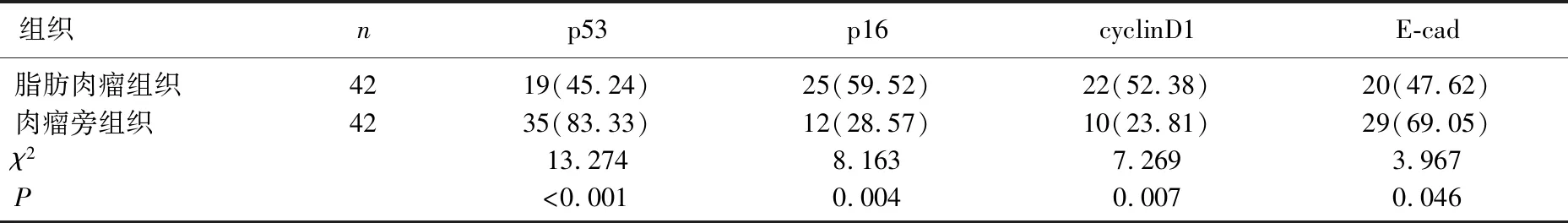
表1 p53、p16、cyclinD1和E-cad蛋白在脂肪肉瘤组织及肉瘤旁组织中的阳性表达情况[n(%)]
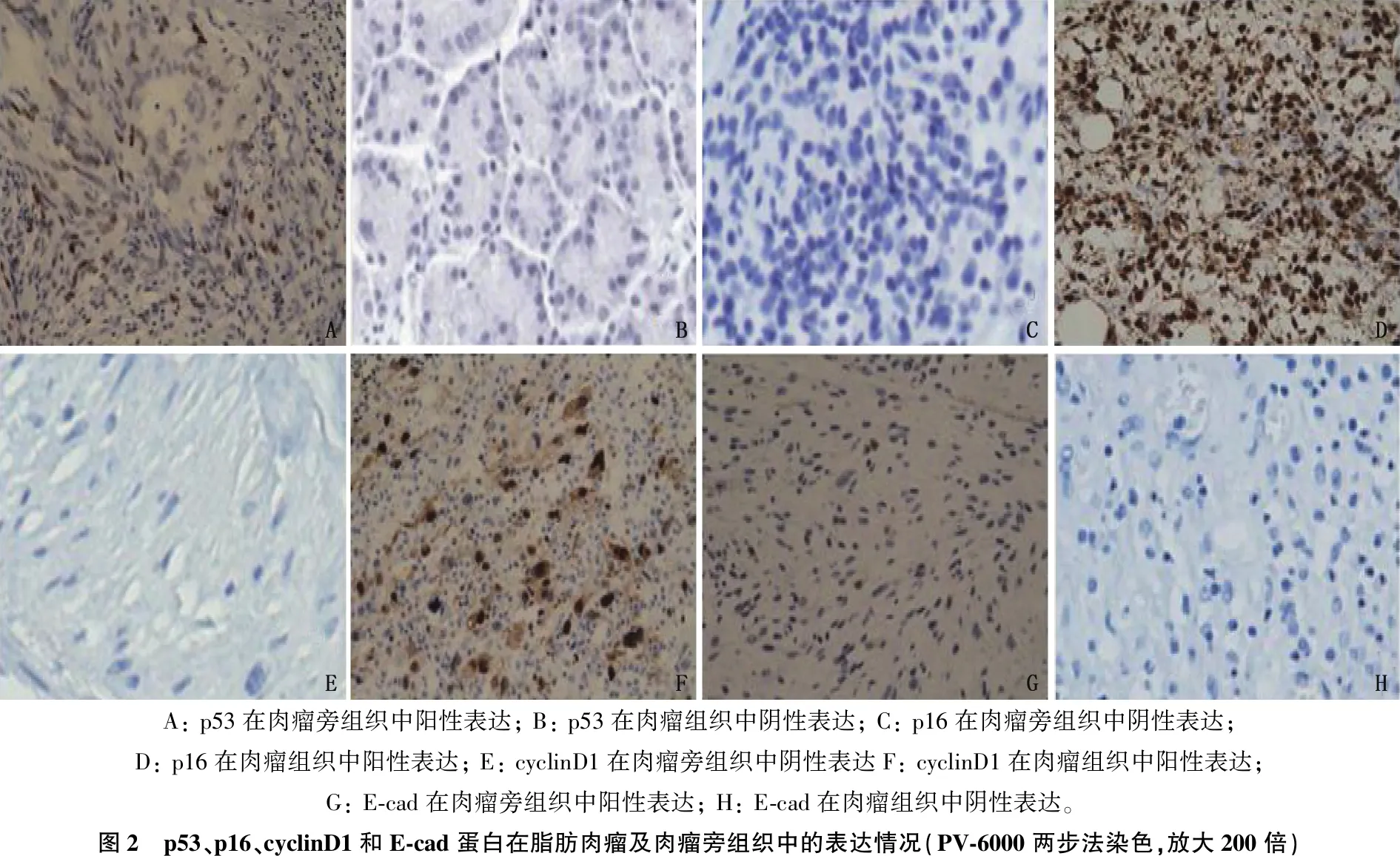
A: p53在肉瘤旁组织中阳性表达; B: p53在肉瘤组织中阴性表达; C: p16在肉瘤旁组织中阴性表达; D: p16在肉瘤组织中阳性表达; E: cyclinD1在肉瘤旁组织中阴性表达F: cyclinD1在肉瘤组织中阳性表达; G: E-cad在肉瘤旁组织中阳性表达; H: E-cad在肉瘤组织中阴性表达。图2 p53、p16、cyclinD1和E-cad蛋白在脂肪肉瘤及肉瘤旁组织中的表达情况(PV-6000两步法染色,放大200倍)
阳性表达患者中死亡人数分别多于p16阴性表达患者、cyclinD1阴性表达患者,差异均有统计学意义(P<0.05)。见表4、图3。
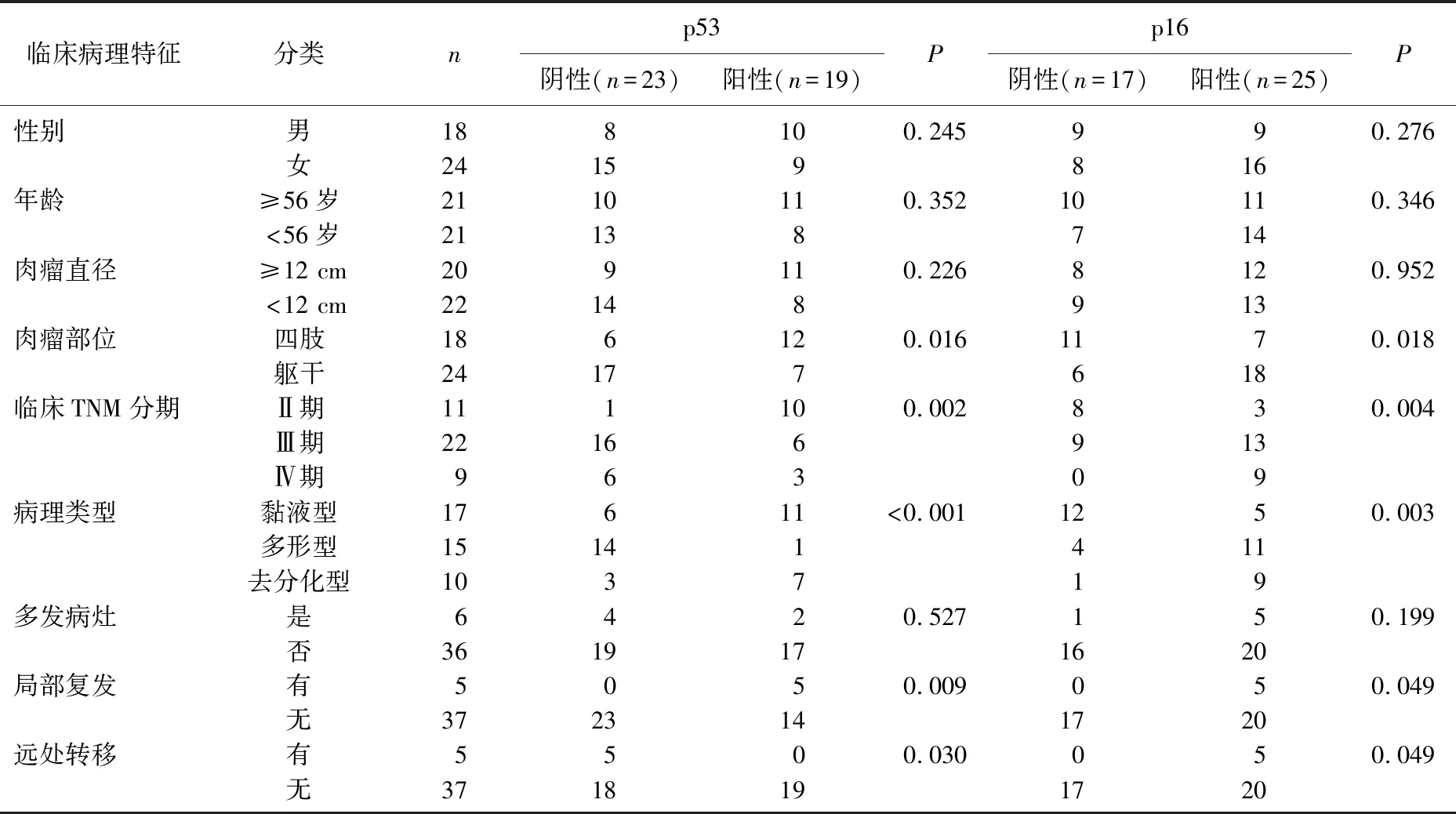
表2 p53、p16蛋白表达与脂肪肉瘤患者临床病理特征的关系 例
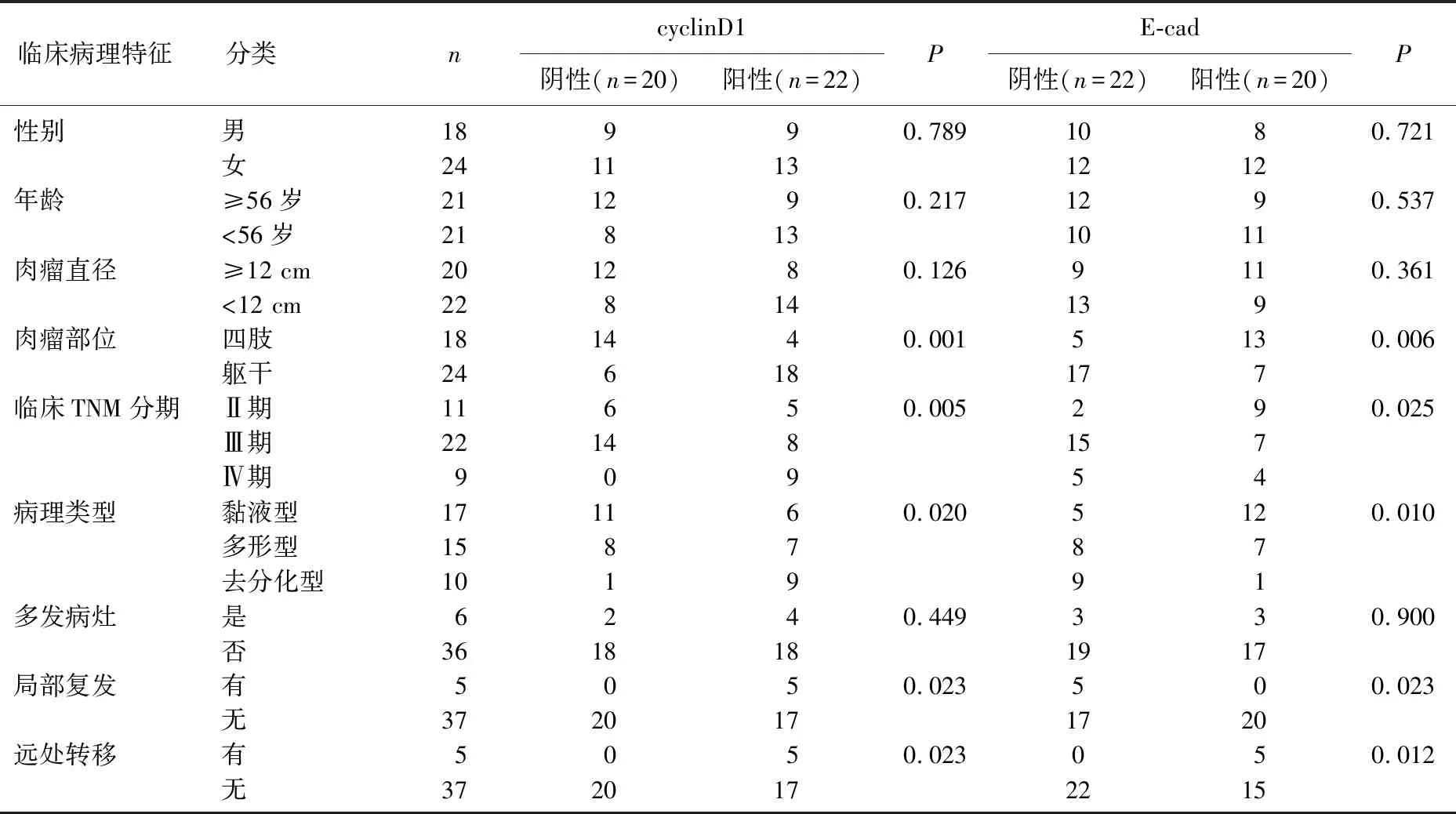
表3 cyclinD1、E-cad蛋白表达与脂肪肉瘤患者临床病理特征的关系 例

表4 不同p53、p16、cyclinD1和E-cad蛋白表达情况脂肪肉瘤患者的预后情况 例

3 讨 论
脂肪肉瘤是在脂肪母细胞向脂肪细胞分化的各个阶段均可发生的恶性肿瘤,其发病率居软组织恶性肿瘤前列,临床初始症状多不明显,病理检查结果显示局部软组织存在浸润,其发病原因尚未阐明。
p53基因定位于人类染色体17p13, 是多种肿瘤的重要基因,其蛋白的异常表达现象出现在多种肿瘤中。野生型p53基因是一种抑癌基因,可抑制肿瘤细胞生长,促进肿瘤细胞分化,使肿瘤细胞停留在G1期,通过诱导凋亡的方式消除异常细胞, p53失活对肿瘤形成起着重要作用, p53突变的细胞修复损伤DNA的效力降低,进而导致肿瘤细胞增殖能力增强[6]。本研究结果显示,不同肉瘤部位、TNM分期、病理类型和有无局部复发、有无远处转移患者的p53蛋白阳性表达情况比较,差异有统计学意义(P<0.05), 其中肉瘤位于四肢、TNM分期为Ⅱ期、黏液型脂肪肉瘤、无复发和无远处转移患者的p53阳性表达率较高,且p53阳性表达患者生存时间较长,提示随着脂肪肉瘤恶性程度的增加, p53蛋白表达减少。本研究结果佐证了p53是一种抑癌基因,其失活可促进肿瘤的发生与发展,这也是一些研究认为增加p53蛋白的稳定性、延长其半衰期,有助于延长恶性肿瘤患者生存期的可能原因。AVALLONE G等[6]研究显示,犬脂肪肉瘤的p53表达与病理类型相关,在高分化型中呈阳性。ZUCO V等[7]收集8例脂肪肉瘤患者的肉瘤组织,发现均为p53基因突变,其中7例患者p53无表达。GONG L H等[8]收集2009—2017年北京积水潭医院9例四肢去分化脂肪肉瘤患者的肉瘤组织,免疫组织化学结果显示p53阳性者仅1例。但p53表达与脂肪肉瘤的关系仍存在争议,例如孙萍萍等[9]分析114例腹膜后脂肪肉瘤患者的资料后发现, p53阳性百分比≥70%的患者生存中位数为21.1个月, <70%患者的生存中位数为56.3个月,提示p53表达可能对肿瘤细胞增殖存在双重作用,但仍需进一步深入研究。
与p53基因相似,E-cad也是一种抑癌基因,其功能丧失参与了肿瘤的发生和发展。E-cad丧失功能后,组织内细胞黏附强度显著降低,细胞活动性增加,肿瘤细胞可穿过基底膜并提升分化和侵袭能力,即细胞上皮间质转化,而上皮间质转化在肿瘤细胞的恶性表型中扮演重要角色。本研究结果显示,不同肉瘤部位、TNM分期、病理类型和有无局部复发、有无远处转移患者的E-cad阳性表达情况比较,差异有统计学意义(P<0.05), 且E-cad阳性表达患者生存时间较长,提示随着脂肪肉瘤恶性程度的增加, E-cad蛋白表达减少,与XIONG D等[10]研究结论相似。
p16的氨基末端存在与cyclinD1周期素盒编码区同源的区域,故两者异常表达在肿瘤的发生和发展过程可相互协同,使肿瘤细胞获得显著的生长优势。正常组织不表达p16和cyclinD1, 但发生恶变后, p16和cyclinD1表达将显著增高。刘族志等[11]报道口腔癌患者cyclinD1阳性率(40.00%)显著高于对照组(14.29%), 而p16阳性患者3年生存率显著低于p16阴性患者。李庆[12]报道皮肤鳞状细胞癌的发生和进展与p16、cyclinD1等蛋白异常表达相关,且cyclinD1高表达与p53低表达具有相关性,两者对骨肉瘤细胞的增殖与侵袭具有促进作用,联合检测可提高骨肉瘤的诊断效能[13], 与本研究结果相符。本研究尚存在不足之处,例如未深入分析p53、E-cad蛋白低表达是否与基因突变相关,且临床对于p53基因表达与脂肪肉瘤患者病理参数及预后的关系仍争议较大,未来需增加样本量进一步深入探讨。
综上所述, p53、p16、cyclinD1、E-cad蛋白在脂肪肉瘤组织中均呈异常表达,且p53、E-cad、p16、cyclinD1蛋白表达情况与肉瘤部位、TNM分期、病理类型、局部复发和远处转移情况相关, p53、E-cad表达阴性患者和p16、cyclinD1表达阳性患者的预后不佳。
