血清低氧诱导因子-1α、甲胎蛋白表达对肝癌患者肝动脉化疗栓塞术预后的影响
2022-11-12殷梦杰王晓维沈建东付守忠
殷梦杰, 戴 锋, 王 斌, 王晓维, 沈建东, 丁 苇, 付守忠
(江苏省南通市第三人民医院 介入血管科, 江苏 南通, 226000)
肝动脉化疗栓塞术(TACE)是中晚期肝癌患者的首选治疗方式,可有效提高患者的生存率。但部分肝癌患者经TACE治疗后仍难以获得完全缓解或部分缓解,预后不良风险较高[1]。因此,寻找影响肝癌患者TACE治疗预后不良的相关指标,对治疗方案的制订与调整尤为必要。作为氧平衡调节的重要因子,低氧诱导因子-1α(HIF-1α)影响肿瘤基因及细胞的合成、表达,对肿瘤的复发、转移起重要作用[2]。HIF-1α可通过诱导血管内皮生长因子(VEGF)基因转录,增加VEGFmRNA稳定性,上调VEGF及其受体表达,影响癌细胞及内皮细胞,促进血管生成,导致肿瘤细胞的增殖[3]。甲胎蛋白(AFP)是一种糖蛋白,且是临床应用较为广泛的标志物,肝癌患者接受合理的治疗后,血清AFP水平降低[4]。有研究[5]将AFP用于肝癌的诊断且获益。由此猜测,血清HIF-1α、AFP的异常表达可能对肝癌患者TACE治疗预后造成一定影响。本研究重点观察血清HIF-1α、AFP水平对肝癌患者TACE治疗预后的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年12月南通市第三人民医院行TACE术治疗的80例肝癌患者作为研究对象。纳入标准: 符合《原发性肝癌诊疗规范(2017年版)》[6]关于肝癌的诊断标准者; 肝功能Child分级[7]为A~B级者; 首次接受TACE治疗者; 卡氏(KPS)评分[8]≥60分者。排除标准:合并其他部位恶性肿瘤者; 接受其他抗肿瘤治疗者; 严重肝硬化者; 凝血功能异常者; 严重肾功能不全者; 大量腹水者。80例肝癌患者中男60例,女20例; 年龄45~72岁,平均(56.06±5.25)岁; Child分级为A级49例, B级31例; 单发45例,多发35例。患者及家属均知晓本研究方案,并签署知情同意书。医院医学伦理委员会已审核本研究方案,并批准实施。
1.2 方法
预后评估方法: 全部患者均治疗2个周期,并于治疗结束后接受至少1个月随访,参照实体瘤疗效评价标准[9]评估所有患者的预后情况。完全缓解:可测病灶完全消失,全部病理淋巴结短直径必须减少至<10 mm, 且维持4周以上;部分缓解:可测病灶的直径之和比基线水平减少≥30%, 且维持4周以上;进展:以所有可测病灶直径之和的最小值作为参照,直径之和相对增加≥20%, 且满足直径之和的绝对值增加≥5 mm, 或出现新病灶;稳定:可测病灶减小的程度未达到部分缓解,增加的程度也未达到进展。将部分缓解、完全缓解患者作为预后良好患者,纳入良好组(n=46), 其他则纳入不良组(n=34)。
基线资料统计方法: 设计基线资料调查表,详细统计2组基线资料。① 一般资料: 性别、年龄、Child分级(A级、B级,将患者的一般状况、血清白蛋白、腹水、胆红素、凝血酶原时间分为3个层次,分别计1、2、3分,其中A级为5~6分,B级为7~9分)、肿瘤数目(单发、多发)、最大肿瘤直径、肿瘤部位(左半肝、右半肝及左、右半肝)、肝硬化病史(有、无,通过查阅患者病历资料判断); ② 实验室指标检查: 治疗前,取患者的空腹肘静脉血3 mL, 以3 000转/min离心10 min, 分离上层血清,采用日立全自动生化分析仪测定谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆红素水平,采用酶联免疫吸附法测定血清AFP、HIF-1α水平。
1.3 统计学分析
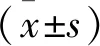
2 结 果
2.1 预后情况
80例肝癌患者经TACE治疗2个周期且随访1个月时,完全缓解10例,部分缓解36例,稳定27例,进展7例。预后良好46例,占比57.50%, 预后不良34例,占比42.50%。
2.2 不良组与良好组基线资料比较
不良组血清AFP、HIF-1α水平高于良好组,差异有统计学意义(P<0.05); 2组间性别、年龄、Child分级、肿瘤数目、最大肿瘤直径、肝硬化病史、肿瘤部位、AST、ALT、总胆红素比较,差异均无统计学意义(P>0.05)。见表1。
2.3 肝癌患者TACE治疗预后影响因素Logistic回归分析
将肝癌患者TACE治疗预后情况作为因变量(1=不良, 0=良好),将2.2基线资料中差异有统计学意义的变量作为自变量,逐个纳入进行单项Logistics回归分析,后将P条件放宽至<0.2, 纳入符合条件的变量(AFP、HIF-1α)作为自变量(均为连续变量),建立多元回归模型,结果显示,治疗前血清AFP、HIF-1α高表达可能是肝癌患者TACE治疗预后不良的风险因子(OR>1,P<0.05)。见表2。

表1 不良组与良好组基线资料比较

表2 肝癌患者TACE治疗预后影响因素Logistic回归分析
2.4 血清AFP、HIF-1α水平评估肝癌患者TACE治疗预后不良风险
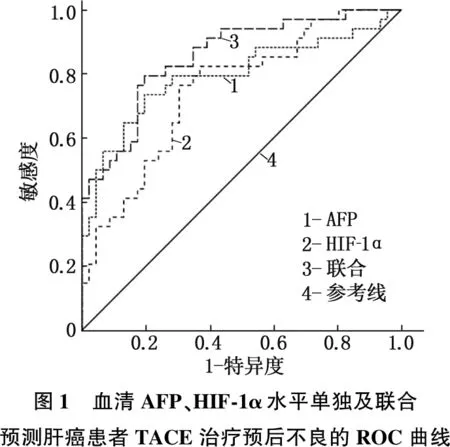
将肝癌患者TACE治疗预后情况作为状态变量(1=不良, 0=良好),将治疗前血清AFP、HIF-1α水平作为检验变量,绘制ROC曲线,结果显示,治疗前血清AFP、HIF-1α水平预测肝癌患者TACE治疗预后不良风险的AUC均>0.70, 预测价值较为理想,且以联合预测价值最高。见图1、表3。
3 讨 论
TACE可通过减少、阻断肿瘤血供,导致肿瘤缺血、缺氧坏死达到治疗目的,可有效延长肝癌患者生存时间。但有研究[10]指出,肝癌患者在接受TACE治疗后的1、2、3年生存率分别为61.3%、44.2%、40.5%。本研究结果显示, 80例肝癌患者经TACE治疗2个周期且随访1个月时预后不良34例,占比42.50%, 说明肝癌患者接受TACE治疗后仍有较高的预后不良风险。因此,寻找影响肝癌患者TACE治疗预后不良的相关指标十分必要。
AFP属于糖蛋白,由肝脏实质细胞合成,在健康人体内含量极低,但当肝细胞发生癌变时, AFP蛋白功能会恢复,且随着病情的加重AFP表达增加[11]。研究[12]指出, AFP可反映肿瘤内在的负荷及活性大小,可用于评估治疗效果,当肝癌患者得到有效的治疗后, AFP水平迅速降低。同时,有研究[13]指出, AFP可用于原发性肝癌的诊断,且诊断效能较好。HIF-1α作为调节细胞内氧代谢的关键因子之一,可通过诱导VEGF, 对新生血管进行刺激,促进肿瘤的生长[14]。研究[15]发现,恶性肿瘤患者因组织氧浓度降低,可引起HIF-1α的表达增高。同时,有研究[16]指出, HIF-1α的释放,可诱导VEGF的表达,促进癌组织生长、浸润及转移。由此,猜测血清AFP、HIF-1α的异常表达可能对肝癌患者TACE预后造成一定影响。本研究结果显示,不良组血清AFP、HIF-1α水平均高于良好组。初步说明血清AFP、HIF-1α的异常高表达可能与肝癌患者TACE治疗预后不良有关。简单分析可能的原因: AFP作为诊断肝癌的特异性标志物,其高表达提示临床高分期,肿瘤侵袭性高,可能存在血管侵犯及肿瘤高负荷,直接对TACE治疗效果造成影响,增加患者预后不良风险[17]; 此外, 高表达AFP可作用于免疫系统,协助肿瘤逃逸免疫功能,促进癌细胞增殖,因此AFP高表达可促进肿瘤的侵袭、增殖及转移,增加肝癌患者TACE治疗预后不良风险[18]。研究[19]报道称肿瘤生长依赖于新生血管生成, VEGF有自分泌功能,可刺激癌细胞增殖,加快肿瘤新生血管速度。而HIF-1α可通过诱导VEGF表达,促进癌组织增长,若肝癌患者治疗前HIF-1α高表达,可进一步促进VEGF的表达,加快肿瘤进展,影响TACE治疗效果,增加预后不良风险。
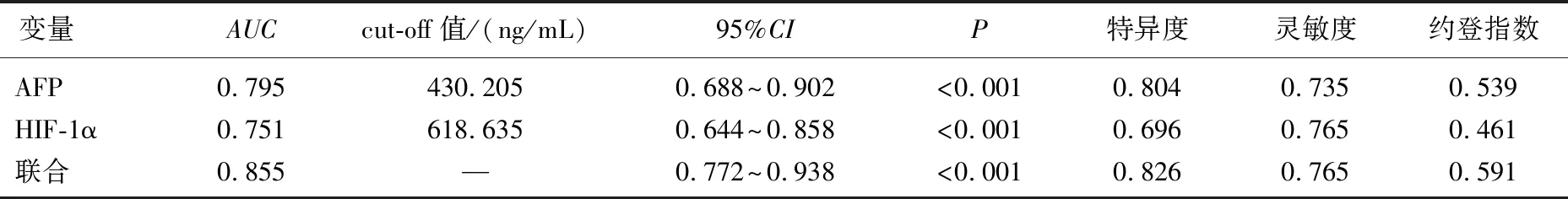
表3 血清AFP、HIF-1α水平预测肝癌患者TACE治疗预后不良风险
为进一步证实血清AFP、HIF-1α表达对肝癌患者TACE治疗预后的影响,本研究行Logistic回归分析,结果显示,治疗前血清AFP、HIF-1α高表达可能是肝癌患者TACE治疗预后不良的风险因子,进一步证实上述结论。本研究中, ROC曲线结果显示,治疗前血清AFP、HIF-1α水平预测肝癌患者TACE治疗预后不良风险的AUC>0.70, 预测价值较为理想,且以联合预测价值最高。上述结果证实,血清AFP、HIF-1α高表达不仅可影响肝癌患者TACE治疗预后,也可能是其TACE治疗预后不良的风险因子。这表明临床应在肝癌患者接受TACE治疗前测定血清AFP、HIF-1α, 针对上述指标高表达患者,采取积极且合理的治疗措施,以改善患者预后。
综上所述,肝癌患者TACE治疗预后不良可能与血清AFP、HIF-1α高表达有关,临床可考虑在治疗前测定其血清AFP、HIF-1α水平,预测TACE预后不良风险,以指导治疗方案的调整,改善疾病治疗现状。
