微小RNA-141靶向表皮生长因子受体调控乳腺癌上皮间质转化的作用机制研究
2022-11-12吴沉昊
王 婧, 周 蓓, 吴 忠, 吴沉昊
(海南省妇女儿童医学中心 乳腺外科, 海南 海口, 570206)
研究[1]显示乳腺癌占全球女性浸润性癌症的22.9%, 每年约有425 000名女性死于乳腺癌。更为严峻的是,每年有35 000名女性死于乳腺癌侵袭和转移,这是因为癌细胞可以通过血液扩散到全身,导致病情进一步恶化[2-3]。根据定义乳腺癌表型和预测治疗反应的分子标志物,可以将乳腺癌分为不同的亚型,包括管腔亚型和基底亚型,其中基底亚型是癌细胞中侵袭性最强的,肿瘤转移率高,患者存活率较低[4-5]。上皮细胞间质转化(EMT)是指通过特定的程序将上皮细胞转化为具有间质表型细胞的生物学过程[6]。研究[7]发现EMT异常激活与加速各种癌症的进展有关。研究[8-9]表明, EMT是恶性肿瘤发生和转移的基础,是源自上皮细胞的恶性细胞迁移和侵袭的重要生物学过程。研究[10]表明,表皮生长因子受体(EGFR)的表达与乳腺癌的发生和预后有关。研究[11-12]报道在三阴性乳腺癌患者中可观察到EGFR的遗传改变,并可被视为乳腺癌脑转移的潜在生物标志物。本研究探讨EGFR在乳腺癌中的作用及其上游调控机制,为乳腺癌早期生物标志物的筛选及靶向治疗提供依据,现报告如下。
1 资料与方法
1.1 一般资料
选取2016年10月—2017年10月本院收集的60份肿瘤组织和癌旁正常组织样本(距离肿瘤组织>5 cm)。纳入标准: ① 经2名以上病理学家确诊者; ② 患者均未进行术前或术后药物治疗; ③ 患者无其他恶性疾病或肿瘤; ④ 患者依从性良好。排除标准: ① 男性乳腺癌患者; ② 合并其他恶性疾病或肿瘤者; ③ 接受过相关干预治疗者; ④ 依从性较差的患者。所有样本取出后迅速转移到液氮中保存并贮存在-80 ℃冰箱中。所有纳入患者均对本研究知情同意。本研究经本院医学伦理委员会审核通过(审批号: 2022伦申第1号)。
1.2 细胞系和细胞培养
人乳腺纤维细胞系(Hs578Bst)和3种人乳腺癌细胞系(MCF-7、MDA-MB-231和 MDA-MB-435)均购自北纳生物。人乳腺细胞系Hs578Bst在90%的DMEM培养基和10%的胎牛血清(FBS)中培养。MCF-7和MDA-MB-231在90%的DMEM和10% FBS组成的CM1-1培养基中培养。人乳腺癌细胞MDA-MB-435在90%的L15和10%的FBS中培养。细胞在37 ℃、5% CO2的潮湿环境中生长。
1.3 微阵列分析
使用癌症基因组图谱计划(TCGA)数据分析癌旁组织和乳腺癌组织之间的前20个差异表达基因。筛选标准为log2(倍数变化)mRNAs>1和P<0.05。
1.4 加权基因共表达网络分析(WGCNA)
WGCNA R软件包用于在共表达网络中收集多组强共表达基因。使用加权基因共表达网络重建算法创建共表达网络。差异表达数据预处理后,去掉所有样本中表达量都很低的基因,去掉所有样本中表达量几乎没有差异的基因,可用sd筛选,但不建议只保留差异基因。构建相关性矩阵,相关系数范围是-1~1, 而后构建拓扑重叠矩阵,对基因进行聚类,每条线代表1个基因,相似的基因被聚到1个分支。
1.5 双荧光素酶报告基因检测
通过Targetscan和Miranda预测微小RNA-141(miR-141)的靶基因,然后使用双荧光素酶报告基因检测证明miR-141与靶基因之间的靶向关系。Dual-Luciferase Reporter System(Progema, 美国)用于测量萤火虫和海肾荧光素酶活性的荧光素酶活性。根据制造商的说明,在Lipofectamie 2000 (Invitrogen, 美国)基础上应用miR-141模拟物或miR-141 NC转染含有EGFR 3′UTR-WT或EGFR 3′UTR-MUT的psi-CHECK2 载体或psi-CHECK2。所有寡核苷酸均购自Sangon Biotech(中国上海)。
1.6 细胞转染
将购自Genepharma(中国上海)的miR-141模拟物、miR-141抑制剂、pcDNA3.1-EGFR 重组质粒和miRNA对照转染到MDA-MB-231和MDA-MB-435细胞中。转染前1 d, 将处于对数期的MDA-MB-231和MDA-MB-435细胞(5×104/mL)接种到12孔板中。第2天,当细胞达到约80%汇合时,采用Lipofectamine 2000 (Invitrogen)转染细胞。转染效率通过实时定量聚合酶链式反应(PCR)测试进行评估。
1.7 实时荧光定量PCR(qRT-PCR)
根据制造商的说明,使用TRIzol试剂(Invitrogen)从组织或细胞系中提取总RNA。根据制造商的说明,使用多合一TM miRNA qRT-PCR检测试剂盒制备提取的RNA。HiScipt Ⅱ (Vazyme,China)用于合成cDNA。使用AB7300 thrmo-recycler (Applied Biosystems, USA)进行qRT-PCR, 相关的EGFR、GAPDH、miR-141和U6的引物序列见表1。GAPDH和U6分别作为EGFR和miR-141检测的内参基因。通过2-△△ct计算EGFR和miR-141的相对表达水平,每个实验独立进行3次。

表1 qRT-PCR相关的引物序列
1.8 细胞增殖试验
使用Cell Counting Kit-8(CCK-8系统, Dojindo, 日本)评估细胞增殖能力。转染后,将细胞接种于96孔板(每孔密度为2×103个细胞),并通过CCK-8系统记录细胞增殖情况,每24 h记录1次,持续3 d。使用酶标仪在450 nm处检测光密度值。
1.9 Transwell实验
使用24孔Transwell小室(Corning, NY, USA)评价乳腺癌细胞迁移能力。在Transwell上室加入200 μL乳腺癌细胞悬液(1×105个细胞); 在下室添加600 μL含有1% FBS的RPMI-1640培养基; 24 h后,将迁移到下表面的乳腺癌细胞用无水乙醇固定10 min, 然后用0.5%结晶紫染色10 min。在显微镜(Olympus,日本)下放大200倍观察染色的细胞。
1.10 BrdU增殖情况检测
BrdU标记细胞完成后,去除培养液,并加入1 mL 4%的多聚甲醛,室温固定15 min后,每孔加入1 mL含0.3% TritonX-100的PBS,室温孵育15 min。每孔加入0.5 mL Click反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品。室温避光孵育30 min, 吸除Click反应液,用洗涤液洗涤3次。1×Hoechst 33342溶液的配制: 按1∶1 000比例用PBS稀释Hoechst 33342。吸除洗涤液后,每孔加1×Hoechst 33342溶液1 mL, 室温避光孵育10 min。用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
1.11 蛋白质印迹分析
使用RIPA裂解缓冲液裂解转染后的乳腺癌细胞。使用BCA蛋白质检测试剂盒(Thermo Fisher Scientific,美国)测量细胞裂解物的蛋白质浓度。等量蛋白样品经SDS-PAGE分离后电转至PVDF膜(Millipore, 德国), 5%脱脂奶粉室温密封2 h, 然后用原代培养抗体4 ℃过夜。一抗包括抗波形蛋白(Santa Cruz, CA,USA; 1∶5 000)、抗E-cadherin(Santa Cruz; 1∶5 000)、抗EGFR(Santa Cruz; 1∶5 000)和抗GAPDH(Santa Cruz; 1∶5 000)。使用辣根过氧化物酶(HRP)滞后的二抗在室温下孵育膜1 h。扫描印迹并使用Quantity One成像软件(Bio-Rad, 美国)测量条带密度。
1.12 裸鼠皮下移植实验
取对数生长期的MDA-MB-231细胞,制备单细胞悬液计数,按2×105个/只分别接种于BALB/c裸鼠背部左侧或右侧皮下,每组6只裸鼠, 4周后处死裸鼠,观察成瘤情况。
1.13 统计学分析
采用GraphPad 7.0(GraphPad Software, 美国)进行统计分析。经正态检验后,满足正态分布的数据以平均值±标准偏差的形式表示, 2组间比较分析采用t检验,多组比较分析采用单因素方差分析(ANOVA)检验。P<0.05为差异有统计学意义。
2 结 果
2.1 EGFR在乳腺癌组织和细胞中的表达情况
应用TCGA数据库分析乳腺癌基因表达情况。在乳腺癌细胞中,差异表达前20个基因组的热图显示,含有EGFR的基因组在乳腺癌细胞中的表达上调(图1A)。根据其在乳腺癌中的表达,基因组被分为不同的模块,每个模块用不同的颜色表示(图1B)。不同模块中基因组的统计分析通过Z-summary进行评估,其中模块的Z-summary>0表示该模块在乳腺癌细胞中高表达(图1C)。每个基因块都由PLotMA映射,并分别在12个模块中选择特定的中心基因(图1D)。结合其他文献,初步筛选出棕色模块中的EGFR基因。此外,使用基于STRING数据库的Cytoscape有助于建立棕色模块中所有基因的蛋白质-蛋白质相互作用(PPI)网络,最终确定EGFR的核心位置(图1E)。
应用qRT-PCR检测miR-141和EGFR在乳腺癌组织或细胞中的表达,结果表明, miR-141在癌组织中表达降低,而EGFR在癌组织中的表达水平高于癌旁组织,差异有统计学意义(P<0.05); miR-141在3种乳腺癌细胞系(MCF-7、MDA-MB-231、MDA-MB-435 )中的表达低于正常乳腺细胞系(Hs 578Bst), 而EGFR在3种乳腺癌细胞系(MCF-7、MDA-MB-231、MDA-MB-435)中表达均升高,差异有统计学意义(P<0.05)。见图2。

A: 倍数变化>2的前20个基因组差异表达的热图,红色代表上调,绿色代表下调; B: 基于相异性测量聚类的所有差异表达基因的树状图; C: 基于相异性度量聚类的所有差异表达基因的气泡图; D: 12个模块中模块特征基因的散点图; E: 棕色模块中基因的PPI网络,每个节点的颜色强度与加权基因共表达网络中的连接程度呈正比,红色为正相关,绿色为负相关。图1 乳腺癌中EGFR的表达情况
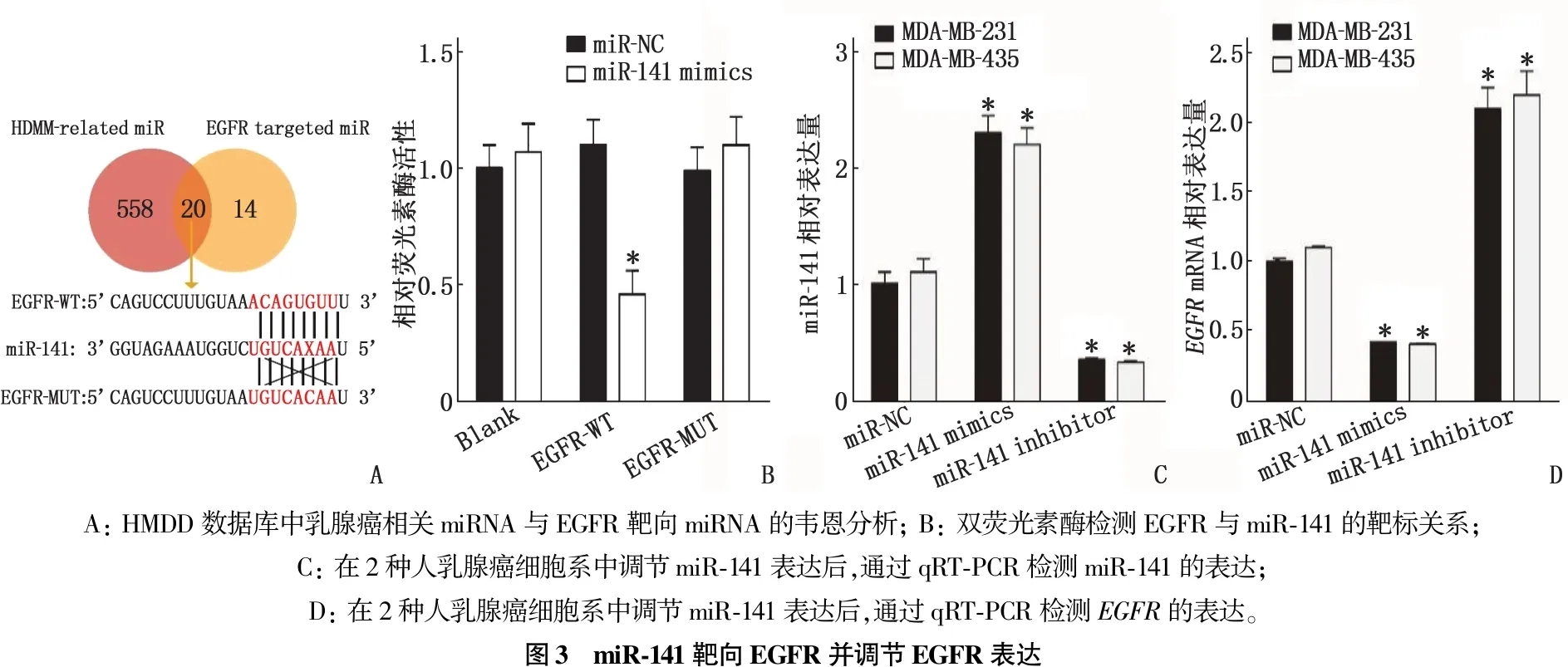
2.2 miR-141与EGFR的靶向关系验证
本研究通过HMDD数据库找出了578个与乳腺癌相关的miRNA, 共筛选出34个靶向EGFR的上游miRNA。韦恩图显示有20个重叠的miRNA, 最终选择了miR-141作为上游miRNA进行研究(图3A)。双荧光素酶报告基因检测表明,转染miR-141模拟物后, EGFR-WT 组的荧光素酶活性显著降低(P<0.05), 含有相同片段突变序列的EGFR-MUT组的荧光素酶活性在转染后几乎保持不变(图3B)。结果表明,EGFR是miR-141的靶基因。本研究进一步验证了miR-141过表达及抑制模型的构建情况,结果提示miR-141模拟物显著增高了miR-141的表达(P<0.05), 而miR-141抑制剂则显著抑制了miR-141的表达(图3C)。进一步检测发现, miR-141过表达能够显著抑制EGFR的表达(P<0.05), 而miR-141受抑制则能够显著增高EGFR的表达(图3D)。
2.3 miR-141和EGFR在调控细胞迁移、增殖及EMT进程中的作用
本研究同时构建了miR-141和EGFR的干预模型,EGFRmRNA检测结果显示, miR-141模拟物组EGFR表达水平降低, miR-141抑制剂组EGFR升高,但miR-141模拟物+EGFR组的EGFR表达上调被逆转,差异有统计学意义(P<0.05); 蛋白质表达检测中也发现了相似的结果。上述结果表明miR-141靶向EGFR, 并且EGFR在乳腺癌中的表达受到miR-141的调节。见图4。

Transwell实验结果显示, miR-141过表达能够显著降低细胞迁移能力,但miR-141抑制剂和EGFR过表达则能显著增强细胞迁移能力(P<0.05); 此外, miR-141模拟物+EGFR组细胞迁移数与空白组无显著差异(P>0.05)。细胞增殖能力检测显示,与空白组相比, EGFR组和miR-141抑制剂组的增殖能力增强,而miR-141过表达组的增殖能力下降。此外,模拟物+EGFR组中miR-141和EGFR的共同过表达显著减轻了EGFR诱导的增殖能力增强的现象(P<0.05), 这一结果在BrdU免疫荧光检测中同样得到了证实。见图5。此外,蛋白质印迹分析显示,在miR-141过表达细胞中, E-cadherin表达显著增加而Vimentin表达减少。相反,在EGFR 过表达细胞和miR-141抑制细胞中则观察到E-cadherin表达显著降低和Vimentin表达显著增加。EGFR过表达能够显著逆转miR-141抑制的EMT进程(P<0.05), 见图6。
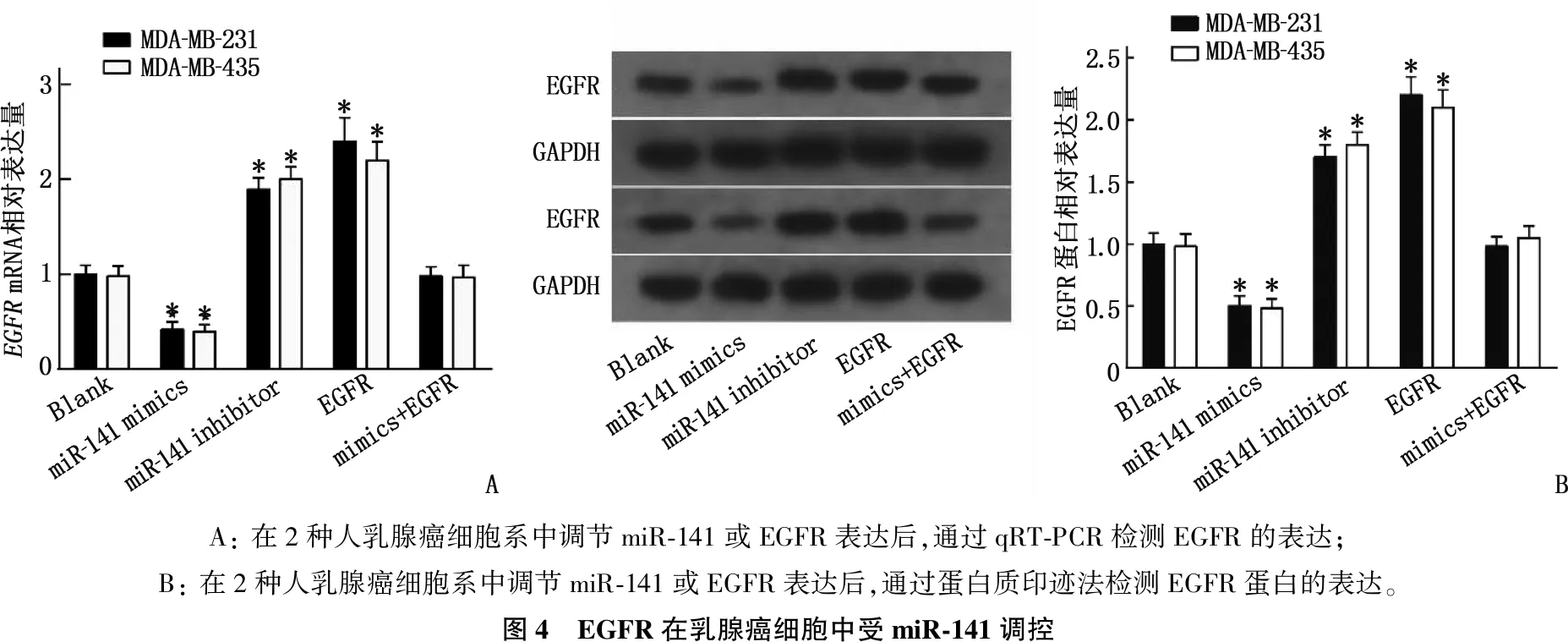
A: 在2种人乳腺癌细胞系中调节miR-141或EGFR表达后,通过qRT-PCR检测EGFR的表达; B: 在2种人乳腺癌细胞系中调节miR-141或EGFR表达后,通过蛋白质印迹法检测EGFR蛋白的表达。图4 EGFR在乳腺癌细胞中受miR-141调控

A、B: 通过Transwell实验检测miR-141或EGFR表达调控的细胞的迁移能力; C、D: 通过CCK-8法检测在0、24、48、72 h调节miR-141或EGFR表达后MDA-MB-231和MDA-MB-435细胞的增殖情况; E、F: 通过BrdU法检测在72 h时miR-141或EGFR表达后MDA-MB-231和MDA-MB-435细胞的增殖情况。图5 miR-141的下调或EGFR的上调可促进细胞迁移和细胞增殖

2.4 miR-141对裸鼠体内成瘤的调控作用
生长曲线显示, miR-141模拟物组肿瘤的体积显著小于空白组(P<0.001); miR-141模拟物组肿瘤质量显著小于空白组(P<0.05); qRT-PCR结果显示, miR-141过表达后, EGFR表达显著下降(P<0.05), 而抑制miR-144的表达后EGFR显著上升(P<0.05); 免疫组化检测发现, miR-141模拟物组的阳性细胞率显著低于空白组(P<0.05), 说明miR-141对肿瘤有抑制作用。见图7。

3 讨 论
EGFR表达的改变与许多恶性肿瘤的发病机制和预后密切相关[13]。在乳腺癌患者中,经常观察到EGFR基因表达升高。有研究[14]鉴定并验证了3种miRNA(miR-124、miR-147和miR-193a-3p)作为肿瘤抑制因子通过靶向EGFR调控细胞周期并抑制乳腺癌的进程。高EGFR表达是三阴性乳腺癌的独立预后因素,而本研究发现EGFR表达在乳腺癌组织和细胞中上调并促进乳腺癌增殖和EMT进程。
近年来,已在多种人类癌症中观察到miRNA的异常表达。研究[15-16]表明, miR-141通过直接靶向乳腺癌基因来影响EMT、癌细胞迁移、肿瘤生长和转移。研究[17]报道, SerpinB2促进了miR-200c/141簇的过表达并诱导了乳腺癌细胞的转移。研究[18]显示miR-141在乳腺癌中受FOXP3-KAT2B轴调控,并与肿瘤转移有关。其中转移性乳腺癌患者血浆中miR-141和miR-200c的表达水平高于非转移性乳腺癌患者。本研究提出miR-141作为一种抗癌基因,靶向EGFR并且miR-141的过表达可以抑制乳腺癌中的细胞迁移和增殖。本研究通过生物信息学分析筛选并验证在乳腺癌细胞和组织中EGFR表达上调,并结合HDMM数据库、Targetscan和miranda网站联合分析并选择miR-141作为EFGR的上游调控分子进行验证。本研究进一步通过qRT-PCR证实了miR-141在乳腺癌组织和细胞中低表达。双荧光素酶报告基因检测进一步验证了miR-141和EGFR之间的靶向关系。Transwell检测和CCK-8检测表明miR-141的下调或EGFR的上调可促进细胞迁移和细胞增殖,而miR-141过表达抑制细胞迁移和细胞增殖。此外,蛋白质印迹分析表明EGFR过表达或miR-141抑制可以促进EMT的进程。
综上所述,本研究有助于理解miR-141通过靶向EGFR介导乳腺癌的进展。EGFR和miR-141表达都可能作为未来预后的预测因素,而miR-141/EGFR轴可能是乳腺癌靶向治疗的潜在靶点。
