血栓通注射液和胞磷胆碱钠注射液配伍稳定性研究
2022-11-11王海燕韦思遥
王海燕 韦思遥 韦 杰
血栓通注射液和胞磷胆碱钠注射液配伍稳定性研究
王海燕 韦思遥 韦 杰
(广西梧州制药(集团)股份有限公司,广西 梧州 543000)
血栓通注射液为临床常用制剂,可与胞磷胆碱钠注射液合用药。为提高用药安全性,降低不良反应发生率,笔者对血栓通注射液和胞磷胆碱钠注射液进行配伍稳定性实验,考察配伍前后注射液主成分含量、pH值、外观、可见异物、渗透压、不溶性微粒等6项指标的变化情况。实验结果表明,以5%葡萄糖为稀释液时,血栓通注射液与胞磷胆碱钠注射液配伍8小时内各检查指标均无明显变化,表明血栓通注射液与胞磷胆碱钠注射液配伍8小时内配伍稳定性良好。
血栓通注射液;胞磷胆碱钠注射液;配伍稳定性
引言
血栓通注射液主要是由从三七中提取得到的三七总皂苷制成,其主要成分为人参皂苷Rg1和Rb1,是注射型中成药制剂,具有改善脑供血、加强脑灌注、减轻缺血所致病理损害,降低胆固醇,抑制血小板聚集,降低血黏度等多种作用,因此在临床中应用相当广泛[1]。但随着其临床应用的增加,出现的不良反应相关报道也逐渐增加,且多见于联合用药后[2]。胞磷胆碱钠可与血栓通联合用药治疗瘀血阻窍型椎-基底动脉供血不足性眩晕、缺血性脑卒中等疾病[3,4],为提高用药安全性,降低不良反应发生率,笔者对血栓通注射液和胞磷胆碱钠注射液配伍稳定性进行如下研究。
1 实验目的
以5%葡萄糖为稀释剂,考察血栓通注射液与胞磷胆碱钠注射液配伍后0 h、2 h、4 h、6 h、8 h内,主成分含量、pH值、外观、可见异物、渗透压、不溶性微粒等6项指标的变化情况,为提高血栓通注射液临床用药安全,修订药品说明书提供依据,期望降低药品临床不良反应发生率。
2 实验仪器与材料
2.1 仪器与设备
梅特勒FE20型pH计;天大天发BY-2型澄明度检测仪;天大天发CJ-840净化工作台;天大天发GWJ-16智能微粒检测仪;梅特勒XPE-205型电子分析天平(十万分之一);雅森OM819.C型渗透压仪;赛默飞U3000高效液相色谱仪;色谱柱为岛津Intersil ODS-3(4.6*250 mm,5 μm)。
2.2 材料与试剂
胞磷胆碱钠注射液由辰欣药业股份有限公司提供,规格为2 mL/支,批号为2001212261;血栓通注射液由广西梧州制药(集团)股份有限公司提供,规格为2 mL/支,批号为180602;胞磷胆碱钠、三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd对照品均由中国食品药品检定研究院提供;磷酸、甲醇为色谱纯;磷酸二氢钾、四丁基氢氧化铵为分析纯;实验用水均为去离子水。
3 实验过程
3.1 对照品与供试品制备
胞磷胆碱钠对照品溶液:精密称取胞磷胆碱钠约12.0 mg置于25 mL量瓶中,加去离子水稀释至刻度,摇匀。即得胞磷胆碱钠对照品溶液。
血栓通注射液混合对照品溶液:取三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd对照品适量,精密称定,加甲醇制成每1 mL含(三七皂苷R1对照品0.5 mg,人参皂苷Rg1对照品1.5 mg,人参皂苷Re 0.3 mg,人参皂苷Rb1对照品1.0 mg,人参皂苷Rd 0.1 mg)的混合溶液。
胞磷胆碱钠注射液空白液的制备:精密量取胞磷胆碱钠注射液4 mL置250 mL量瓶,分别加5%葡萄糖溶液稀释至刻度,摇匀,即可。
血栓通注射液空白液的制备:精密量取血栓通注射液5 mL置250 mL量瓶混合,加5%葡萄糖溶液稀释至刻度,摇匀,即可。
胞磷胆碱钠注射液与血栓通注射液配伍溶液(以下简称“配伍溶液”)的制备:精密量取胞磷胆碱钠注射液4 mL、血栓通注射液5 mL置250 mL量瓶混合,加5%葡萄糖溶液稀释至刻度,摇匀,即可。
3.2 pH值测定
在溶液制备完成后的第0 h、2 h、4 h、6 h、8 h,分别对配伍溶液、胞磷胆碱钠注射液空白液、血栓通注射液空白液进行取样,测定溶液pH值,平行测定3次,计算平均值。
3.3 可见异物检查
在溶液制备完成后的第0 h、2 h、4 h、6 h、8 h,分别对配伍溶液、胞磷胆碱钠注射液空白液、血栓通注射液空白液进行取样测定,具体操作步骤如下:取待测溶液,置洁净透明的西林瓶内,擦净容器外壁,将澄明度检测仪光照度调为2000 Lx~3000 Lx,将待测溶液置遮光板边缘处,在明视距离(25 cm),手持西林瓶颈部,轻轻旋转和翻转,避免产生气泡,使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视检查,重复观察有无可见异物,观察20秒。
3.4 外观性状检查
在溶液制备完成后的第0 h、2 h、4 h、6 h、8 h,取适量配伍溶液、胞磷胆碱钠注射液空白液、血栓通注射液空白液,目视,观察溶液的颜色,是否有气体产生,有无浑浊或沉淀。
3.5 渗透压测定
在溶液制备完成后的第0 h、2 h、4 h、6 h、8 h,分别取配伍溶液、胞磷胆碱钠注射液空白液、血栓通注射液空白液100 μL至离心管,测定渗透压。
3.6 不溶性微粒测定
分别于0 h、2 h、4 h、6 h、8 h取配伍溶液、胞磷胆碱钠注射液空白液、血栓通注射液空白液,分别倒入取样杯中,静置至脱气泡,测定不溶性微粒并记录数据,弃第一次测定数据,平行三份,取后续测定数据的平均值作为测定结果。
3.7 含量测定
3.7.1 胞磷胆碱钠注射液含量测定方法
参照《中国药典》中胞磷胆碱钠注射液的含量检测方法进行检测[5],考察胞磷胆碱钠注射液2 h、8 h以及胞磷胆碱钠注射液和血栓通注射液配伍后在0 h、2 h、4 h、6 h、8 h中胞磷胆碱钠含量的变化情况。检测方法如下。
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液[0.1 mol/L的磷酸二氢钾溶液和四丁基氢氧化铵溶液(取0.01 mol/L四丁基氢氧化铵溶液用磷酸调节pH值至4.5)等量混合]-甲醇(95∶5)为流动相;检测波长为276 nm;进样体积为10 μL。
测定法:精密量取胞磷胆碱钠对照品溶液、胞磷胆碱钠注射液空白液、配伍溶液分别注入液相色谱仪,记录色谱图。
3.7.2 血栓通注射液的含量测定方法
参照国家标准《血栓通注射液质量标准》(WS3-B-3829-98-2010)进行检测[6],考察血栓通注射液0 h、8 h以及血栓通注射液和胞磷胆碱钠注射液配伍0 h、2 h、4 h、6 h、8 h后血栓通注射液有效成分的含量变化情况。
检测方法如下:
色谱条件:以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动性A,水为流动相B,流速为1.0 mL/min,柱温为25 ℃,检测波长220 nm,按表1进行梯度洗脱。

表1 血栓通注射液含量测定方法梯度洗脱表
测定法:精密量取血栓通注射液混合对照品溶液、血栓通注射液空白液、配伍溶液分别注入液相色谱仪,记录色谱图。
4 实验结果
4.1 血栓通注射液与胞磷胆碱钠注射液配伍稳定性pH值测定结果
通过8小时持续监测配伍溶液的pH值变化,并绘制pH变化曲线,得到的结果表明,血栓通注射液与胞磷胆碱钠注射液配伍后,pH值在8小时内无明显变化,说明血栓通注射液与胞磷胆碱钠注射液配伍后pH值稳定性良好(如表2、图1所示)。
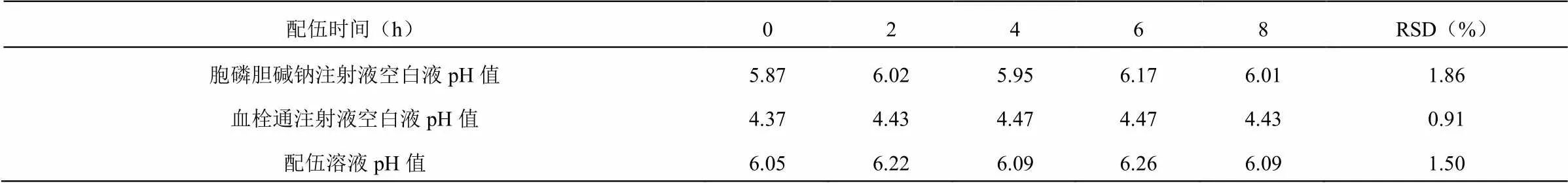
表2 血栓通注射液与胞磷胆碱钠注射液配伍稳定性
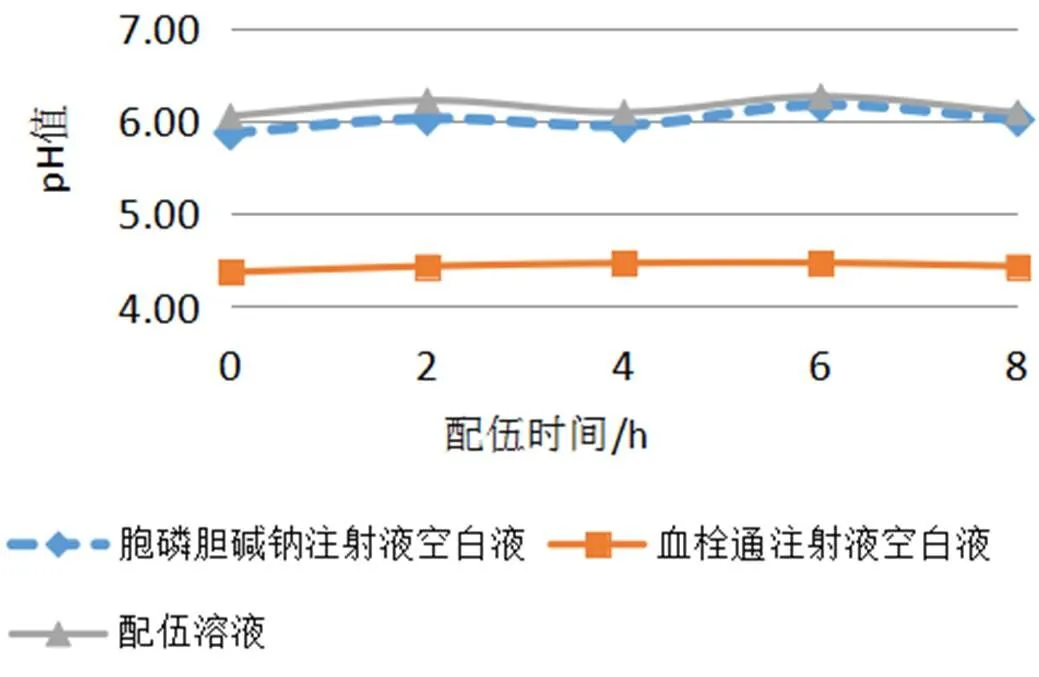
图1 血栓通注射液与胞磷胆碱钠注射液配伍稳定性pH值变化曲线图
4.2 血栓通注射液与胞磷胆碱钠注射液配伍稳定性可见异物检查结果
在8 h内持续监测配伍溶液、胞磷胆碱钠注射液空白液、血栓通注射液空白液的可见异物变化,均未检出可见异物,说明血栓通注射液与胞磷胆碱钠注射液配伍后在该项考察指标中稳定性良好。
4.3 血栓通注射液与胞磷胆碱钠注射液配伍稳定性外观性状检查结果
胞磷胆碱钠注射液空白液、血栓通注射液空白液、配伍溶液在8 h内呈无色液体,未检出气体、沉淀、浑浊。说明血栓通注射液与胞磷胆碱钠注射液配伍后在性状稳定性良好。
4.4 血栓通注射液与胞磷胆碱钠注射液配伍稳定性渗透压测定结果
通过8 h持续监测配伍溶液的渗透压变化,并绘制渗透压变化曲线,得到的结果表明,血栓通注射液与胞磷胆碱钠注射液配伍后,渗透压值在8小时内无明显变化,说明血栓通注射液与胞磷胆碱钠注射液配伍后渗透压稳定性良好(如表3、图2所示)。
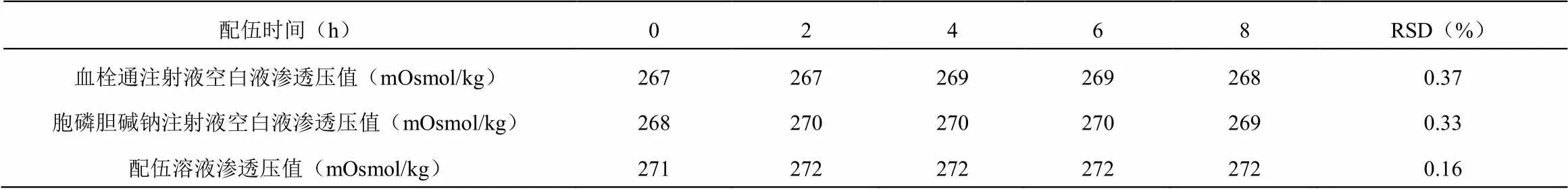
表3 血栓通注射液与胞磷胆碱钠注射液配伍稳定性渗透压值测定结果
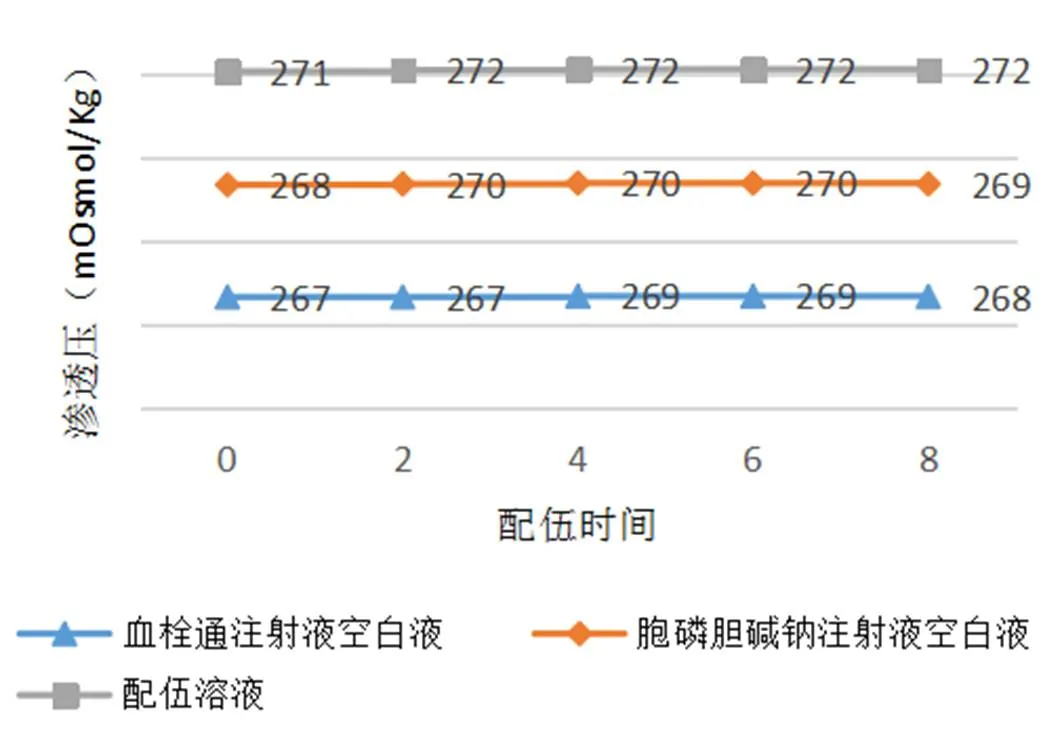
图2 血栓通注射液与胞磷胆碱钠注射液配伍稳定性渗透压值变化曲线图
4.5 血栓通注射液与胞磷胆碱钠注射液配伍稳定性不溶性微粒测定
通过8 h持续监测配伍溶液的不溶性微粒变化,得到的结果(表4)表明,血栓通注射液与胞磷胆碱钠注射液配伍后,不溶性微粒数在8 h内符合2020年版《中国药典》中对注射剂不溶性微粒数的要求[7],即每个供试品容器(份)中含10 μm及10 μm以上的微粒数不得超过6000粒,含25 μm及25 μm以上的微粒数不得超过600粒。

表4 血栓通注射液与胞磷胆碱钠注射液配伍稳定性不溶性微粒测定结果
4.6 血栓通注射液与胞磷胆碱钠注射液配伍8 h内主成分含量变化情况
通过8小时持续监测配伍溶液中主成分含量的变化,并绘制各个主成分含量变化曲线,得到的结果(表5、表6,图3、图4)表明,以5%葡萄糖为稀释液,血栓通注射液与胞磷胆碱钠注射液配伍8小时内各个主成分含量均无明显变化。
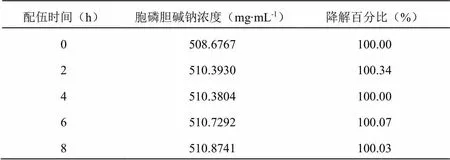
表5 配伍溶液8 h内胞磷胆碱钠注射液主成分含量测定结果
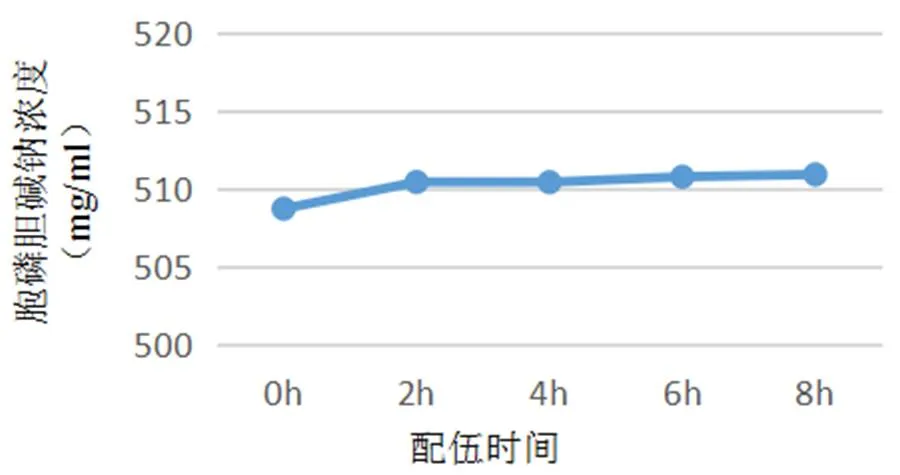
图3 配伍溶液8 h内胞磷胆碱钠注射液主成分含量变化曲线图

表5 配伍溶液8 h内血栓通注射液主成分含量测定结果
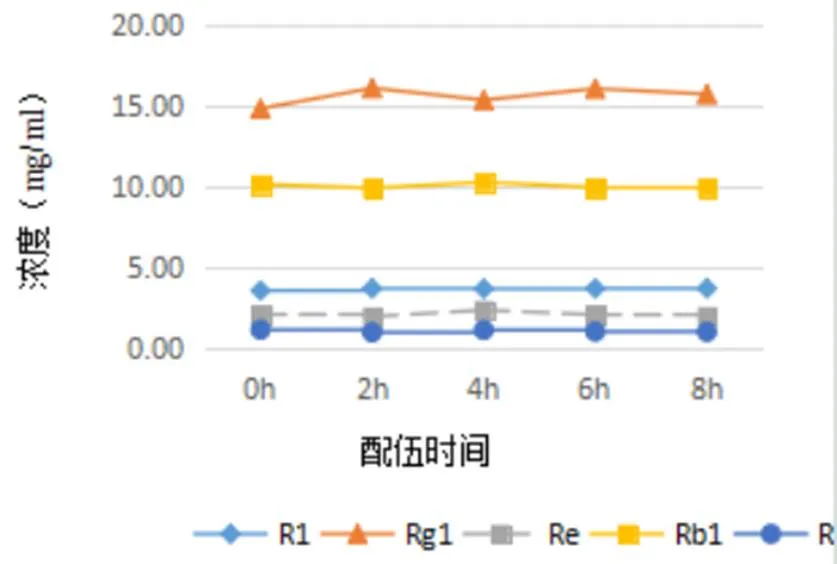
图4 配伍溶液8 h内血栓通注射液主成分含量变化曲线图
5 结束语
本文通过对血栓通注射液和胞磷胆碱钠注射液进行配伍稳定性实验,持续监测血栓通注射液和胞磷胆碱钠注射液配伍前后注射液主成分含量、pH值、外观、可见异物、渗透压、不溶性微粒等6项指标的变化情况,以考察该两种注射液配伍后的用药安全性。从实验结果可以得出,以5%葡萄糖为稀释液时,血栓通注射液与胞磷胆碱钠注射液配伍8 h内渗透压、pH值无明显变化,不溶性微粒及可见异物、性状均符合2020年版《中国药典》对注射剂各检查项目的要求,血栓通注射液与胞磷胆碱钠注射液配伍8 h内主成分含量无明显变化,表明以5%葡萄糖为稀释液时血栓通注射液与胞磷胆碱钠注射液配伍8 h内配伍稳定性良好,建议在临床使用过程中配伍溶液在8 h内用完,以确保配伍用药的安全性及有效性。
[1] 王忠全,丁卓玲. 血栓通的临床应用研究进展[J]. 中国药业,2007,16(12): 62-64.
[2] 阎琰. 注射用血栓通所致不良反应统计与分析[J]. 中国处方药,2017,15(11): 47-48.
[3] 谭文澜,张永全,陆晖. 血栓通联合胞磷胆碱钠片治疗瘀血阻窍型椎—基底动脉供血不足性眩晕46例临床研究[J]. 西部中医药,2012,25(12): 4-6.
[4] 林丽红,苏洽玉,陈文亮,等. 血栓通联合胞磷胆碱注射液治疗缺血性脑卒中的成本-效果分析[J]. 中国药物经济学,2015(12): 8-9.
[5] 国家药典委员会. 中国药典: 二部[M]. 北京: 中国医药科技出版社,2020.
[6] WS3-B-3829-98-2010. 血栓通注射液质量标准[S]. 北京: 中国标准出版社,2010.
[7] 国家药典委员会. 中国药典: 四部[M]. 北京: 中国医药科技出版社,2020.
Study on Compatible Stability of Xueshuantong Injection and Citicoline Sodium Injection
Xueshuantong injection is a commonly used clinical preparation and can be used in combination with citicoline sodium injection. In order to improve the safety of drug use and reduce the incidence of adverse reactions, the author carried out the compatible stability experiment on Xueshuantong injection and citicoline sodium injection, and investigated the changes of 6 indexes such as the content of main components, pH value, appearance, visible foreign matters, osmotic pressure and insoluble particles of the injection before and after the compatibility. The experimental results showed that when 5% glucose was used as the diluent, there was no significant change in the examination indexes within 8 hours after the compatibility of Xueshuantong injection and citicoline sodium injection, indicating that the compatible stability of Xueshuantong injection and citicoline sodium injection was good within 8 hours.
Xueshuantong injection; citicoline sodium injection; compatible stability
R927
A
1008-1151(2022)10-0117-04
2022-07-28
王海燕(1991-),女,广西梧州制药(集团)股份有限公司助理级工程师(药物研究专员),研究方向为药物分析。
韦思遥(1994-),女(壮族),广西梧州制药(集团)股份有限公司助理级工程师(分析研究专员),研究方向为药物分析。
