LncRNA NEF对成骨细胞和破骨细胞分化及相关蛋白表达的影响
2022-11-11陈路沅
沈 琴, 朱 宏, 陈路沅
(南方医科大学深圳医院 口腔科, 广东 深圳, 518100)
骨质疏松症是一种以骨密度减少为基本特征的骨骼系统疾病,易发于老年人群,主要表现为骨脆性增加、骨强度下降、易发生骨折[1-2]。骨质疏松症骨丢失主要由机体内成骨细胞形成和破骨细胞分化的失衡引起。长链非编码RNA(lncRNAs)是一种长度超过200 nt的非编码RNA小分子,其异常表达与骨关节炎、骨质疏松症等疾病的发生发展有关[3]。LncRNA AK077216在破骨细胞生成过程中显著上调,通过调节活化T细胞核因子的表达,促进破骨细胞的形成[4]。lncRNA XIST在骨质疏松症患者中高表达,体外过表达lncRNA XIST可降低碱性磷酸酶(ALP)、骨γ-羧基谷氨酸蛋白和runt相关转录因子2的表达,从而抑制骨髓间充质干细胞的成骨分化[5]。LncRNA NEF在绝经后骨质疏松患者血浆中呈下调趋势,且与患者复发关系密切[6]。目前,有关LncRNA NEF在骨质疏松中的作用机制尚未明确。本研究建立动物骨质疏松模型,检测LncRNA NEF在骨质疏松中的表达变化,并进行体外实验分析沉默LncRNA NEF对成骨、破骨细胞分化的影响,以期为寻找骨质疏松潜在治疗靶标提供参考。
1 材料与方法
1.1 实验动物与细胞来源
6月龄SPF级健康雌性SD大鼠,体质量(180.25±27.03) g, 购自广州赛业百沐生物科技有限公司,使用许可证为[SYXK(粤)2020-0242]。饲养条件:每12 h明暗交替自然光照,进食、进水,25 ℃, 湿度50%, 噪音<60分贝,环境及鼠笼清洁、透气。
大鼠前成骨细胞系MC3T3-E1细胞(TC-axbz-094)购自上海信裕生物科技有限公司; 大鼠单核巨噬细胞系RAW264.7细胞株(C2001)购自上海盈湾生物科技有限公司。
1.2 主要试剂与仪器
MEMα培养基(KPM150421P)均购自武汉楚锐科药业科技有限公司; 反转录试剂盒(RP1105-100T)、AceQqPCR SYBR Green Mix(ALH185)、Trizol Reagent核酸分离试剂(YT526)、碱性磷酸酶活性检测试剂盒(1535174279); 茜素红染色液(YT8939)购自北京伊塔生物科技有限公司; 抗酒石酸酸性磷酸酶(TRAP)染液(OX02564)购自上海圻明生物科技有限公司; 蛋白提取试剂盒(SD-001)购自晨学生物科技(广州)有限公司; 兔抗人ALP(Abcam)、组织蛋白酶K(CTSK, PAB8636)购自上海科敏生物科技有限公司; HRP标记山羊抗兔二抗(GB23303)抗体均购自东莞市润博生物科技有限公司。
CO2培养箱(NHD DYE1738)购自日本sanyo公司; Elx800酶标仪(HSG9832)购自美国Thermo公司; 双能X射线骨密度仪(DPX-NT)购自上海聚慕医疗器械有限公司; 微计算机断层扫描仪(uCT50)购自瑞士SCANCO Medical。
1.3 方法
1.3.1 鼠尾悬吊法制备骨质疏松动物模型: 取12只大鼠,随机分为对照组(n=6, 正常大鼠)和实验组(n=6, 骨质疏松症大鼠)。大鼠骨质疏松症模型建立: 对大鼠实验室适应性饲养1周,采用鼠尾悬吊法(尾部悬吊,前肢着地,后肢悬空)[7], 制备骨质疏松症大鼠模型,使其身体长轴与水平面夹角呈30 °, 且活动不受限制, 4周后给予大鼠戊巴比妥钠(0.3 mL/kg)腹腔注射麻醉后处死,剥离左侧胫骨、椎骨,置于双能X射线骨密度仪探头下扫描,测定其骨密度值[8]。
1.3.2 微计算机断层扫描技术检测大鼠股骨骨量及结构: 腹腔注射麻醉后,处死取大鼠股骨组织,通过微计算机断层扫描仪及相关软件,检测骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁间距(Tb.Sp)。
1.3.3 实时荧光定量聚合酶链反应(qRT-PCR)法检测LncRNA NEF、ALP、TRAP、CTSK水平: TRIzol法分别提取对照组、实验组股骨组织总RNA并测定浓度。以RNA为模板、PrimeScript RT reagent试剂盒说明书为操作标准进行逆转录合成cDNA。体系20 μL: ULtraSYBR mixture(10.0 μL)、模板cDNA(2.0 μL)及上、下游引物(各2.0 μL)、去离子纯化水(4.0 μL); 条件(40个循环): 93 ℃ 30 s、93 ℃ 5 s、65 ℃ 30 s。β-actin为内参引物,引物由苏州泓迅生物科技股份有限公司设计合成,引物序列见表1。采用2-△△Ct方法计算LncRNA NEF、ALP、TRAP、CTSKmRNA相对表达量。

表1 引物序列
1.3.4 细胞培养及分化诱导: ① 细胞培养。分别复苏并解冻MC3T3-E1细胞、RAW264.7细胞,分别用含10%胎牛血清(FBS)+1%双抗的MEMα培养基,于37 ℃、5% CO2条件下培养,每2 d换液,无菌操作并传代培养。② 细胞分化诱导: 诱导MC3T3-E1细胞成骨分化时,更换成骨诱导分化培养液(含15% FBS+50 μmol/L α-左旋抗坏血酸+10 mmol/Lβ甘油磷酸盐+10-8mol/L地塞米松+100 U/mL青霉素+100 μg/mL链霉素的MEMα培养基),每2 d换液,诱导15 d。诱导RAW264.7细胞破骨分化时,更换含100 ng/mL破骨诱导因子RANKL的MEMα培养基,每2 d换液,诱导6 d。
1.3.5 茜素红染色: 将诱导成骨分化后的细胞用4%多聚甲醛固定30 min、茜素红染液(pH值4.2)染色10 min, 显微镜下观察成骨分化效果。
1.3.6 检测成骨分化过程中ALP活性及LncRNA NEF水平: 取“1.3.4”诱导成骨分化的MC3T3-E1细胞,严格按照ALP活性检测试剂盒检测诱导分化第0、15 天的细胞ALP活性,以全自动酶标仪测定各样品520 nm处吸光度(OD)值,在ALP标准曲线上读取酶活性值。参照“1.3.3” qRT-PCR法检测诱导分化第0、15天的细胞LncRNA NEF水平。
1.3.7 TRAP染色: 将诱导破骨分化后的细胞用4%多聚甲醛固定30 min、0.1%TritonX100通透10 min, 磷酸盐缓冲液(PBS)洗涤; 加入100 ng/mL 的TRAP染色液,染色60 min。显微镜下观察破骨分化效果,细胞呈酒红色、含3个及3个以上细胞核为破骨细胞。
1.3.8 检测破骨分化过程中CTSKmRNA及LncRNA NEF水平: 取“1.3.4”诱导破骨分化的RAW264.7细胞,参照“1.3.3” qRT-PCR法检测第0、6天CTSKmRNA、LncRNA NEF水平。
1.3.9 慢病毒感染实验: 设计并合成LncRNA NEF基因的siRNA序列,依据pSUPER质粒图谱选择单一酶切位点Bgl Ⅱ及Hind Ⅲ, 合成shRNA。① 对MC3T3-E1细胞成骨诱导3 d时,分别感染阴性对照的慢病毒、敲低LncRNA NEF的慢病毒,分别设为NC-shRNA组、shRNA-LncRNA NEF组。继续培养3 d后,参照“1.3.6”检测2组细胞ALP活性及LncRNA NEF水平; 参照“1.3.5”茜素红染色检测下调LncRNA NEF表达对成骨诱导分化的影响。② 对RAW264.7细胞破骨诱导3 d时,分别感染阴性对照的慢病毒、敲低LncRNA NEF的慢病毒,分别设为NC-shRNA组、shRNA-LncRNA NEF组。继续培养3 d后,参照“1.3.8”检测2组细胞CTSKmRNA、LncRNA NEF水平; 参照“1.3.7”TRAP染色检测下调LncRNA NEF表达对破骨诱导分化的影响。
1.3.10 蛋白免疫印迹法(WB)检测成骨分化、破骨分化相关蛋白表达情况: 收集诱导分化后的细胞,加入RIPA裂解液提取总蛋白并检测浓度及纯度,取20 μg蛋白于12% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,将各蛋白转至聚偏氟乙烯(PVDF)膜,放入脱脂奶粉(5%)溶液室温封闭2 h, 分别加入成骨分化相关蛋白(ALP)、破骨分化相关蛋白(CTSK), 稀释比均为1∶500(一抗), 4 ℃孵育过夜,洗膜缓冲液(TBST)清洗,加入辣根过氧化物酶(HRP)标记山羊抗兔二抗(1∶1 000), 室温孵育1 h, 采用ECL发光试剂显影,以β-actin为内参, Image J软件对各蛋白相对表达量进行半定量分析。
1.4 统计学分析
2 结 果
2.1 大鼠股骨结构参数比较
与对照组相比,实验组大鼠股骨骨密度、BV/TV、Tb.N、Tb.Th降低, Tb.Sp升高,差异有统计学意义(P<0.05)。见表2。
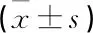
表2 大鼠股骨结构参数比较
2.2 LncRNA NEF、ALP、TRAP、CTSK在大鼠组织中的表达情况
与对照组比较,实验组大鼠股骨组织中LncRNA NEF、ALP水平降低,TRAP、CTSK水平升高,差异有统计学意义(P<0.05)。见表3。
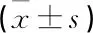
表3 LncRNA NEF、ALP、TRAP、CTSK在大鼠股骨组织中的表达情况
2.3 大鼠LncRNA NEF与ALP、TRAP、CTSK相关性分析
Pearson相关分析结果表明,在骨质疏松症大鼠中, LncRNA NEF与ALP表达呈正相关(P<0.05), 与TRAP、CTSK表达呈负相关(P<0.05)。见表4。

表4 骨质疏松症大鼠LncRNA NEF与ALP、TRAP、CTSK相关性分析
2.4 成骨分化过程中ALP活性及其蛋白表达与LncRNA NEF水平表达变化
与诱导第0天比较,第15天诱导成骨分化的MC3T3-E1细胞ALP活性与LncRNA NEF水平升高,差异有统计学意义(P<0.05)。见表5。

表5 成骨分化过程中ALP活性与LncRNA NEF水平表达变化
2.5 破骨分化过程中CTSK mRNA及其蛋白
表达与LncRNA NEF水平表达变化与诱导第0 天比较,第6 天诱导破骨分化的RAW264.7细胞CTSKmRNA水平及其蛋白表达均升高, LncRNA NEF水平降低,差异有统计学意义(P<0.05)。见表6、图1。

表6 成骨分化过程中CTSK mRNA及其蛋白表达与LncRNA NEF水平表达变化

图1 成骨分化过程中CTSK蛋白表达WB图
2.6 下调LncRNA NEF表达对成骨诱导分化的影响
与NC-shRNA组比较, shRNA-Lnc RNA NEF组成骨诱导分化的MC3T3-E1细胞ALP活性与LncRNA NEF水平均降低,且茜素红染色显示红色钙化结节减少,差异有统计学意义(P<0.05)。见表7、图2。
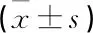
表7 下调LncRNA NEF表达对成骨诱导ALP活性及LncRNA NEF的影响
2.7 下调LncRNA NEF表达对破骨诱导分化的影响
与NC-shRNA组比较, shRNA-LncRNA NEF组破骨诱导分化的RAW264.7细胞CTSKmRNA水平及其蛋白表达均升高, LncRNA NEF水平降低,且TRAP染色结果显示酒红色、多核细胞增多,差异有统计学意义(P<0.05)。见图3、表8、图4。
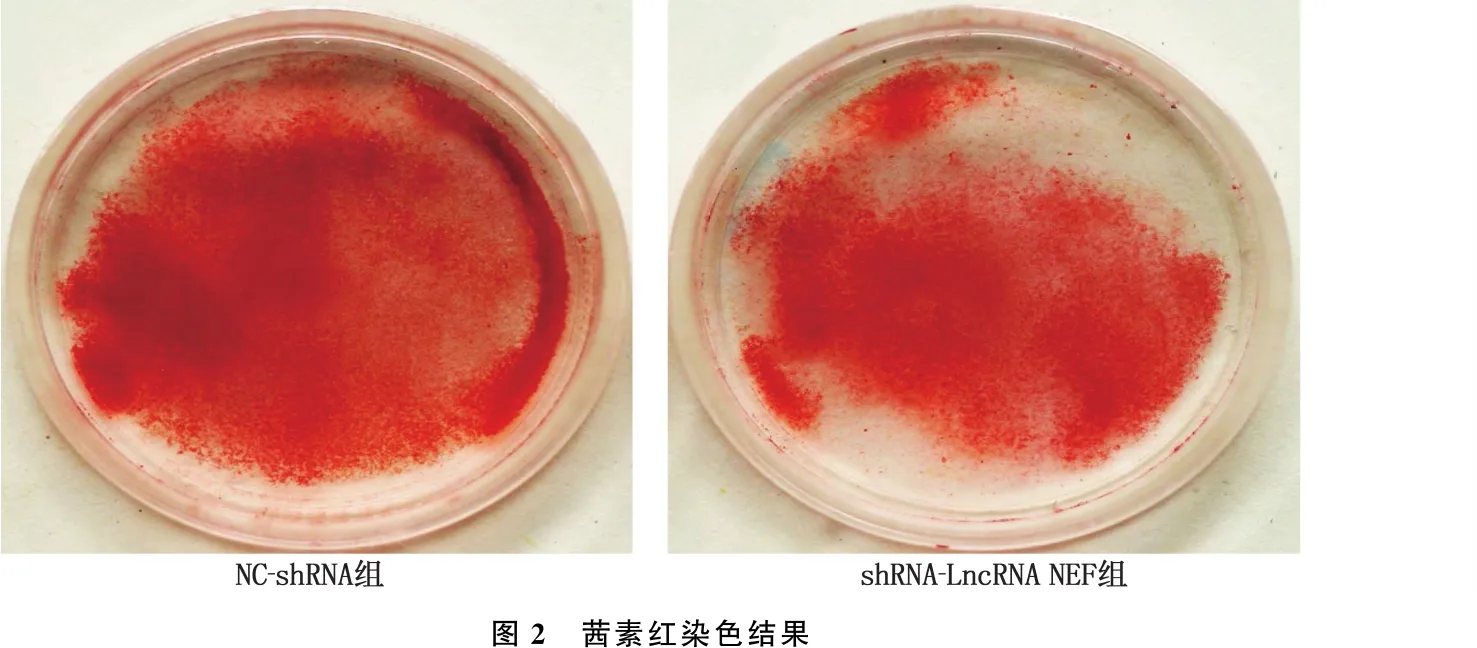

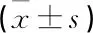
表8 下调LncRNA NEF表达对破骨诱导CTSK mRNA与蛋白及LncRNA NEF影响
3 讨 论
骨质疏松症是随年龄增长而出现的一种病理生理现象,主要表现为骨量低、骨组织微结构损坏、骨脆性增加等,是引起骨折的主要危险因素,其已成为全球慢性非传染性疾病之一[9-10]。骨生长是成骨细胞介导的骨形成与破骨细胞介导的骨吸收处于动态平衡的一个过程,当骨吸收大于骨形成时,则引发骨质疏松[10-11]。因此探究影响成骨与破骨分化活性的相关机制,并寻找新型生物防治靶点具有重要意义。尾悬吊法最早用于模拟宇航员的失重状态。大鼠尾部悬吊后,后肢肌肉的主动收缩减少,导致股骨和腰椎的生理运动负荷显著下降,由于废用导致骨重建,加速骨转换,骨吸收大于骨形成,骨量减少,使骨结构发生骨质疏松样变化[12]。骨密度是公认的用于评价是否发生骨质疏松的有力指标[13]。本研究显示,实验组大鼠股骨骨密度值显著低于对照组,说明模型建立成功。

LncRNAs在骨质疏松、关节炎、牙周炎等多种骨代谢疾病中发挥重要作用。LncRNAs可以从表观遗传(基因组印迹、X染色体失活)、转录调控(干扰临近基因表达)、转录后调控等方面对基因进行调控,参与成骨细胞分化、破骨细胞形成,影响骨吸收功能[14-15]。LncRNA NEF是由RNA聚合酶转录而成,是一种抑癌因子[16]。研究[17]显示,过表达LncRNA NEF能够抑制骨肉瘤细胞增殖、侵袭及转移。目前,有关LncRNA NEF的研究[18-20]主要集中在甲状腺癌、喉癌、骨相关肿瘤等方面。本研究发现,与对照组比较,实验组大鼠股骨组织中LncRNA NEF水平显著降低,与相关研究[5]结果表达趋势一致。ALP是成骨标志因子,能够促进成骨细胞成熟、钙化,其活性是反映成骨细胞分化程度及功能状态的良好指标[21]。TRAP是破骨细胞分化标志酶,可反应破骨细胞数量。本研究发现,实验组大鼠血清ALP、TRAP水平较对照组显著升高,提示骨质疏松发生引起成骨细胞、破骨细胞之间平衡紊乱,且LncRNA NEF异常低表达可能与骨质疏松的发生发展有关,但LncRNA NEF在骨质疏松大鼠中对成骨细胞和破骨细胞分化的影响需进一步研究。
ALP、TRAP、CTSK均为骨代谢过程中的重要指标。CTSK是破骨细胞重要的功能因子,主要参与降解骨有机基质,促进破骨细胞骨吸收[22]。本研究显示,前成骨细胞系MC3T3-E1细胞诱导成骨分化过程中MC3T3-E1细胞ALP活性与LncRNA NEF水平均显著升高; 诱导破骨分化的RAW264.7细胞CTSKmRNA及其蛋白表达水平显著升高, LncRNA NEF水平显著降低,提示LncRNA NEF可能参与成骨及破骨分化过程。此外,本研究发现,与NC-shRNA组比较,诱导成骨分化的shRNA-LncRNA NEF组细胞ALP活性与LncRNA NEF水平均降低,且茜素红染色的红色钙化结节减少,说明下调LncRNA NEF表达可能抑制MC3T3-E1细胞向成骨分化。与NC-shRNA组比较,诱导破骨分化的shRNA-LncRNA NEF组细胞CTSKmRNA及其蛋白表达水平升高,且TRAP染色结果显示破骨细胞数增多,说明下调LncRNA NEF表达可能促进RAW264.7细胞向破骨细胞分化。上述提示,LncRNA NEF可能通过调控ALP、TRAP、CTSK表达,参与调控成骨及破骨分化过程。
综上所述,LncRNA NEF在骨质疏松大鼠股骨中表达降低, NEF沉默可能通过抑制成骨分化并促进破骨分化,进而诱导骨质疏松的发生。然而本研究并未明确LncRNA NEF对成骨及破骨分化影响的具体作用机制,后期应进一步深入阐述。
