胸腺肽联合顺铂、培美曲塞二钠治疗晚期非小细胞肺癌临床疗效研究
2022-11-11王崇宝
高 娜,王崇宝
(陕西省中医医院,陕西 西安 710003)
在我国,肺癌的发病率、病死率均在恶性肿瘤疾病中排第一,其中约80%的患者为非小细胞肺癌(Non-small-cell lung cancer,NSCLC),且据流行病学调查显示,至2030年我国每年新发肺癌患者人数将达100万,而5年生存率仅有约10%,因此积极探索更加有效的治疗方法对改善患者的生存质量有重要意义[1-2]。目前临床治疗肺癌以放化疗、手术、免疫治疗等方法综合应用为主,而90%以上的患者需接受化疗[3]。顺铂是NSCLC一线治疗中的常用药物,治疗有效率约25%,培美曲塞二钠属于叶酸拮抗剂,可抑制肿瘤细胞增殖,两者联合应用在NSCLC的一、二、三线治疗中均有一定疗效,但两者对肿瘤细胞侵袭、转移的抵抗作用缺乏选择性,易损伤正常的组织、脏器等,进而影响患者接受化疗的耐受性[4]。胸腺肽属于免疫调节药物,可提高癌症患者的抗肿瘤效能,本研究旨在探讨胸腺肽与顺铂、培美曲塞二钠联合应用于晚期NSCLC治疗中的效果,现报告如下。
1 资料与方法
1.1 一般资料 选取2020年1月至2021年11月陕西省中医医院收治的101例NSCLC患者为研究对象。病例纳入标准:①经CT、病理学、细胞学检查确诊为NSCLC;②TNM分期[5]为Ⅲb-Ⅳ期;③Karnofsky功能状态评分[6]60分以上,预计生存期3个月以上;④可耐受本研究的治疗方法;⑤患者及其家属对研究内容知情同意。排除标准:①伴有其他原发恶性肿瘤;②伴有严重肝、肾等脏器功能异常;③临床资料不完整或中途退出研究;④精神疾病患者、哺乳妊娠妇女、未成年人等。应用随机抽签法将纳入患者分为对照组(51例)与观察组(50例)。对照组中男33例,女18例;年龄42~70岁,平均(57.63±10.22)岁;TNM分期:Ⅲb期23例,Ⅳ期28例;转移部位:肝6例,骨10例,胸腺及肺内13例,脑15例,淋巴结7例;疾病类型:鳞癌13例,腺癌38例。观察组中男34例,女16例;年龄41~69岁,平均(56.15±10.08)岁;TNM分期:Ⅲb期24例,Ⅳ期26例;转移部位:肝7例,骨10例,胸腺及肺内11例,脑16例,淋巴结6例;疾病类型:鳞癌15例,腺癌35例。两组上述一般资料比较差异无统计学意义(均P>0.05),具有可比性。本研究内容经本院伦理委员会同意后实施。
1.2 治疗方法 对照组治疗第1天静脉滴注注射用培美曲塞二钠(批号207235A)500 mg/m2,治疗第1~3天静脉滴注注射用顺铂(批号OMO345B02)75 mg/m2,1个化疗周期为3周,对照组患者共治疗2个周期。观察组患者在接受上述治疗的基础上皮下注射胸腺肽(批号2006401-2)治疗,20 mg/次,隔日注射1次,治疗时间同对照组。
1.3 观察指标 ①免疫指标水平:取两组患者治疗前及治疗后第3个月的空腹静脉血3 ml,使用流式细胞仪(美国BD,FACSCanto Ⅱ)检测其中T细胞亚群CD3+、CD4+、CD8+及自然杀伤细胞(NK)水平,并计算CD4+/CD8+的值。②肿瘤标志物水平:应用电化学发光法检测两组患者治疗前后血清中癌胚抗原(CEA)、胸苷激酶1(STK1)和糖类抗原125(CA125)水平。③近期疗效:治疗后参照《实体瘤治疗疗效评价标准-RECIST》[7]评价两组患者的治疗效果,完全缓解:病灶基本消失,肿瘤标记物检查无异常,并持续1个月以上;部分缓解:病灶体积缩小30%以上,同时维持时间1个月以上;稳定:病情发展未达到完全缓解和部分缓解条件,或病灶体积增加20%以下;进展:病灶体积增加20%以上,有效率=(完全缓解+部分缓解)例数/总例数×100%。④不良反应:统计两组患者治疗期间发生不良反应的概率,包括血液系统反应(白细胞、中性粒细胞、血小板减少等)、胃肠道反应(恶心、呕吐、腹泻等)、肝肾功能损伤及其他。

2 结 果
2.1 两组免疫指标水平比较 治疗前两组CD3+、CD4+、CD8+、NK、CD4+/CD8+水平比较,差异无统计学意义(均P>0.05),治疗后第3个月观察组上述指标水平均高于对照组,差异有统计学意义(P<0.05),见表1。
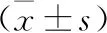
表1 两组免疫指标水平比较

续 表
2.2 两组肿瘤标志物水平比较 治疗前两组血清CEA、STK1、CA125水平比较,差异无统计学意义(均P>0.05),治疗后观察组上述指标水平均低于对照组,差异有统计学意义(均P<0.05),见表2。
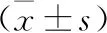
表2 两组肿瘤标志物水平比较
2.3 两组近期疗效比较 两组有效率比较,差异无统计学意义(P>0.05),见表3。

表3 两组近期疗效比较[例(%)]
2.4 两组不良反应发生情况比较 两组不良反应发生率比较,差异无统计学意义(P>0.05),见表4。

表4 两组不良反应发生情况比较[例(%)]
3 讨 论
肺癌的发病早期患者可有咳嗽、咳痰、胸闷等普通呼吸系统疾病症状,不足以引起患者的重视,因此有约80%的患者在疾病中晚期才接受治疗,错过最佳手术治疗时间,而对于晚期肺癌患者而言,化疗是其延长生命的重要治疗方法[8-9]。本研究中对照组患者使用顺铂与培美曲塞二钠治疗。顺铂可通过连接DNA中的鸟嘌呤和胞嘧啶干扰DNA复制,破坏DNA的结构和功能,是常用的一线化疗药物,但其应用易产生恶心、乏力等不良反应,影响治疗效果和治疗依从性,而培美曲塞二钠进入细胞后可转换为多谷氨酸,多谷氨酸可通过对胸苷酸合成酶产生抑制作用,阻止肿瘤细胞增殖过程中嘌呤、嘧啶的合成,同时多谷氨酸在肿瘤细胞中的代谢时间较长,因此培美曲塞二钠对肿瘤细胞产生药性作用的时间较长,顺铂与培美曲塞二钠联合治疗晚期NSCLC可降低肿瘤标志物水平,提高治疗效果,但也存在使患者免疫力下降的问题[10-11]。
恶性肿瘤细胞可通过生成活性氧、活性氮中间产物等促进周边间质上皮细胞发生恶性转化,还可以分泌细胞因子的方式激活抑制性信号通路,因此癌症患者体内的免疫系统常呈抑制状态,而化疗对正常细胞的伤害易加重免疫功能损伤[12]。但目前有诸多证据表明,机体免疫系统具有识别、吞噬肿瘤细胞的作用,有效的免疫应答可清除肿瘤细胞、防止癌症复发,尤其是效应T细胞的杀伤作用,因此提高患者的免疫功能有助于机体清除肿瘤细胞[13]。本研究中观察组患者在对照组治疗的基础上使用胸腺肽治疗。胸腺肽属于免疫调节制剂,主要成分是由28个氨基酸组成的胸腺肽α1,胸腺肽进入机体后呈现阳性免疫调节作用,可对T淋巴细胞的成熟、分化、抗原提呈、识别肿瘤细胞等起到促进作用,进而增强机体免疫功能,改善癌症患者的免疫抑制,同时其可经Toll样受体增强树突状细胞的活性,进而促进机体产生对肿瘤细胞有针对性的免疫应答,起到抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡的作用[14],同时有研究[15-16]表明,胸腺肽应用于晚期NSCLC化疗患者可提高药物的抗肿瘤效能,激活CD4+细胞和患者的体液免疫应答,同时促进CD8+细胞成熟,延长患者的平均生存时间。由T淋巴细胞介导的细胞免疫是机体免疫系统抵抗肿瘤细胞的重要方式,CD3+、CD4+可通过促进免疫应答的启动发挥抗肿瘤效应,而CD8+细胞可对细胞免疫功能产生抑制作用,当CD4+/CD8+的值减小时,表明机体的细胞免疫功能受到抑制,在该种状态下肿瘤细胞易逃脱免疫系统的相关清除作用,此外NK细胞是人体抗肿瘤的第一道防线[17-18]。本研究结果显示,治疗后第3个月观察组的CD3+、CD4+、CD8+、NK、CD4+/CD8+水平均显著高于对照组,表明胸腺肽联合培美曲塞二钠与顺铂治疗晚期NSCLC可改善免疫功能,究其原因可能与胸腺肽的免疫增强作用有关。CEA、STK1、CA125均为血清肿瘤标志物,其中CEA为酸性糖蛋白,具有人类胚胎抗原特异性,是较早用于NSCLC诊断的肿瘤标志物;STK1为DNA修复酶,可参与细胞增殖,与肿瘤细胞转化有关;CA125与纤维溶酶前体的结构类似,可阻碍纤维蛋白降解,影响肿瘤细胞的增殖、转移,三者血清水平越高代表恶性肿瘤的严重程度越重[19-20]。在本次研究结果中,治疗后观察组血清CEA、STK1、CA125水平均显著低于对照组,表明胸腺肽联合培美曲塞二钠与顺铂治疗晚期NSCLC可降低肿瘤标志物水平,究其原因可能与胸腺肽的应用间接促进了免疫细胞对肿瘤细胞的清除作用有关。有研究[21]表明,胸腺肽类免疫调节剂可通过促进淋巴细胞的表达增加造血因子的分泌量,还可通过调节柠檬酸循环代谢、饱和与不饱和脂肪酸的生物合成代谢、嘌呤代谢等纠正机体的代谢紊乱状态,其与化疗药物联用治疗NSCLC可降低化疗不良反应的发生率,提高疗效。本研究结果显示两组有效率、不良反应发生率之间的差异无统计学意义,该结果可能与研究时间较短、病例数较少等有关。
综上所述,胸腺肽联合培美曲塞二钠与顺铂治疗晚期NSCLC可改善患者免疫功能,降低肿瘤标志物水平,应用效果优于培美曲塞二钠与顺铂联合治疗,但本次研究的时间、纳入病例数量均有限,因此本研究中联合治疗方法对有效率、不良反应发生率的影响仍有待探讨。
