纤维蛋白原与白蛋白比值与激素受体阳性/人类表皮生长因子受体2阴性乳腺癌新辅助化疗疗效相关性分析
2022-11-11崔杰,刘鑫
崔 杰,刘 鑫
(安康市中心医院,陕西 安康725000)
相关流行病学资料显示,2020年全球乳腺癌新发病例为226万,约占当年全球新发恶性肿瘤患者的11.7%,位居恶性肿瘤排名第一位[1]。激素受体阳性/人类表皮生长因子受体2阴性(HR+/HER2-)乳腺癌是乳腺癌患者最常见的分子亚型。新辅助化疗(Neoadjuvant chemotherapy,NAC)亦被称为术前化疗,目前被认为是治疗局部晚期乳腺癌患者的重要手段,通过NAC能够显著缩小患者肿瘤体积,不仅增加保乳率与瘤体切除率,减轻患者手术所致的创伤,延长患者无病生存期和总生存期[2]。然而仍有部分的乳腺癌患者在接受NAC时疗效不佳,从而耽误了化疗后的手术时机。因此,NAC前如何精准有效的预测化疗疗效,对于临床医师制定更加精准的诊疗方案,并提高NAC疗效至关重要。纤维蛋白原与白蛋白比值(Fibrinogen to albumin ratio,FAR)既往被发现对评估急性ST段抬高型心肌梗死、颈动脉粥样硬化、糖尿病肾病等疾病病情及预后转归具有较高的临床价值[3-5]。近些年的研究证实FAR在预测恶性肿瘤如直肠癌、胃癌、肺癌等预后方面亦具有良好的价值[6-8]。然而,临床则鲜有报道FAR在预测乳腺癌患者预后尤其在预测NAC疗效的研究。鉴于此,本研究探讨了FAR与HR+/HER2-乳腺癌NAC疗效的相关性,为临床提供参考。
1 资料与方法
1.1 一般资料 回顾性收集2016年10月至2021年10月我院收治的112例首次实施NAC的HR+/HER2-乳腺癌患者的临床资料。病例纳入标准:①均为女性,经过病理组织学证实为HR+/HER2-乳腺癌,且属于浸润性导管癌;②患者纳入前均未接受相关乳腺治疗,且纳入后接受NAC的周期≥2个;③单侧乳腺肿瘤,且乳腺至少存在一个可测量病灶。排除标准:合并其他系统的恶性肿瘤,肿瘤发生远处移转者,合并心脑血管疾病者,血液系统疾病,凝血功能障碍,伴有感染性疾病者,伴有严重的心、肝和肾脏功能障碍者,缺失重要的病理资料者。纳入的患者或家属均签署知情同意书,并经过医院伦理委员会批准。
1.2 研究方法
1.2.1 NAC方案:采用蒽环联合或序贯紫杉类实施NAC,①TEC方案(多西他赛+表阿霉素+环磷酰胺),第1天静脉滴注环磷酰胺(500 mg/m2)与表柔比星(90 mg/m2),第2天静脉滴注多西他赛(75 mg/m2),总疗程为6个周期;②EC-T方案(表阿霉素+环磷酰胺序贯多西他赛),前4个周期静脉滴注环磷酰胺(600 mg/m2)与表柔比星(90 mg/m2),后4个周期静脉滴注多西他赛(100 mg/m2),此方案总疗程为8个周期。各方案均以21 d为一个NAC周期。
1.2.2 一般临床资料的收集:收集患者NAC前的临床资料与病理学资料,包括年龄、体重指数(BMI)、绝经状态、组织学分级、肿瘤直径、TNM分期、腋窝淋巴结情况、NAC方案、化疗周期。入院前1周内收集患者清晨空腹静脉血5 ml,采用法国STAGO公司生产的STA Compact Max全自动凝血分析仪检测血浆纤维蛋白原,应用日本奥林巴斯公司生产的AU5400型全自动生化分析仪检测血清白蛋白,并计算FAR。NAC前的孕激素受体(PR)、雌激素受体(ER)及Ki-67结果的判读:肿瘤细胞核染色显示出淡黄至棕黄色,在高倍镜下(400 倍光学显微镜下)随机选取5个视野,计算阳性染色细胞数量占全部细胞数量的比例。ER高表达、低表达分别定义为≥10%、1%~9%。PR高表达、低表达分别定义为>20%、≤20%。Ki-67高表达与低表达分别为>14%、≤14%[9]。
1.2.3 化疗疗效判定标准:参照实体肿瘤反应评价(RECIST)1.1版实施疗效评定[10]。分为4个等级,分别为完全缓解(所有靶病灶消失,全部病理淋巴结短径<10 mm)、部分缓解(基线靶病灶最长径总和缩小≥30%)、疾病稳定(介于部分缓解与疾病进展)、疾病进展(基线靶病灶最长径总和增加≥20%或出现新病灶)。化疗有效率=(完全缓解+部分缓解)例数/总例数×100%。

2 结 果
2.1 FAR预测NAC疗效的ROC曲线 FAR预测患者NAC疗效的ROC曲线下面积为0.719,最佳截断值为 0.073,灵敏度与特异度分别为78.97%和88.89%,见图1。

图1 FAR预测NAC疗效的ROC曲线
2.2 高FAR组和低FAR组临床特征与病理资料比较 根据FAR的最佳诊断截断值,将患者分为高FAR组(≥0.073)与低FAR组(<0.073)。与低FAR组比较,高FAR组ER、Ki-67高表达比例较低,两组比较差异有统计学意义(均P<0.05)。两组年龄、BMI、绝经状态、组织学分级、肿瘤直径、TNM分期、腋窝淋巴结情况、NAC方案、化疗周期、PR状态比较差异无统计学意义(均P>0.05)。见表1。

表1 高FAR组和低FAR组临床特征与病理资料比较(例)

续 表
2.3 高FAR组和低FAR组NAC疗效比较 低FAR组NAC有效率显著高于高FAR组(82.43%与 60.52%,P<0.05),见表2。

表2 高FAR组和低FAR组NAC疗效比较[例(%)]
2.4 NAC有效与无效患者FAR比较 NAC有效患者平均FAR水平显著低于无效患者,两组比较差异有统计学意义(P<0.05),见表3。
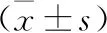
表3 NAC有效与无效患者FAR比较
2.5 影响NAC疗效的多因素Logistic回归分析 各变量赋值方法,见表4。经过多因素Logistic回归分析结果显示,FAR≥0.073是HR+/HER2-乳腺癌患者NAC疗效的不良预测因素(OR=0.350,95%CI:0.224~0.542,P<0.05),见表5。
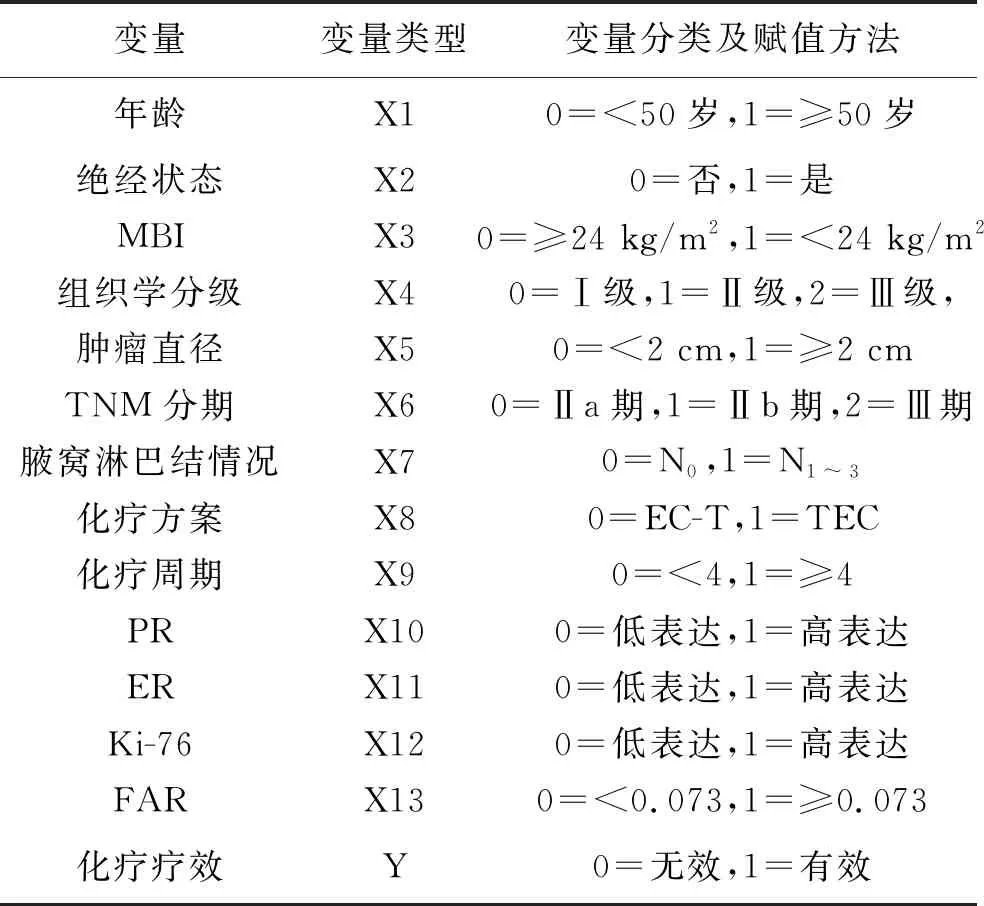
表4 Logistic回归分析中各变量赋值方法

表5 影响NAC疗效的多因素Logistic回归分析
3 讨 论
相关资料显示,在初次就诊的新发乳腺癌女性患者中有7%的病例已处于进展期,另有五分之一的新发患者已处于局部晚期。术前给予NAC是乳腺癌患者整个治疗过程中的重要一环,有研究显示,接受NAC的乳腺癌患者化疗总体有效率在60%~90%之间[11],本研究结果显示,NAC的总体有效率为75%(84/112),与上述报道基本一致。由于部分患者对NAC不敏感,因此并非所有患者都能从NAC中获益,为准确预测NAC疗效,为后续的手术做好充分准备,寻找一种预测并评价NAC疗效的指标就显得十分迫切。
既往的研究已证实,恶性肿瘤的发生、进展和扩散不仅与患者的病理特征密切相关,还和机体的慢性持续性炎性反应与凝血级联反应有关[12]。随着对恶性肿瘤化疗及预后研究的不断深入,近些年,有诸多炎症标记物(比如血小板和淋巴细胞比值,中性粒细胞和淋巴细胞比值等)被发现与患者预后有关,且能够在一定程度预测NAC疗效[13]。FAR是临床新近发现的一种炎症指标,相关研究证实,纤维蛋白原增高与白蛋白水平降低与肿瘤患者无进展生存期和总生存期缩短呈相关性[14]。Hwang等[15]回顾性收集了793例原发性乳腺癌的病理资料,按照绘制的ROC曲线得出FAR的最佳诊断截点值为0.071,并以此截点分为高低FAR组,该研究结果显示,高值组的总生存率显著低于低值组,且FAR≥0.071是影响患者总生存率的独立预测因素。张宏旭等[16]对995例乳腺癌患者的临床资料进行回顾性分析发现,FAR预测患者复发的ROC曲线下面积为0.078,最佳诊断截点为0.079,且FAR≥0.079组的复发率显著高于FAR<0.079。
本研究结果显示,低FAR组NAC有效率显著高于高FAR组。NAC有效患者平均FAR水平显著低于无效患者。多因素Logistic回归分析结果显示,FAR≥0.073可能是HR+/HER2-乳腺癌患者NAC疗效的不良预测因素。上述结果提示了,FAR越高,则患者NAC疗效越差,因此对于FAR≥0.073的患者应当视为化疗不佳的高危人群。FAR与NAC疗效的相关性机制可能有以下几点:①纤维蛋白原是由肝细胞产生的一种参与止血和凝血的糖蛋白,一方面其能够释放血管内皮生长因子(VEGF),加速新生血管的形成,因此为肿瘤细胞的增殖、扩散及侵袭性行为提供了有利的物质基础[17];此外,Hou等[18]通过相关实验证实,纤维蛋白原能够分布在肿瘤细胞周围从而形成一种致密的保护膜(纤维蛋白层),该保护膜能够有效保护肿瘤细胞,从而阻止自然杀伤细胞介导的细胞毒性效应;纤维蛋白原属于一种活性较强的促炎介质,能够通过诱导巨噬细胞活化并释放诸多炎症因子如巨噬细胞炎性蛋白-1,白细胞介素-1和肿瘤坏死因子等,从而刺激肿瘤细胞分化与增殖[19]。②血清白蛋白不仅反映了机体营养状况,还被认为是一种抗氧化、抗炎的保护性物质[20]。当白蛋白降低时一方面机体免疫功能降低,导致自然杀伤细胞杀灭肿瘤细胞的能力减弱,有利于肿瘤进展;另一方面白蛋白降低可削弱机体的抗炎效应,有利于炎症的持续存在,从而增加肿瘤扩散的风险。因此,对于伴有高FAR的乳腺癌患者,提示其机体慢性炎性反应程度较高,营养状况较差,肿瘤细胞侵袭性较强,不良预后的风险高,此类患者接受NAC时的疗效可能较差。
综上所述,FAR可能是预测HR+/HER2-乳腺癌患者NAC疗效的潜在指标,FAR<0.073的患者NAC疗效更佳。
