TLR2和NLRP3对大肠杆菌诱导的细胞因子分泌、脏器损伤和小鼠死亡的调控作用
2022-11-11任佩佩巩志国张兰欣顾柏臣赵佳敏高飞菲
任佩佩,巩志国,张兰欣,顾柏臣,赵佳敏,高飞菲,刘 博
(内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018)
大肠杆菌(Escherichiacoli,E.coli)是一种可以引起多种感染性疾病的重要病原,其致病性主要由特定的内外毒素所决定[1-2]。大肠杆菌感染通常会引起败血症、肾盂肾炎和腹膜炎等[3]。当大肠杆菌侵入动物机体后,宿主免疫细胞如巨噬细胞和树突状细胞等能够通过胞膜或胞内的模式识别受体(pattern recognition receptor,PRRs),包括Toll样受体(toll-like receptor,TLR)和NOD样受体(NOD-like receptor,NLR),对其特定的病原相关分子模式(pathogen associated molecular pattern,PAMP)或损伤相关分子模式(damage associated molecular pattern,DAMP)进行识别,随后激活细胞内信号转导通路,诱导细胞因子和趋化因子的分泌,从而发挥抗感染的作用[4]。
脂多糖(lipopolysaccharide,LPS)是一种存在于革兰阴性细菌细胞壁的内毒素。其作为大肠杆菌的主要致病成分之一,可被细胞膜表面的TLR4特异性识别[5]。此外,还可诱导上皮细胞释放大量的炎性介质,加剧炎症反应并引起局部组织的炎性损伤[6-7]。LPS耐受是一种被充分验证的现象。有研究表明,使用低剂量LPS刺激单核细胞或巨噬细胞后,再使用高剂量LPS刺激可以减少促炎细胞因子的分泌,保护“致死”剂量的LPS的刺激,从而降低实验动物的死亡率[8]。研究表明,除LPS外,大肠杆菌中还存在布劳恩脂蛋白(Braun lipoprotein,BLP),其广泛存在于大肠杆菌外膜中,由生长或裂解的细菌释放[9]。有研究证实,在宿主体内BLP能够通过TLR2诱导炎症反应的发生,且与大肠杆菌诱导的宿主体内细胞因子分泌和内毒素休克具有紧密关联[10]。既往研究发现,预先给予低剂量BLP刺激不仅可下调随后的“致死”剂量BLP刺激所致的宿主死亡,还可以减缓金黄色葡萄球菌(S.aureus)和鼠伤寒沙门菌(S.typhimurium),或盲肠结扎和穿刺诱导的败血症[11-12]。BLP耐受是生物在长期进化过程中形成的一种保护性调节机制,其目的是避免机体对BLP或内毒素再次刺激产生过度反应,进而造成炎性损伤,是机体防御机制的重要组成部分[13]。研究表明LPS和BLP诱导的耐受现象均与TLR2之间存在着紧密联系[14-16]。NLRP3(NLR pyrin domain-containing 3)炎性小体由NLRP3、细胞凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和caspase 1组成,可对特定的微生物和内源性配体进行识別[17]。研究证实,NLRP3炎性小体参与大肠杆菌感染诱导的小鼠腹腔巨噬细胞炎症反应[18]。有研究表明,在与直接使用LPS与ATP联合刺激相比,LPS预处理24 h后再用LPS与ATP联合刺激诱导的巨噬细胞IL-1β分泌处于较低水平,将其称为内毒素诱导的炎症小体激活耐受[19-20]。因此,本研究推测TLR2与NLRP3在大肠杆菌感染宿主过程中可能会介导类似的耐受现象。
本研究分析了大肠杆菌感染TLR2-/-、NLRP3-/-和野生型C57BL/6J小鼠后体内和体外细胞因子分泌、脏器损伤水平和小鼠死亡的情况,为阐明TLR2和NLRP3在调控大肠杆菌感染导致的宿主炎症反应中发挥的具体作用奠定了理论基础。
1 材料与方法
1.1 主要试剂、抗体和仪器PBS缓冲液购自Hyclone公司;硫乙醇酸盐流体培养基购自BD公司;LB肉汤培养基购自Oxoid公司;小鼠TNF-α和IL-1β ELISA试剂盒均购自Biolegend公司;小鼠IL-10 ELISA试剂盒购自eBioscience公司;组织包埋剂购自SAKURA公司;牛血清白蛋白(BSA)购自VWR Chemicals公司;兔抗HABP2单克隆抗体购自Abcam公司;Alexa Fluor 488偶联的山羊抗兔IgG二抗购自Abcam公司;多功能酶标仪ELX800购自Bio-Tek公司;低温高速离心机购自Thermo Fisher公司;组织匀浆仪TP-24购自杰灵仪器制造有限公司;激光共聚焦显微镜LSM800购自Zeiss公司;冰冻切片机购自SLEE公司。
1.2 细菌培养致病性大肠杆菌(鉴定证书号:SYS110017)由本课题组分离鉴定保存,并使用其开展了部分前期研究工作[21]。将-80℃保存的菌液于4℃融化后,转移至100 mL已灭菌的LB肉汤培养基中,37℃、200 r/min恒温摇床中连续培养12 h。根据本课题组前期研究数据,使用酶标仪检测菌液D600约为0.9时,表明其处于对数生长期。将菌液混匀后取1 mL,3 000 r/min离心6 min,弃上清,用无菌PBS缓冲液清洗细菌3次,最后使用1 mL PBS缓冲液重悬细菌,4℃保存备用。
1.3 实验动物与处理野生型C57BL/6J小鼠、TLR2基因敲除小鼠、NLRP3基因敲除小鼠均购自南京大学模型动物研究所,采用8~10周龄、体质量22 g左右的健康小鼠开展后续试验。使用致病性大肠杆菌对TLR2基因敲除(TLR2-/-)小鼠,NLRP3基因敲除(NLRP3-/-)小鼠和C57BL/6J小鼠进行腹腔注射(1×108CFU),随后观察小鼠存活情况,每组20只小鼠。感染3,6 h后进行眼球采血,同时收集腹腔灌洗液。收集血液置于室温2 h后,4℃过夜。3 000 r/min离心10 min后,取上层血清;收集的腹腔灌洗液3 000 r/min离心10 min,收集上清液,-80℃保存备用。TLR2-/-、NLRP3-/-和C57BL/6J小鼠腹腔均注射2 mL 3%硫乙醇酸盐流体培养基,注射3 d后处死小鼠,提取小鼠腹腔巨噬细胞并将细胞浓度调至2.5×106,将细胞转移至6孔板中,37℃、5% CO2细胞培养箱培养18 h。使用大肠杆菌(1×106CFU)感染TLR2-/-、NLRP3-/-和C57BL/6J小鼠巨噬细胞,分别在感染3,6,9,12,24 h后收集细胞培养上清液,3 000 r/min离心10 min,取上清液于-80 ℃保存备用。
1.4 ELISA检测将-80℃保存的血清、腹腔灌洗液和细胞培养上清液置于4℃缓慢解冻。按照ELISA试剂盒说明书方法检测血清、腹腔灌洗液和细胞培养上清液中TNF-α、IL-1β和IL-10的分泌水平。
1.5 免疫荧光法检测将-80℃保存的肾脏和肝脏转移至4℃缓慢解冻,剪成小块,使用包埋剂将其包埋,用冰冻切片机制成6 μm厚的切片,冷丙酮固定10 min后,将切片在含0.25%吐温的冷PBS缓冲液中清洗3次,每次10 min。室温下用含有5% BSA的封闭液孵育1 h。加入兔抗HABP2单克隆抗体,4℃避光孵育过夜。孵育完成后,用含0.25% 吐温的PBS缓冲液洗涤3次,每次15 min,然后使用Alexa Fluor 488偶联的山羊抗兔IgG二抗于室温避光条件下孵育1 h。使用激光共聚焦显微镜进行图像采集(Zeiss LSM 800,×100倍)及荧光强度分析。
2 结果
2.1 TLR2和NLRP3对大肠杆菌感染后小鼠死亡率的影响使用致病性大肠杆菌(1×108CFU)分别感染TLR2-/-、NLRP3-/-和C57BL/6J小鼠后,进行死亡情况的分析,结果显示,在大肠杆菌感染14 h后C57BL/6J试验组小鼠的存活率为100%,而TLR2-/-感染试验组小鼠存活率为80%,NLRP3-/-试验组小鼠全部死亡(图1)。结果表明,在大肠杆菌感染小鼠的过程中,TLR2和NLRP3对小鼠均具有一定的保护作用,可在一定程度上避免小鼠出现由大肠杆菌感染导致的快速死亡。
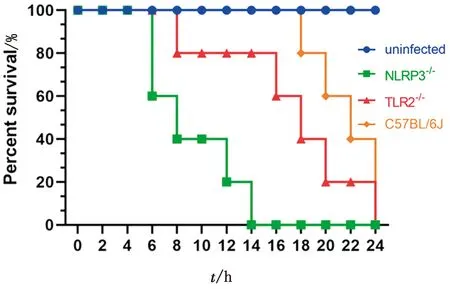
图1 致病性大肠杆菌感染TLR2-/-,NLRP3-/-和C57BL/6J小鼠后的死亡情况
2.2 TLR2和NLRP3对大肠杆菌感染后小鼠腹腔灌洗液和血清中细胞因子分泌的影响使用致病性大肠杆菌(1×108CFU)分别感染TLR2-/-、NLRP3-/-和C57BL/6J小鼠后,分析腹腔灌洗液和血液中促炎性细胞因子(TNF-α和IL-1β)和抗炎因子(IL-10)的分泌水平。由图2可见,与未感染对照组相比,使用大肠杆菌感染3,6 h后,小鼠腹腔灌洗液和血清中TNF-α、IL-1β和IL-10分泌水平均显著上升(P<0.001)。大肠杆菌感染3,6 h后,与C57BL/6J小鼠相比,TLR2-/-和NLRP3-/-小鼠血清中TNF-α、IL-1β和IL-10的分泌均处于较高水平(P<0.001)。此外,在大肠杆菌感染3,6 h后,与C57BL/6J小鼠相比,TLR2-/-和NLRP3-/-小鼠腹腔灌洗液中TNF-α和IL-10的分泌均处于较高水平,而IL-1β的分泌处于较低水平(P<0.001)。结果表明,TLR2和NLRP3在致病性大肠杆菌感染过程中,对小鼠血清和腹腔灌洗液中促炎性细胞因子和抗炎因子的分泌水平具有一定的调控作用。

A~C.血清中TNF-α、IL-1β、IL-10的分泌水平;D~F.腹腔灌洗液中TNF-α、IL-1β、IL-10的分泌水平
2.3 TLR2和NLRP3对大肠杆菌感染后小鼠腹腔巨噬细胞细胞因子分泌的影响使用致病性大肠杆菌(1×106CFU)感染TLR2-/-、NLRP3-/-和C57BL/6J小鼠腹腔巨噬细胞后,分析细胞培养上清液中促炎性细胞因子(TNF-α和IL-1β)和抗炎因子(IL-10)的分泌水平。结果表明(图3),使用大肠杆菌感染3,6,9,12,24 h后,巨噬细胞培养上清液中TNF-α、IL-1β和IL-10的分泌水平均显著高于未感染组(P<0.001)。在大肠杆菌感染3,6,9,12,24 h后,TLR2-/-和NLRP3-/-巨噬细胞培养上清液中TNF-α的分泌水平均显著高于C57BL/6J小鼠来源巨噬细胞中TNF-α的分泌水平(P<0.001)。在感染3,6,9 h后C57BL/6J小鼠来源的巨噬细胞IL-1β分泌水平显著高于TLR2-/-和NLRP3-/-巨噬细胞,而在感染12,24 h后其IL-1β的分泌水平显著低于TLR2-/-巨噬细胞。此外,NLRP3-/-巨噬细胞IL-1β的分泌量始终处于较低水平(P<0.001)。在感染3,6,9 h后,TLR2-/-和NLRP3-/-巨噬细胞培养上清液中IL-10的分泌水平显著高于C57BL/6J小鼠来源的巨噬细胞,而在感染12,24 h后显著低于C57BL/6J小鼠来源的巨噬细胞IL-10分泌水平(P<0.01)。结果表明,TLR2和NLRP3参与对大肠杆菌感染诱导的小鼠腹腔巨噬细胞促炎性细胞因子和抗炎因子分泌的调控。
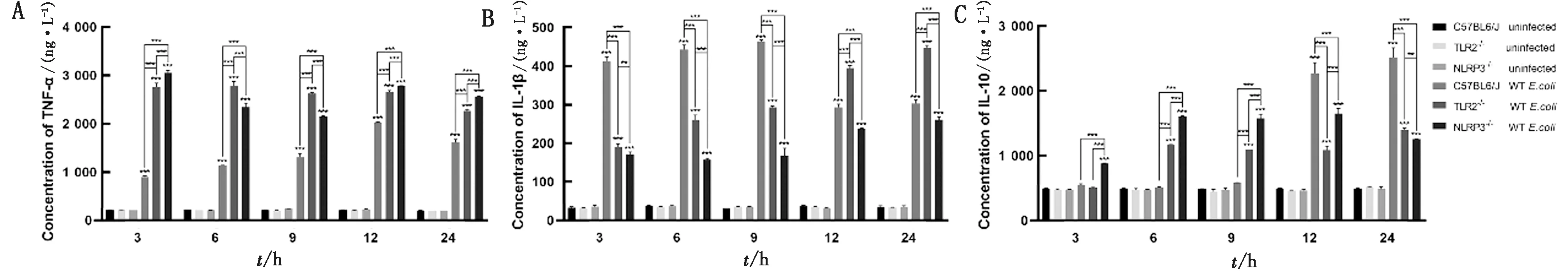
A.TNF-α;B.IL-1β;C.IL-10
2.4 TLR2和NLRP3对大肠杆菌感染诱导的小鼠肝脏和肾脏组织损伤的影响使用致病性大肠杆菌(1×108CFU)感染12 h后,分析小鼠肾脏和肝脏中组织损伤标志物HABP2的表达情况。结果表明(图4),与未感染对照组相比,大肠杆菌感染TLR2-/-、NLRP3-/-和C57BL/6J小鼠后,小鼠肝脏和肾脏中HABP2的表达显著上升(P<0.01)。此外,与C57BL/6J小鼠相比,TLR2-/-和NLRP3-/-小鼠在大肠杆菌感染后肝脏和肾脏中HABP2的表达均处于较高水平。结果表明,TLR2和NLRP3对大肠杆菌诱导的小鼠脏器组织损伤标志物HABP2的蛋白表达具有下调作用。
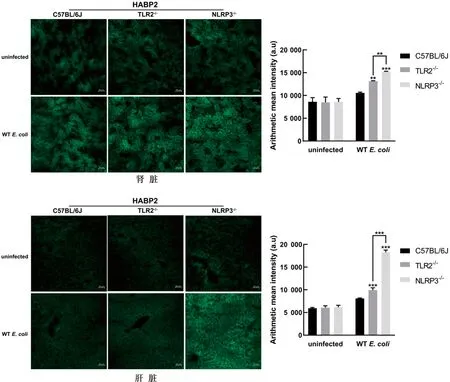
图4 致病性大肠杆菌感染TLR2-/-、NLRP3-/-和C57BL/6J小鼠后肝脏和肾脏中组织损伤标志物HABP2的表达
3 讨论
大肠杆菌是一种广泛存在于自然界中的条件性致病菌[1-2]。当大肠杆菌入侵机体后宿主体内的天然免疫细胞,如巨噬细胞和树突状细胞通过胞膜或胞内的模式识别受体对大肠杆菌的病原相关分子模式进行特异性识别[4]。研究表明,大肠杆菌的病原相关分子模式,可被宿主TLR4或TLR2识别,进而激活转录因子(NF-κB)和丝裂原活化蛋白激酶(MAPK)等信号通路,从而介导促炎细胞因子和趋化因子的分泌,形成有效的免疫反应[22-23]。NLRP3炎性小体是一个蛋白复合体,可以被多种刺激物激活,如病原体或特定的病原相关分子模式,从而诱导 caspase-1的剪切和IL-1β的成熟[24]。MANGAN等[17]研究表明,在大多数细胞中,NLRP3的激活至少需要2个步骤,首先通过启动NLRP3基因的表达转录来启动细胞;随后的启动是通过模式识别受体(PRRs)的参与NF-κB激活,包括Toll样受体(TLRs)、核苷酸结合寡聚结构域包含蛋白2(NOD2)等介导的。研究表明,TLR2和NLRP3均可介导宿主炎症反应和组织损伤[25-26]。但TLR2和NLRP3在大肠杆菌诱导的宿主炎症反应中的具体调控作用目前尚不完全清楚。本研究结果表明,TLR2和NLRP3在大肠杆菌诱导的小鼠死亡、细胞因子分泌和脏器损伤均具有一定的调控作用。
细菌成分的耐受是生物在长期进化过程中形成的,是细菌感染过程中机体的一种重要的保护性调节机制[15,27]。有研究表明,TLR2在LPS或BLP诱导的宿主耐受过程中充当着重要的角色[14-16]。NLRP3在微生物感染过程中发挥的调节作用尚不清楚,此前对于NLRP3具有耐受性的报道较少。但是,近期BAMBOUSKOVA等[19]研究表明,在LPS预刺激24 h后再用LPS和ATP联合刺激巨噬细胞,其诱导的IL-1β分泌比直接使用LPS和ATP联合刺激巨噬细胞时发生下调,这种现象被称为内毒素诱导的炎症小体激活耐受。本研究发现,使用致病性大肠杆菌感染小鼠后,TLR2-/-、NLRP3-/-小鼠的死亡速度比C57BL/6J小鼠的死亡速度更快。本课题组对该现象可能出现的原因开展了进一步的探索。
细菌感染导致宿主死亡的主要原因是严重的全身性或局部炎症反应,而细胞因子的分泌是炎症反应强度的关键指标[28-29]。结果表明,在致病性大肠杆菌感染后,TLR2-/-和NLRP3-/-小鼠血清或腹腔灌洗液中TNF-α、IL-1β和IL-10的分泌量显著高于C57BL/6J小鼠。根据此结果本研究推测,当TLR2和NLRP3被敲除后,在大肠杆菌感染时宿主无法形成有效的耐受来调控细胞因子的分泌量,进而导致细胞因子的大量分泌。这可能是导致TLR2和NLRP3小鼠死亡速度加快的一个重要因素。KOCH等[30]研究表明,细菌菌体成分可通过TLR2或TLR4促进NLRP3炎性小体和Caspase-1的激活,以及IL-1β加工和分泌。因此,当TLR2或NLRP3敲除后,小鼠腹腔灌洗液中IL-1β分泌发生下调。该结果与大肠杆菌感染腹腔巨噬细胞的结果可相互验证,且细胞感染试验表明,耐受的建立可能具有一定时间效应。大肠杆菌感染可诱导宿主体内促炎性细胞因子包括TNF-α和IL-1β的分泌,进而导致炎症反应及脏器损伤[31]。HABP2与多种疾病过程有关,包括肾损伤、肝纤维化和炎症反应[32-33]。结果表明,TLR2和NLRP3参与的耐受效应在大肠杆菌感染导致的肝脏和肾脏损伤中发挥了重要的调控作用。上述研究表明,在大肠杆菌感染过程中,宿主可能通过TLR2和NLRP3介导耐受效应的建立,下调宿主全身或局部炎症反应,对脏器产生一定的保护作用,从而避免由细菌感染导致的宿主快速死亡。
综上所述,耐受现象可能是病原微生物与宿主之间形成的一种共生平衡。本课题组先前的研究表明,大肠杆菌菌体成分BLP可诱导宿主出现耐受效应,以下调宿主的炎症反应,延长宿主的生存时间,进而为其在宿主体内的繁殖创造更有利的条件。在此基础上,本研究结果表明,宿主TLR2和NLRP3可能对大肠杆菌感染诱导的宿主耐受效应具有调控作用,使宿主有足够的时间来形成有效的免疫反应对细菌进行杀伤。因此大肠杆菌感染所致炎症的结局,最终结果取决于宿主与病原微生物之间的斗争关系。但是,该耐受现象产生的具体机制尚未明确,还需进一步研究加以探讨。
