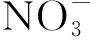氟喹诺酮类药物氯化的选择性氧化反应及紫外/氯强化处理工艺
2022-11-10赵世荣商伟伟钱雅洁
沈 芸,赵世荣,商伟伟,钱雅洁
(东华大学环境科学与工程学院,上海 201620)
氟喹诺酮类(fluoroquinolones,FQs)药物是喹诺酮类药物的哌嗪基衍生物,由于其广谱性和疗效好,在临床中广泛应用[1]。但是FQs在人体内无法完全代谢,在使用后进一步排放至自然环境中,导致该类物质在水环境中频繁检出[2]。据报道,我国七大流域中,海河、辽河和珠江的FQs检出的质量浓度达100 ng/L[3];典型的半封闭内海渤海湾,在废水和城市污水的大量排放下,其FQs检出的质量浓度高达726 ng/L[4]。FQs在水环境中不断累积,通过食物链富集到生物体内,从而危害人体健康[5]。
我国现有污水处理工艺是基于物化预处理耦合活性污泥法的生化处理工艺,该类处理工艺对FQs等新兴污染物去除效率较低[6]。氯化是城市污水和饮用水净化过程中被普遍采用的技术,因此,研究氯化过程对掌握FQs在水环境中的归宿至关重要[4]。几乎所有FQs药物都含有芳香胺的结构,Najjar等[7]研究了左氧氟沙星(levofloxacin,LVF)的氯化行为,发现其结构上的叔胺会最先受到氯的攻击,在氯化过程中,药物可能会发生氧化/取代反应;Wang等[8]的产物分析结果表明,大部分产物中都存在完整的喹诺酮类化合物;Dodd等[9]的研究表明喹诺酮类部分对游离活性氯(FAC)不反应。然而,FQs不同哌嗪结构与氯化反应的活性关系鲜有研究,比较仲胺和叔胺基FQs一类的氯化行为,研究氯化对FQs药物的选择性反应,对掌握氯化消毒过程中污染物的转化具有重要意义。
本文选择LVF、恩诺沙星(enrofloxacin,ENR)和环丙沙星(ciprofloxacin,CIP)3种典型FQs,研究其单独氯化的降解行为,比较了不同FQs氯反应浓度的变化,并探究FQs不同结构与氯化反应的相关关系;同时通过紫外强化手段,研究了FAC在紫外活化作用下CIP的降解反应过程和不同水基质对CIP的降解影响。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
LVF、ENR、CIP的标准化学品均购自Sigma Aldrich上海有限公司,为分析纯级别,物质结构如表1所示。磷酸二氢钠、磷酸氢二钠、L-抗坏血酸、氯化钠、碳酸氢钠、腐植酸、氢氧化钠、磷酸、三乙胺均为Aladdin分析纯级别。液相使用的甲醇、乙腈均为Sigma Aldrich色谱纯级别。
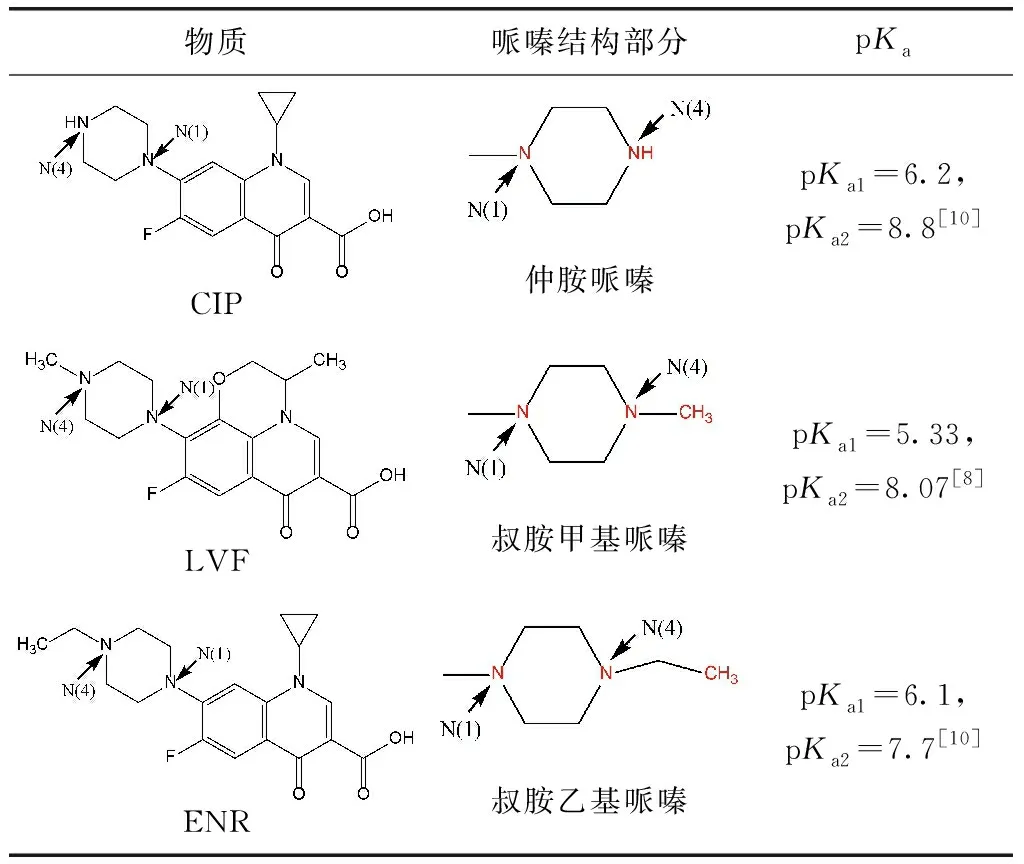
表1 FQs不同结构示意图Tab.1 Schematic Diagram of Different Structures of FQs
1.1.2 试验仪器
试验仪器:高效液相色谱仪(Agilent 1260,美国)、Poroshell 120 EC-C18色谱柱(4.6 mm×250 mm×2.7 μm)、紫外分光光度计(UV-1600PC,上海美谱达)、pH值计(FE28K,Mettler Toledo)、磁力搅拌器(84-1A上海司乐仪器有限公司)、电子天平(AW120, 岛津)。试验装置如图1所示。
图1 反应装置示意图Fig.1 Schematic Diagram of Reaction Apparatus
1.2 试验方法
所有试验操作均在室温为(25±2)℃下,在装有254 nm紫外灯管的黑箱中进行,并于试验前30 min打开紫外灯准备。将40 μmol/L等目标污染物溶解于石英杯中,用10 mmol/L磷酸盐(PB)缓冲液调节反应pH,加入相应浓度的NaClO溶液,在恒温磁力搅拌器上充分搅拌,于一定的时间点取样1 mL并经过0.45 μmol/L滤膜过滤于液相棕色进样瓶,并立即用0.5 mL摩尔浓度为100 mmol/L的L-抗坏血酸对余氯进行猝灭,取样结束后于48 h内将样品放于高效液相色谱(HPLC)进行定量分析以测定FQs浓度。试验还分别研究了NaClO投加量、pH、共存离子等对反应降解效果的影响和降解动力学。所有的试验重复3次。
1.3 分析方法
经过紫外、单独氯化和紫外/次氯酸钠系统处理后的样品溶液采用HPLC进行检测。检测器为光电二极管阵列检测器,流速为0.8 mL/min,进样量为20 μL,柱温为30 ℃,流动相A相(0.3%的磷酸缓冲液,使用三乙胺调节pH值为2.4)和C相(乙腈)的比例为80∶20,样品检测时间为12 min。反应过程中氯浓度的变化采用国标法DPD分析方法进行测定。
1.4 反应动力学分析
FAC降解FQs的动力学方程如式(1)。
(1)
其中:kapp——二级速率常数,L/(mol·s);
t——时间,s;
[FQs]、[FAC]——FQs、FAC的平衡摩尔浓度,μmol/L。
当反应体系中[FAC]∶[FQs]≥10∶1,可近似认为式(1)中的[FAC]为常数,符合一级反应的验证,可简化为式(2)。
(2)
其中:kobs——伪一级反应速率常数,s-1。
2 结果与讨论
2.1 单独氯化过程氧化FQs
2.1.1 氯投加量对不同结构FQs的降解影响
如图2所示,LVF和ENR降解反应呈现较高的一致性,即随着氯浓度的增加,其降解率逐渐增大,而CIP降解率变化较小。结果表明,在pH值为7、氯投加量为75 μmol/L时,LVF和ENR在2 min时降解率分别为96.4%和91.5%,而CIP降解率仅为5.2%。当氯投加量增加到400 μmol/L时,LVF和ENR在2 min内完全降解,CIP降解率为12.4%,仅增加7.2%,由此可见,相较于LVF和ENR,CIP在单独氯化作用下的降解效率较慢,这是FQs不同哌嗪结构所致。
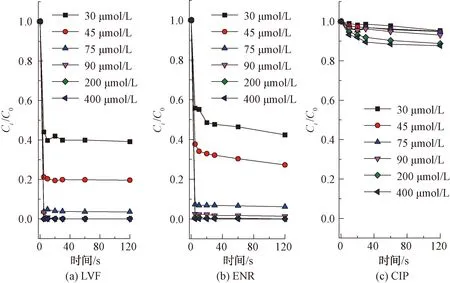
注:[FQs]=40 μmol/L,[PB]=10 mmol/L,pH值=7图2 氯投加量对不同结构FQs的降解影响Fig.2 Influence of Chlorine Dosage on Degradation of FQs with Different Structures
已有研究表明,FQs喹诺酮类部分不易与游离氯反应,每个哌嗪环的酸性N(4)原子(pKa=0.7)对亲电因子的反应性应比N(1)原子小得多[9],因此,FQs主要以哌嗪结构中的N(4)原子为反应位点[9-10]。同时,N(4)原子反应速率的快慢也可间接通过氯消耗速率的快慢来体现。当反应开始,体系中的氯首先会攻击哌嗪结构上的N(4)原子生成自由基,接着通过来自N(1)的电子供体协同裂解导致C-C裂解并生成亚胺中间体,随后发生脱烷基化反应[11]。试验数据表明,相同条件下LVF和ENR降解效率较CIP更快,说明LVF和ENR与氯的反应性高于CIP与氯的反应性,即具有叔胺哌嗪结构的FQs比仲胺哌嗪结构的FQs和氯反应更活泼。
2.1.2 不同FQs结构下对应氯浓度的消耗
为进一步研究FQs结构对氯反应的相关性,试验做了不同FQs结构下对应氯浓度的消耗曲线图。由图3可知,不同FQs对应氯的消耗呈现显著差异性。在相同氯量条件下,FQs对应氯的消耗结果为:LVF>ENR>CIP。比较明显地,当氯摩尔浓度为75 μmol/L时,LVF氯的消耗率为87.07%,ENR为58.57%,而CIP仅为23.33%。试验数据表明,在相同条件下,含有叔胺甲基哌嗪的LVF反应所消耗氯的量最多,含有叔胺乙基哌嗪的ENR反应所消耗的氯量次之,含有仲胺哌嗪结构的CIP反应所消耗的氯量最少。
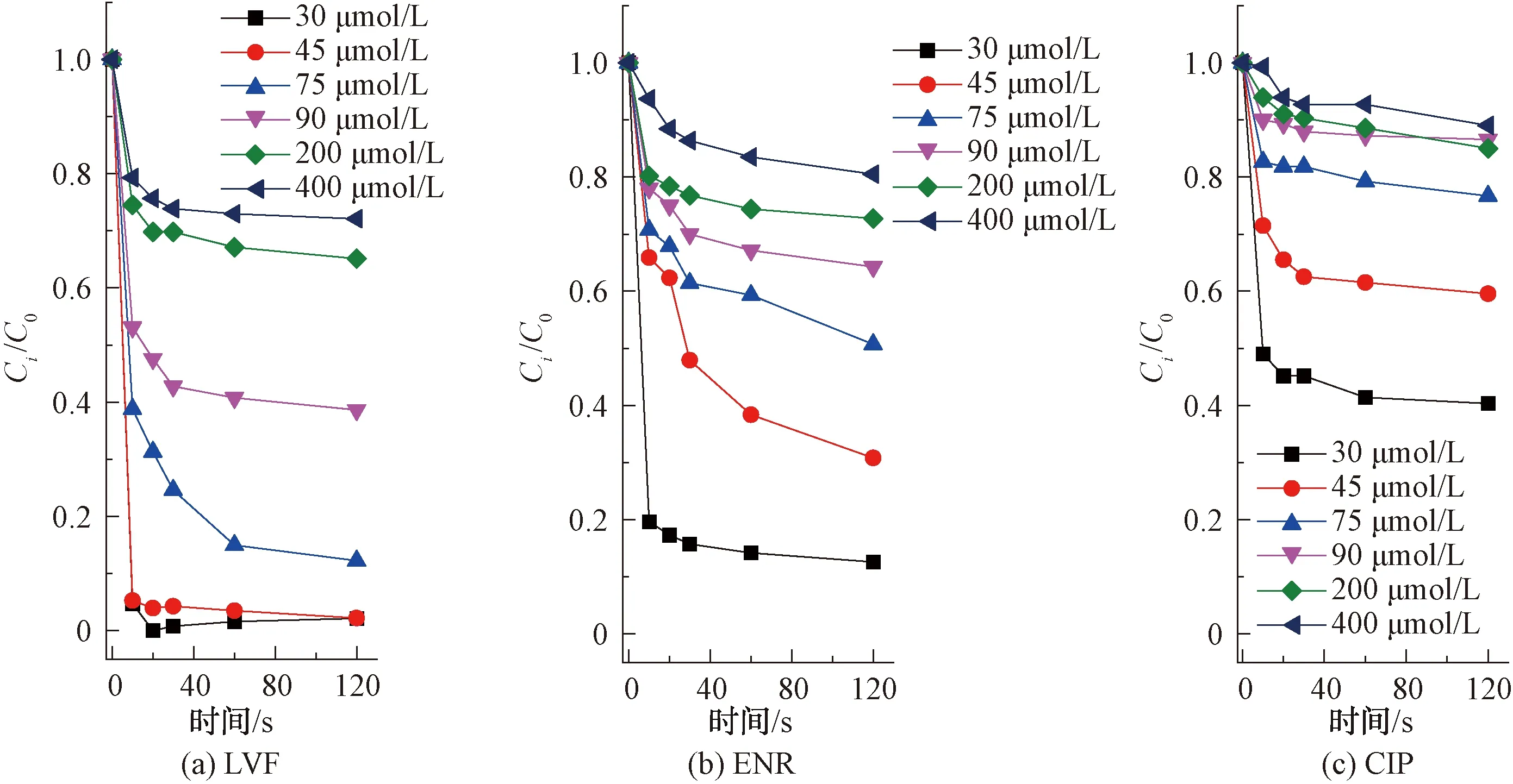
图3 不同FQs结构下对应氯浓度的消耗Fig.3 Consumption of Relevant Chlorine Concentration under Different FQs Structures
已有研究比较了FQ阴离子的速率常数(FQs阳离子对整体的降解贡献不显著[10]),发现在其哌嗪部分含有叔N(4)胺的氧氟沙星(OFL)和ENR与ClO2的反应速率快于含有仲N(4)胺的CIP、诺氟沙星(NOR)、洛美沙星(LOM)和哌啶酸(PIP),其动力学模拟结果为OLF>ENR>CIP~LOM~NOR>>PIP[11]。本试验数据表明,CIP降解所消耗的氯量最少。从结构上来看,LVF和ENR分别为含有叔胺甲基哌嗪和叔胺乙基哌嗪的FQs,而哌嗪结构上甲基的氧化态高于乙基,从而导致LVF消耗更多的氯量。因此,3种不同FQs与氯反应的活泼性为LVF>ENR>CIP,即叔胺甲基哌嗪结构>叔胺乙基哌嗪结构>仲胺哌嗪结构。
2.1.3 pH对不同FQs结构的降解影响
pH是FQs氯化过程中重要的影响因素[12]。如图4所示,LVF、ENR和CIP在不同pH下呈现相同的降解规律,pH值从3~7和7~9降解率分别呈先增加后减少的趋势,即在碱性条件下(pH值=9),FQs的降解率最低,在中性条件下(pH值=7),FQs的降解率最高。查阅文献,抗生素的降解归因于FAC形态(HOCl和OCl-)和抗生素解离状态的综合效应[13]。
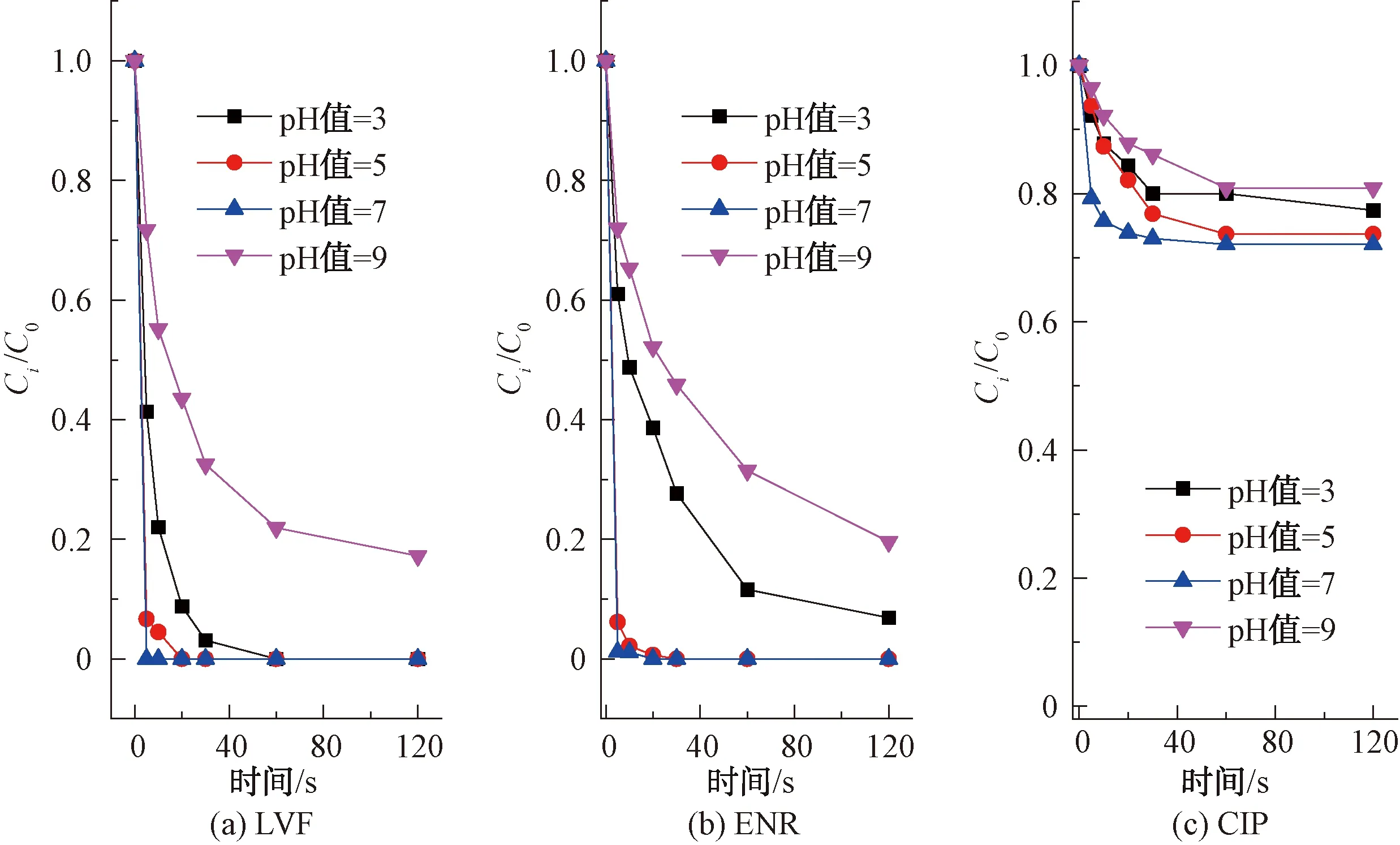
图4 pH值对不同FQs结构的降解影响Fig.4 Influence of pH Value on Degradation of FQs with Different Structures
已知HOCl是一种不稳定弱酸,在水中会发生电离反应[10],如式(3)。

(3)
不同pH下HOCl和OCl-的形态分布如图5所示,pH升高,促使反应正向进行,而后者的氧化能力明显弱于前者,导致pH增大而降解速率降低,即FQs的降解率在碱性条件下低于中性和酸性条件。然而在中性和酸性条件下,FQs的降解率并不总是随着pH的降低而增加。这是因为去质子化的FQs与FAC反应时比质子化的FQs更具活性[14](FQs的pKa如表1所示),同时,HOCl的氧化能力比OCl-更强,因此,当pH值为7时,FQs的降解率最大。
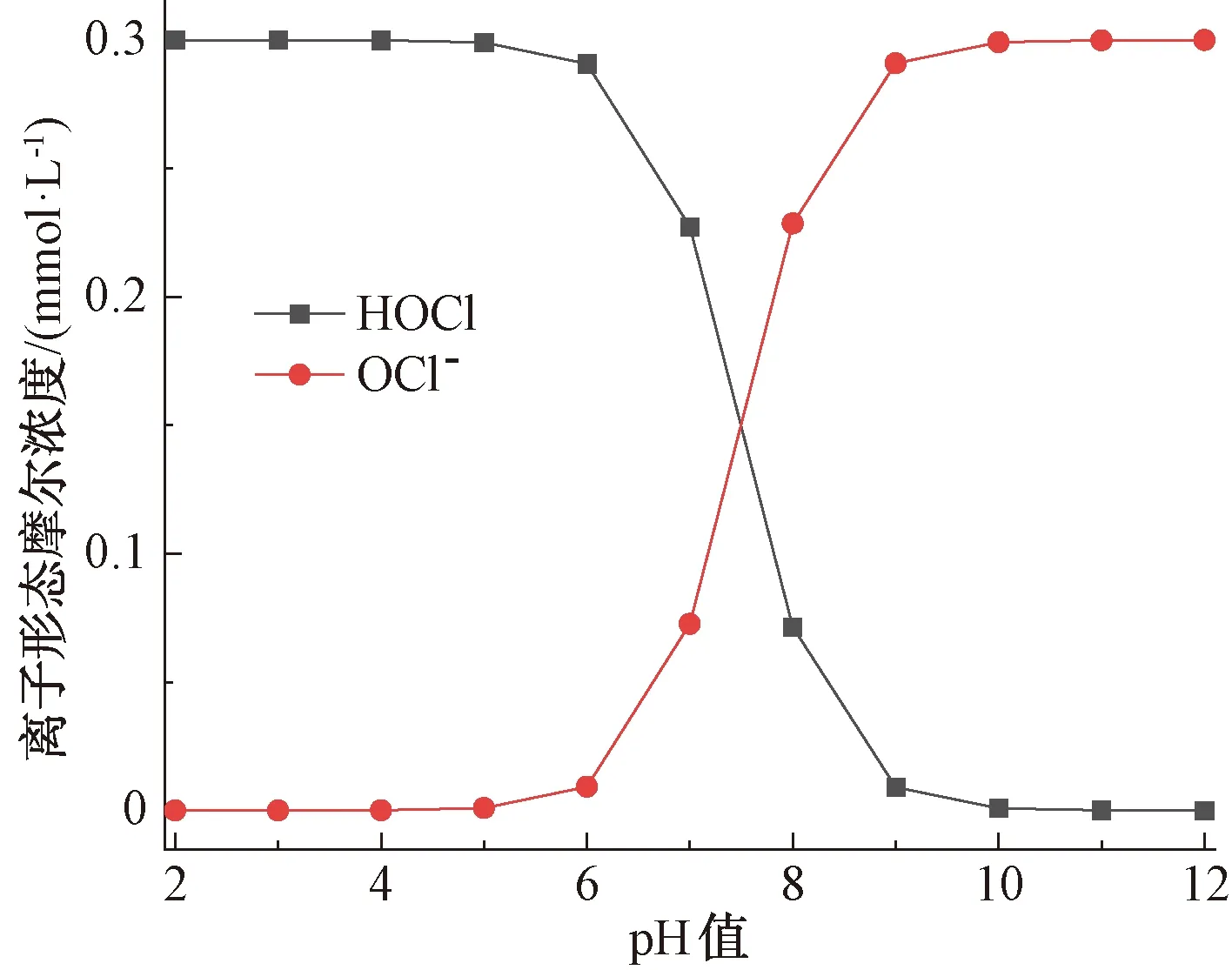
图5 不同pH值下HOCl的形态分布Fig.5 Form Distribution of HOCl under Different pH Values
2.2 紫外活化氯化降解CIP
2.2.1 CIP降解动力学
由于CIP在单独氯化的作用下降解速率慢,因此,本试验通过耦合紫外的方式对其进行强化处理。如图6所示,即随着氯投加量的增加,CIP的降解效率随之变高。在2 min内,紫外/氯作用下的CIP降解率均超过80%,当氯摩尔浓度为400 μmol/L,其降解率高达96.29%,而相同条件下,单独氯作用对CIP的降解效果仅为12.4%,从试验数值上看,紫外/氯条件明显优于单独氯条件对CIP的降解效果。
对CIP在紫外/氯条件下的降解进行动力学分析,ln([CIP]/[CIP]0)与反应时间的反应关系如图6所示,在不同氯投加量下均呈现良好的线性关系(R2>0.91),故可推出:紫外/氯条件对CIP的降解满足准一级反应动力学规律。当氧化剂浓度为0时,由于缺乏足够的活性自由基,CIP降解受到抑制,而随着氯投加量的不断增加,体系中HOCl和OCl-通过UV光解产生HO·和Cl·,促进了CIP的分解[15]。
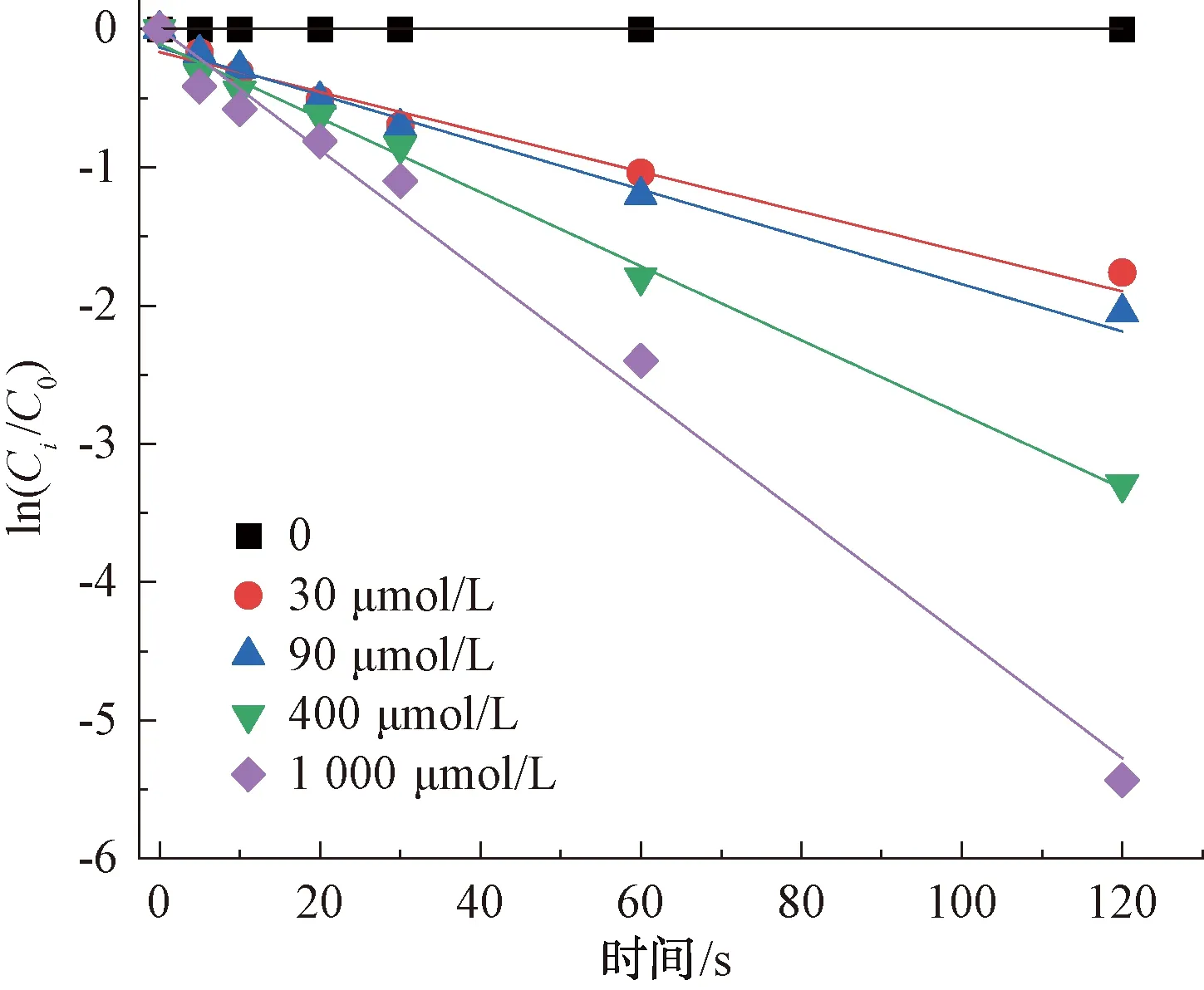
图6 紫外/氯工艺下氯投加量对CIP的降解影响Fig.6 Influence of Chlorine Dosage on Degradation of CIP in UV/Chlorine Process
2.2.2 pH对CIP降解的影响
如图7所示,紫外/氯工艺在不同pH条件下对CIP的降解均符合准一级反应动力学特性,其相关系数R2>0.93。pH在紫外条件下对CIP的降解效果影响较大,其降解率随着pH的增加而增加,在pH值为9时,CIP的降解率最高,达96.61%;pH值为3时降解率最低,仅为76.74%。与单独氯对CIP的降解结果不同,紫外/氯对CIP的降解结果在中性和碱性条件下优于酸性条件。这可能是不同pH条件下活性物质的相对贡献所致[16],这一结果和Deng等[17]报道一致。
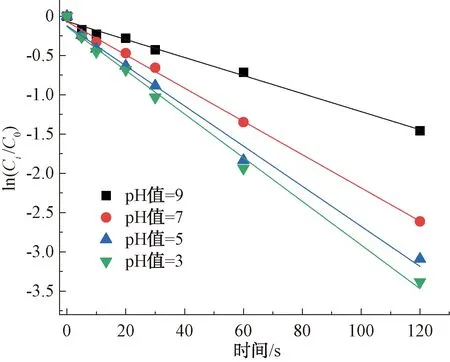
图7 紫外/氯工艺下pH值对CIP的降解影响Fig.7 Influence of pH Value on Degradation of CIP in UV/Chlorine Process
2.2.3 水基质对CIP降解的影响
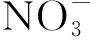
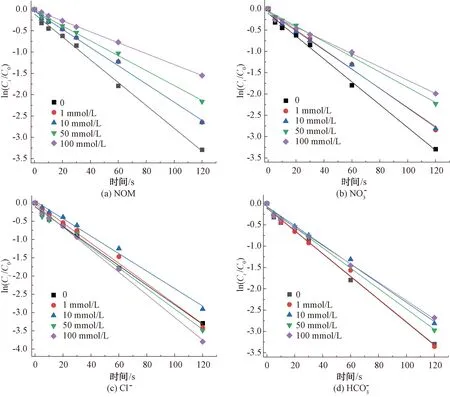
图8 紫外/氯工艺下不同水基质对CIP的降解影响Fig.8 Influence of Water Matrix on Degradation of CIP in UV/Chlorine Process
3 结论
(1)根据3种不同FQs在氯化过程的降解情况及氯投加量的消耗情况,3种不同FQs与氯反应的活泼性:LVF>ENR>CIP,即叔胺甲基哌嗪结构>叔胺乙基哌嗪结构>仲胺哌嗪结构。
(2)pH可以通过改变物质形态(HOCl、OCl-和FQs离子形态)、自由基的产生来影响FQs的降解情况,在单独氯化条件下,对FQs降解影响为pH值为7>pH值为5>pH值为3>pH值为9;而在紫外/氯工艺下对仲胺哌嗪FQs降解影响为在碱性条件下,即pH值为9降解效果最好。