经桡动脉入路血流导向装置治疗颅内动脉瘤:27例单中心应用经验
2022-11-10李张昱段国礼吴一娜路智文黄清海
李张昱 段国礼 吴一娜 路智文 黄清海
经桡动脉入路(transradial approach,TRA)在冠状动脉介入治疗中应用已久[1],近年在神经介入治疗中也越来越受关注[2]。相较于经股动脉入路(transfemoral approach,TFA),TRA被证实可显著降低穿刺点出血并发症和深静脉血栓发生率,缩短住院时间,提高患者舒适度[3-5]。TRA在神经介入中的应用已不局限于动脉瘤栓塞、后循环取栓等范畴。血流导向装置(flow diverter,FD)作为颅内大动脉瘤、串联动脉瘤或夹层动脉瘤的一种有效治疗手段,因在输送和释放过程中可产生较大前向加载力而需更稳固的同轴系统支撑。同时,FD置入术对弓上血管条件和FD释放技术有较高的要求,使TRA行FD置入术在各方面都充满挑战。我们在对血管路径进行充分评估后,开始尝试经近端桡动脉入路(proximal transradial approach,pTRA)和经远端桡动脉入路(distal transradial approach,dTRA)对不同位置和性质的动脉瘤进行FD置入。本研究回顾性纳入2021年2月至8月在本中心采用TRA行FD置入术的连续性病例,分析TRA行FD治疗的可行性和安全性。
1 对象与方法
1.1 对象
回顾性纳入2021年2月至8月于海军军医大学第一附属医院脑血管病中心采用TRA行FD置入术治疗的27例连续性颅内动脉瘤患者并对其临床资料进行分析。本研究所涉及的临床研究方案经海军军医大学第一附属医院伦理委员会审批通过,患者或其家属均知晓并签署诊疗知情同意书。
纳入标准:(1)颅内动脉瘤;(2)经DSA和(或)CT血管成像(CTA)和(或)MR血管成像(MRA)和(或)高分辨率MR诊断为单发或多发囊性动脉瘤、夹层动脉瘤、椎-基底动脉冗长扩张症;(3)采用TRA治疗,桡动脉穿刺且置鞘成功;(4)术中进行FD释放。
排除标准:(1)假性动脉瘤;(2)首选TRA治疗,但桡动脉穿刺或置鞘失败。
1.2 资料收集及分类
收集并记录患者人口学信息、临床资料及手术指标。人口学信息包括性别、年龄;临床资料包括动脉瘤的破裂状态、数量、位置、大小、形态及载瘤动脉情况;手术指标包括导引导管或中间导管到达位置及血管状态、FD释放情况、手术时间。颅内动脉瘤形态分类及大小分型标准见《中国颅内未破裂动脉瘤诊疗指南2021》[6]:按形态分为囊状动脉瘤、梭形动脉瘤和夹层动脉瘤,其中囊状动脉瘤按大小分类(小动脉瘤:动脉瘤直径≤5 mm;中动脉瘤:动脉瘤直径> 5~15 mm;大动脉瘤:动脉瘤直径>15~25 mm;巨大动脉瘤:动脉瘤直径>25 mm)。
1.3 TRA通路建立方案
选择鼻烟壶窝区远端桡动脉进行穿刺[7],穿刺或置鞘失败达3次即更换为近端桡动脉穿刺,置6 F桡动脉鞘。DSA评估主动脉弓及弓上血管解剖特点、病变位置及目标血管条件。TRA通路建立方案:(1)目标血管为右侧椎动脉、右侧颈内动脉、Ⅰ~Ⅱ型弓及“牛”型弓起源的左侧颈内动脉首选右侧TRA治疗;(2)Ⅲ型弓起源的左侧颈内动脉在导引导管或中间导管顺利交换至目标位置且未发生打折情况下继续选择右侧TRA治疗;(3)左侧椎动脉选择左侧TRA治疗;(4)基底动脉根据椎动脉粗细及路径条件,选择粗优势侧椎动脉作为入路。
所有导引导管或中间导管输送均予0.035英寸(0.089 cm)260 cm导丝(Cordis,美国)交换引导,必要时可选择0.018英寸(0.046 cm)300 cm SV-5导丝(Cordis,美国)进行通路稳定性支撑。
1.4 通路导管的选择
根据病变位置及载瘤动脉的路径情况,选择合适通路,如血管比较迂曲且病变较远,选择头端较软的中间导管,实现更好到位;如果血管条件尚可,且动脉瘤位于椎动脉或颈内动脉床突旁段及海绵窦段等,则选用普通导引导管。
1.5 手术指标和并发症的观察及随访
回顾性分析治疗过程中导引导管或中间导管的到达位置、到达后血管状态,以及FD置入过程中导管的稳定性。
观察术后桡动脉并发症,包括穿刺点血肿、顽固性疼痛、桡动脉闭塞性缺血事件。观察围手术期并发症,包括支架内血栓、分支或穿支血管闭塞性缺血事件、抗血小板聚集相关性出血事件。术后3个月门诊随访复查MRA或CTA,术后6个月住院随访复查DSA,评估动脉瘤的显影情况和FD状态。
2 结果
2.1 一般资料
共纳入25例动脉瘤及2例椎-基底动脉冗长扩张症患者(共进行28次FD置入)。12例(44.4%)患者采用dTRA治疗成功,14例(51.9%)采用pTRA治疗成功;1例(3.7%)由dTRA转换为TFA治疗成功。27例中,男12例(44.4%),女15例(55.6%);年龄36~77岁,平均(57±11)岁。25例动脉瘤中,前循环动脉瘤15例[右侧8例(29.6%),左侧7例(25.9%)],椎动脉瘤5例[右侧4例(14.8%),左侧1例(3.7%)],基底动脉瘤4例(14.8%),右侧大脑后动脉瘤1例(3.7%);囊状动脉瘤16例[59.3%;巨大动脉瘤2例(7.4%),大动脉瘤6例(22.2%),中动脉瘤7例(25.9%),小动脉瘤1例(3.7%)],夹层动脉瘤6例(22.2%),多发动脉瘤3例(11.1%)。27例中,未破裂动脉瘤26例(96.3%),破裂动脉瘤1例(3.7%)。
2.2 手术情况
所有患者未出现桡动脉痉挛致通路建立失败情况,无额外使用解痉药物。所有病例未出现目标血管夹层情况。26例(96.3%)TRA治疗成功病例均未使用长鞘系统,共使用了Chaperon(MicroVention,美国)、U-Track[上海微创医疗器械(集团)有限公司]、Navien(Medtronic,美国)、ENVOY(Codman,美国)、ENVOY DA(Codman,美国)、普微森中间导管(南京普微森医疗科技有限公司)、Tethys[加奇生物科技(上海)有限公司]7种导引导管或中间导管,其中18例(69.2%)使用导引导管,8例(30.8%)使用中间导管;累计释放PipelineTMFlex栓塞装置(Medtronic,美国)、Tubridge®血管重建装置[上海微创医疗器械(集团)有限公司]、Repath FD(北京久事神康医疗科技有限公司)、TQL麒麟FD(珠海通桥医疗科技有限公司)4款不同参数的FD共27枚。术中因导引导管或中间导管滑落而中断FD释放操作4次。1例因右侧颈总动脉与右侧锁骨下动脉成锐角而出现导管打折,更换为另一款不同编织的中间导管并以SV-5导丝支撑后得到解决;该例同时因颈内动脉迂曲以及交换导丝在巨大动脉瘤内成袢后的长度消耗,导致支架微导管到位困难而转换为TRA治疗。
所有病例均完全置入FD且充分打开。除1例(3.7%)由dTRA转换为TFA的手术时间大于3 h外, dTRA和pTRA治疗的病例手术时间分别为48.2(29.4,76.0) min和57.5(45.8,87.0) min。见表1。

表1 27例经桡动脉入路行FD置入术患者手术指标情况
2.3 并发症
本组2例(7.4%)患者出现缺血或出血事件,其中1例术后当天出现穿支缺血事件,表现为短暂性失语、肢体运动功能减退,改良Rankin量表评分2分,术后1个月随访,改良Rankin量表评分恢复至0分;1例因合并脑积水于FD术后1周行脑室腹腔分流术,住院期间出现抗血小板聚集相关性穿刺道出血。所有患者未出现穿刺点相关顽固性疼痛、出院前未缓解的穿刺点血肿和症状性桡动脉闭塞。
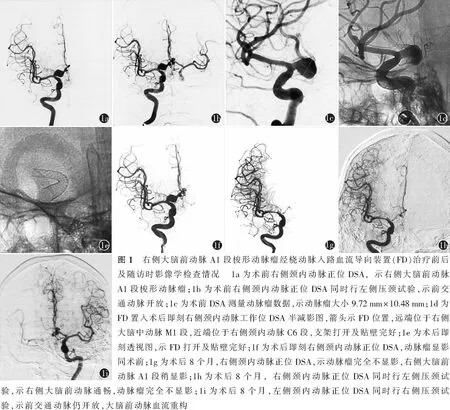
典型病例女,50岁,以“发现右侧大脑前动脉瘤20余天”为主诉于2021年4月18日至海军军医大学第一附属医院脑血管病中心住院。患者2021年3月20日于外院行CTA、DSA检查发现右侧大脑前动脉A1段梭形动脉瘤(图1a),前交通动脉开放(图1b),动脉瘤大小约9.72 mm×10.48 mm(图1c)。入院后神经系统检查未见阳性体征,既往史、个人史无特殊。患者术前口服阿司匹林100 mg +氯吡格雷75 mg连续5 d以预防性抗血小板聚集,术前血栓弹力图达标[花生四烯酸(arachidonic acid,AA)抑制率为100.0%,腺苷二磷酸(adenosine diphosphate,ADP)抑制率为49.7%]。于2021年4月22日经右侧pTRA,使用Chaperon导引导管到位至右侧颈内动脉C2段,顺利置入1枚PipelineTMFlex直径4.25 mm、长度16.00 mm的FD,FD远端位于右侧大脑中动脉M1段,近端位于右侧颈内动脉C6段,完全覆盖大脑前动脉开口(图1d),释放时未出现导引导管后退情况。FD释放时间2.4 min,手术总时间27.0 min。术后即刻透视图,示FD打开及贴壁完好(图1e),术后即刻右侧颈内动脉正位造影,示动脉瘤显影同术前(图1f)。术后8个月随访DSA示动脉瘤完全不显影(图1g,1h),前交通动脉仍开放,大脑前动脉血流重构(图1i)。
3 讨论
3.1 TRA在颅内动脉瘤血管内治疗中的优势
血管内治疗中,TRA对比TFA的优势已被广泛验证,除可降低动脉闭塞和夹层事件发生率,提高患者围手术期舒适度,还可加快住院周转效率和降低医疗费用支出[2-4],甚至作为冠状动脉介入诊疗指南的Ⅰ级推荐[5]。TRA在血管内神经外科手术中应用增加,不仅在颅内动脉瘤栓塞术、颅内外动脉粥样硬化性狭窄支架置入术常规使用,甚至在急性缺血性卒中的机械取栓术都已开展[8]。但常规桡动脉穿刺存在穿刺处血肿、动静脉瘘情况,甚至可发生血肿后继发骨筋膜室综合征等较严重的手术并发症[9];同时,0~33%的闭塞发生率限制了术侧桡动脉的反复使用[10]。自2017年Kiemeneij[11]首次报道经左侧鼻烟壶dTRA行冠状动脉介入诊疗的临床研究后,dTRA治疗开始备受关注。dTRA对比pTRA的主要优势在于术后穿刺点出血发生率[2.44%(11/432)比6.44%(29/435)]和桡动脉闭塞率[1.56%(7/432)比3.78%(17/435)]明显降低(均P<0.05)[12],同时只需更短的术后压迫时间[(104.6±40.6) min比(178.6±68.1) min,P<0.05]及较舒适的患者体验[7]。dTRA虽然在穿刺技术上难度更高,但不失为降低桡动脉穿刺并发症的一种有效方式。选择pTRA或dTRA进行血管内治疗的重要考虑因素即是否需要选择更大口径的血管鞘以稳固通路,虽然诸如7 F Glidesheath Slender (Terumo,日本)的长动脉鞘在血管内治疗中证实不增加桡动脉闭塞率[13],但我们的病例仍未使用大于6 F的桡动脉穿刺血管鞘。随着介入产品迭代,如NeuronMAX 6 F(Penumbra,美国)等大内腔的长动脉鞘的应用,TRA行神经介入治疗的适应证有望拓宽。
3.2 通路建立的方案选择
TRA行神经介入治疗的首要难题是穿刺置管和通路建立。TRA行神经介入的学习曲线显示,一位神经介入医师在完成30~50例手术后,可以获得较高的入路建立成功率和较低的入路更换率[8]。在最早报道TRA行FD置入术的多中心临床研究中,49例患者中10例因为血管过度迂曲或严重桡动脉痉挛而转换为TFA治疗[14]。但在一些困难病例中,如导引导管需要通过与右侧锁骨下动脉成锐角的右侧颈总动脉或非“牛”型弓起源的左侧颈总动脉时,技术上是存在挑战的,通路导管容易在颈总动脉起始段出现打折。虽有报道专门用于TRA策略的6 F Simmons型导引导管到达颈总动脉后可在弓上提供稳固支撑,但对位于Willis环远端或颈内动脉分叉以远的动脉瘤治疗显然是不足够的[15]。因此,对于一些特殊血管,如右侧颈总动脉与右侧锁骨下动脉存在明显夹角且目标血管为右侧颈内动脉、Ⅲ型弓起源的左侧颈内动脉的超选,除了Simmons 2导管和超硬导丝交换外,可能需要使用双导丝技术以避免导管打折或血管损伤等并发症。
3.3 通路导管的选择及其对手术影响
FD拥有较硬的刚度,释放时系统前向加载力大,常需借助外径为2.7 F如XT-27(Stryker,美国)甚至3.0 F如FasTrack[上海微创医疗器械(集团)有限公司]的支架微导管推送。因此,6 F长鞘+中间导管的同轴系统组合可以提供更强支撑力[14]。但目前国内尚无TRA专用6 F长鞘,尽管NeuronMAX 6 F长鞘的参数可能适用部分TRA病例,但易造成桡动脉痉挛及导管输送困难。随着通路产品的迭代,导管的编织特性和线圈特点不断优化,导管的柔软度和抗折性也不断提高。本组病例研究证实Navien、U-Track、普微森和Tethys四款中间导管单独作为通路导管时,均具有良好抗折性,可顺利从右侧TRA完成对不同弓型的双侧前循环动脉瘤的FD置入术。但需注意的是,对于身高和上臂优势的患者,采用TRA治疗前循环远端动脉瘤或巨大动脉瘤可能存在导引导管长度不够或支架微导管难以交换到位等问题,充分评估通路路径是TRA治疗的关键。
本研究证实了TRA FD治疗前、后循环颅内动脉瘤的可行性和安全性。尚无专门适用于TRA的导引导管使这一入路应用的学习需要更久的时间,这可能在专用导引导管和更小的支架输送系统研发后得到改善。随着我们自TFA向TRA应用的逐步过渡,对TRA的适宜解剖结构研究将有助于病例筛选及减少转换为TFA的患者比例。
