中性粒细胞-淋巴细胞比值及其动态变化在人工肝治疗乙肝相关慢加急性肝衰竭预后的评估价值
2022-11-10张雪张亮汤善宏
张雪 张亮 汤善宏
1西南交通大学医学院(成都 610083);2中国人民解放军西部战区总医院消化内科(成都 610083)
慢加急性肝衰竭(acute-on chronic liver failure,ACLF)是一种以器官衰竭和高短期死亡率为主要特征的肝脏功能快速恶化的疾病。乙型肝炎病毒感染是我国ACLF 的主要原因之一[1]。常规内科治疗病死率仍高达50%~80%[2]。肝移植是治疗HBV-ACLF 最有效的方法之一,但肝源的短缺以及免疫排斥等是目前临床面临的巨大难题。因此,人工肝支持(ALSS)治疗是ACLF 患者最常用的治疗手段,研究表明经人工肝治疗患者生存率可达65%~85%[3-4]。人工肝治疗主要基于肝脏强大的再生能力,因而人工肝治疗患者的预后应从肝功能及肝再生能力两方面考量。课题组前期研究发现,肝再生指标甲胎蛋白(AFP)可作为乙肝相关慢加急性肝衰竭患者预后的可靠预后指标[5],结合AFP 创建HBV-ACLF患者预后模型,对患者预后具有良好的预测效能[6]。并且血清AFP 可作为HBV-ACLF 患者人工肝术后生存情况的预测因子,高AFP 组预后更好[7]。
ACLF 病情凶险,短期死亡率高,预后判断至关重要。目前有较多的预后评分系统均可有效预测肝衰竭患者预后,但这些评分系统都计算繁琐。因此,临床需要一些更为简易的指标来预测肝衰竭患者的预后。近年来的多项研究[8-10]表明中性粒细胞-淋巴细胞比值(NLR)可作为肝癌患者术后有效的预后因子。NLR 是乙肝相关肝硬化急性失代偿期和慢加急性肝衰竭患者死亡率的生物标志物[11-12]。目前,NLR 及其动态变化作为ALSS 治疗HBV-ACLF 患者短期死亡率预测指标的价值尚未见报道。本研究旨在探讨NLR 及其动态变化在ALSS 治疗HBV-ACLF 患者短期生存预后中的评估价值。
1 对象与方法
1.1 研究对象
1.1.1 纳入标准符合《肝衰竭诊治指南(2018年版)》[13]中慢加急性肝衰竭的诊断标准:在慢性肝病基础上,由各种诱因引起,以急性黄疸加深、凝血功能障碍为肝衰竭表现的综合征,可合并肝性脑病、腹水、电解质紊乱、感染、肝肾综合征、肝肺综合征等并发症,以及肝外器官功能衰竭。患者黄疸迅速加深,血清TBiL ≥10 ULN 或每日上升≥17.1 μmol/L;有出血表现,PTA ≤40%(或INR ≥1.5)。
1.1.2 排除标准(1)合并酒精性肝病;(2)年龄>75 岁或<18 岁者;(3)合并其他类型肝炎病毒或EB 病毒感染;(4)妊娠;(5)合并其他全身严重疾病或营养不良者;(6)确诊或疑诊恶性肿瘤者;(7)缺乏相关生化学检查。所有入组患者均给予常规内科综合治疗以及人工肝支持治疗。
1.2 一般资料本研究一共纳入106 例患者,其中男性88 例(83.02%),女性18 例(16.98%),中位年龄为48 岁(41.75,56)。按照患者90 d 的随访情况,分为生存组(88 例,83.02%)和死亡组(18 例,16.98%)。生存组年龄、总胆红素、凝血酶原时间(prothrombin time,PT)、中性粒细胞计数、NLR 均低于死亡组(P<0.05)。生存组血清白蛋白、前白蛋白、红细胞、血小板计数均高于死亡组(P<0.05)。生存组MELD、MELD-Na 和iMELD 评分均低于死亡组(P<0.05,表1)。
1.3 研究方法本研究选取西部战区总医院消化内科2018年1月至2021年12月共132 例接受人工肝支持治疗的乙肝慢加急性肝衰竭住院患者。根据纳排标准排除患者32 例,其中包括合并酒精性肝病3 例,药物性肝损伤1 例,合并其他类型肝炎病毒感染8 例,合并EB 病毒感染4 例,疑诊或确诊为恶性肿瘤8 例,合并寄生虫感染1 例,失访或患者资料不全7 例,最终入组患者106 例,按照患者90 d 的随访情况将患者分为其分为生存组和死亡组。回顾性收集患者临床资料和实验室数据,比较组间差异。
1.4 伦理审查本研究遵循世界医学会赫尔辛基宣言,经中国人民解放军西部战区总医院伦理委员会审查通过,批号:2020ky005。
1.5 统计学方法数据处理与分析采用SPSS 26.0软件进行。非正态分布的计量资料用M(P25,P75)表示,采用Mann-WhitneyU检验进行组间比较。计数资料采用绝对数和百分数描述,采用χ2检验进行组间比较。采用二元logistic 回归分析评价90 d 死亡的独立危险因素。相关性检验采用Spearman 相关性检验。使用受试者工作特性曲线(receiver operating characteristic curve,ROC curve)和Kaplan-Meier 生存分析评价淋巴细胞与淋巴细胞比率(NLR)对人工肝术后HBV-ACLF 患者90 d死亡率的预测价值。P<0.05 表示差异有统计学意义。
2 结果
2.1 HBV-ACLF 患者90 d死亡的独立危险因素将表1 中两组之间差异有统计学意义的参数纳入二元logistic 回归分析,结果显示年龄、血清白蛋白、前白蛋白、总胆红素、红细胞、中性粒细胞计数、NLR 是人工肝治疗后HBV-ACLF 患者90 d 死亡的独立危险因素(表2)。
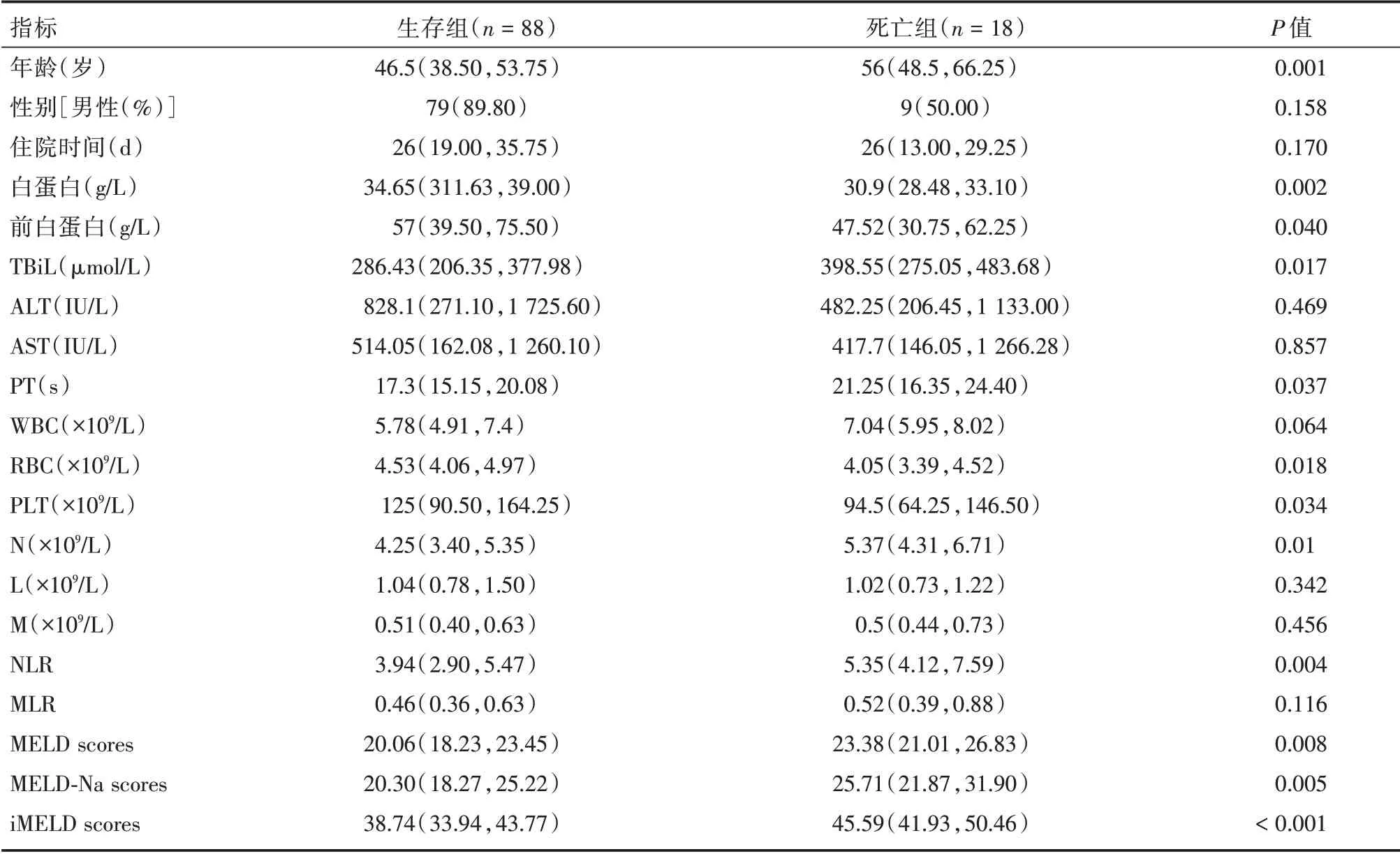
表1 纳入患者的基线特征与观察指标Tab.1 Baseline characteristics and observation indexes of included patientsM(P25,P75)

表2 人工肝治疗后HBV-ACLF 患者90 d 死亡的独立危险因素Tab.2 Independent risk factors for 90-day mortality of HBV-ACLF patients after ALSS
2.2 基线NLR 水平对HBV-ACLF 患者90 d 死亡率的预测价值Spearman 相关性分析显示,基线NLR 水平与MELD 评分(r= 0.374,P<0.001),MELD-Na 评分(r= 0.385,P<0.001),iMELD 评分(r=0.434,P<0.001)呈正相关(图1)。ROC 结果显示,基线NLR 用于判断人工肝术后HBV-ACLF患者预后的曲线下面积(area under the curve,AUC)为0.720(95%CI:0.567~0.873,P= 0.017,图2)。Youden 指数确定基线NLR 的最佳临界值为5.09,灵敏度为71.4%,特异度为71.4%。
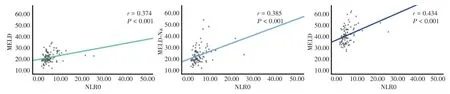
图1 基线NLR 与预后模型MELD 评分、MELD-Na 评分和iMELD 评分的相关性Fig.1 Correlation of baseline NLR with MELD score,MELD-Na score and iMELD score of prognostic model
2.3 人工肝支持治疗过程中NLR 及其动态变化对HBV-ACLF 患者90 d 死亡率的预测价值入院时、接受ALSS 治疗术前1 d、术后3 d患者的NLR 水平逐渐降低,且生存组与死亡组NLR 动态变化差异有统计学意义(P<0.05,表3)。ROC 结果显示,ALSS 术前1 d 和术后3 d 的AUC 分别为0.712 和0.72,最佳临界值分别为3.42、3.73,灵敏度分别为78.6%、78.6%,特异度分别为57.1%、62.9%(图2,表4)。按照基线、ALSS 术前1 d、术后3 d 的NLR最佳临界值进行分层后分别作Kaplan-Meier 生存分析,结果显示分层后高NLR 组患者生存时间显著高于低NLR 组(P<0.05,图3)。

图3 按NLR 分层的90 d 生存曲线分析Fig.3 Analysis of 90-day survival curve by NLR stratification

表3 生存组与死亡组NLR 水平动态变化Tab.3 Dynamic changes of NLR levels in survival group and death group M(P25,P75)

表4 NLR 及其动态变化对人工肝术后HBV-ACLF 预后的评估价值Tab.4 The value of NLR and its dynamic changes in the prognosis of HBV-ACLF after artificial liver surgery
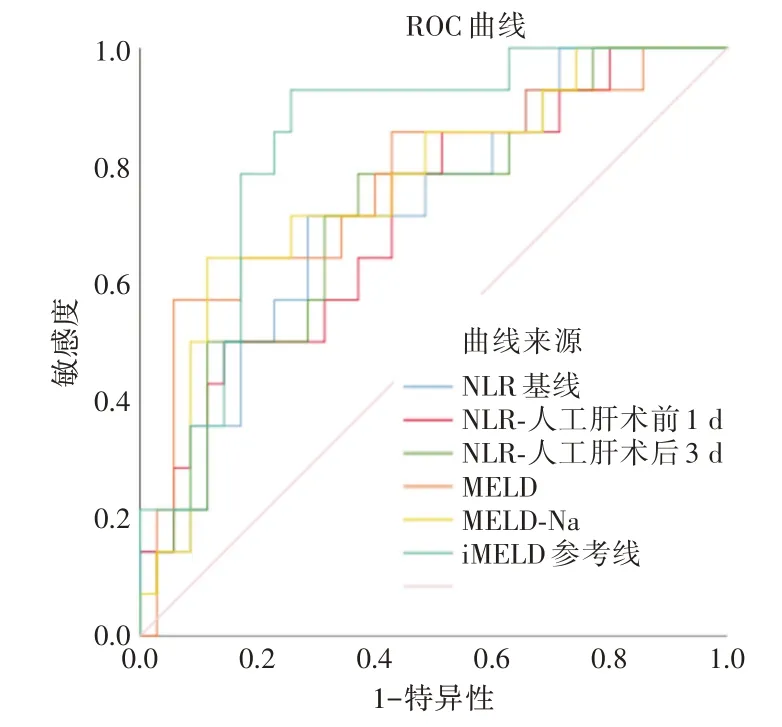
图2 基线NLR 及其动态变化、MELD、MELD-Na、iMELD预测人工肝术后HBV-ACLF 患者预后的ROC 曲线Fig.2 ROC curve of baseline NLR and its dynamic changes,MELD,MELD-Na,and iMELD for predicting the prognosis of HBV-ACLF patients after ALSS
3 讨论
人工肝支持治疗作为目前HBV-ACLF 最常用且有效的治疗方式,对患者的预后判断至关重要。ACLF 患者疾病的发生发展过程常常伴随全身炎症反应的出现,并且与疾病严重程度及患者预后密切相关[14]。炎症指标NLR 在临床中容易获得且计算简便,中性粒细胞增加反映系统炎症恶化,淋巴细胞降低反映机体应激加剧,而NLR 可以综合两者的优点,更好地反映机体炎症与应激程度。但NLR 在疾病进展过程中动态变化鲜有研究。本研究发现,血清NLR 水平是ALSS 术后HBV-ACLF患者90 d 死亡的独立危险因素,NLR 水平越高,患者预后越差。NLR 与目前广泛用于ACLF 患者病情严重程度评估的MELD 及其衍生评分系统呈正相关,ROC 曲线显示NLR 对患者预后具有良好的检测效能。ALSS 治疗术前1 d 和术后3 d NLR的ROC 曲线下面积分别为0.712 和0.72 ,可作为ALSS 疗效判断的依据,患者行人工肝治疗前1 d与术后3 d NLR 的变化率(ΔNLR)在生存组与死亡组之间具有差异有统计学意义,动态监测NLR 水平变化于患者病情判断更为有益。全身炎症反应在ACLF疾病进展中具有重要作用,在炎症应激下,中性粒细胞、淋巴细胞等通过分泌细胞因子与实质细胞和非实质细胞相互作用,促进疾病的进展[15]。本研究发现,生存组与死亡组基线中性粒细胞水平差异具有统计学意义,生存组中性粒细胞计数显著低于死亡组。这可能与ACLF疾病进程中肝损伤加重有关。
综上,通过对106 例ALSS 术后HBV-ACLF 患者的分析,笔者认为NLR 可作HBV-ACLF 患者预后判断的潜在指标之一,其计算简便,临床易获取,且预测效能与传统MELD、MELD-Na、iMELD 评分相去不远,与传统评分系统联合应用或可增加其检验效能,同时解决了传统评分系统所不能反映的免疫过程。NLR 动态检测对于判断患者人工肝治疗疗效及是否继续行人工肝治疗具有重要意义。但本研究尚存局限,即回顾性研究且受限于单一中心的小样本数据,可能存在偏倚,仍需要大样本多中心前瞻性研究来进一步验证。
