MiR-216a调节JAK2/STAT3通路抑制卵巢癌细胞的转移和上皮-间质转化
2022-11-10吴新华顾晓荔胡滨
吴新华 顾晓荔 胡滨
郑州大学第二附属医院妇产科(郑州 450000)
卵巢癌(ovarian cancer,OC)是致死率最高的妇科恶性肿瘤[1-2]。由于缺乏明显临床症状和诊断生物标志物,大多数卵巢癌患者在确诊时就已处于疾病晚期,导致卵巢癌预后不佳[3-4]。因此,鉴定新的生物标志物并阐明卵巢癌发生发展的分子机制至关重要。微小RNA-216a(microRNA-216a,miR-216a)是一种与癌症相关的miRNA,已被发现在乳腺癌[5]、胃癌[6]中下调,表明miR-216a具有肿瘤抑制作用。然而,有研究证实,miR-216a在卵巢癌组织和细胞中高表达,在卵巢癌中具有致癌作用[7],与其他癌细胞中研究不同。因此,有必要对miR-216a 在卵巢癌中的具体生物学功能及其潜在的机制进行探究。据报道,Janus 激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)在多种癌症中发挥重要作用,该通路的激活可增加肿瘤的转移能力和上皮-间质转化(epithelial-mesenchymal transition,EMT)[8]。LIU 等[9]研究表明,抑制JAK2/STAT3 信号通路可抑制EMT 减弱卵巢癌细胞的增殖、迁移和侵袭。EMT 作为肿瘤进展的关键调节剂,参与肿瘤侵袭、扩散等过程[10]。然而,在卵巢癌中miR-216a 是否可通过调节JAK2/STAT3 影响细胞的转移和EMT 仍不明晰。本研究通过表达miR-216a,探索其对卵巢癌细胞的迁移和侵袭的影响以及潜在的作用机制,为卵巢癌的临床治疗提供新的参考依据。
1 材料与方法
1.1 材料
1.1.1 人体组织样本和细胞收集2019年1月至2021年1月期间来本院就诊的20 例卵巢癌患者卵巢癌组织和癌旁正常组织(距离癌组织至少5 cm)样本,术中采集组织后迅速于液氮中冷冻后于-80 ℃冰箱中保存备用。所有患者及其家属均签署知情同意书。本研究经本院伦理委员会批准。
人卵巢癌细胞系A2780(YS018C)、OVCAR3(YS3615C)、SKOV3(YS3110C)、3AO(YS908C)以及人卵巢上皮细胞HOSEpiC(YS1695C)均购自上海雅吉生物科技有限公司。
1.1.2 主要试剂与仪器DMEM 培养基、青/链霉素购自美国Gibco;TRIzol 试剂购自美国Invitrogen;TaqManTMmicroRNA 逆转录试剂盒、TaqManTMmicroRNA 检测试剂盒购自美国Thermo;RIPA 裂解缓冲液、BCA 试剂盒购自江苏Beyotime;一抗E-cadherin、N-cadherin、Vinmentin、JAK2、STAT3、Snalil、Twist、GAPDH 均购自英国Abcam;ECL 发光液购自北京BIOSIC;双荧光素酶报告基因检测试剂盒购自上海钰博生物科技。
Varioskan LUX多功能酶标仪购自美国Thermo;LightCycler 480 荧光定量PCR 仪购自上海Roche;Gel Doc XR 凝胶成像系统购自美国Bio-Rad;EclipseTi-E 激光共聚焦荧光显微镜购自美国Nikon;CX43 显微镜购自美国OLYMPUS。
1.2 方法
1.2.1 细胞培养与分组卵巢癌细胞系(A2780、OVCAR3、SKOV3、3AO)以及人卵巢上皮细胞HOSEpiC 在补充有10%胎牛血清和1%青/链霉素的DMEM 培养基中培养。将细胞维持在37 ℃、5%CO2的湿润气氛中,待细胞生长融合度至70%左右时进行传代培养,取处于对数期且生长良好的第三代后的细胞进行后续研究。
取对数期生长的SKOV3 细胞,依次分为:正常对照(Control)组,miR-NC 对照(miR-NC)组、miR-216a 过表达(miR-216a)组、miR-216a 过表达和JAK2 过表达空载对照(miR-216a+EV)组、miR-216a 和JAK2 过表达(miR-216a+JAK2)组。转染参照Lipofectamine 2000 转染试剂盒方法转染对应的质粒和寡核苷酸。miR-216a 模拟物(miR-216a)及其阴性对照miR-NC、JAK2 过表达(JAK2)及其空载对照(EV)均购自广州Genecopoeia 设计合成。
1.2.2 QRT-PCR 检测组织和细胞中miR-216a 表达水平根据TRIzol 试剂制造商说明书提取组织和细胞总RNA。遵循逆转录试剂盒说明书方法制备cDNA,使用microRNA检测试剂盒对miR-216a进行PCR 扩增和定量。U6 作为内参基因,使用2-ΔΔct计算miR-216a 的相对表达水平。
miR-216a 引物序列:5'-ACACACUUACCCGUA-GAGAUUCUA-3',反向引物使用试剂盒中通用的引物。U6 引物序列:5'-CTCGCTTCGGCAGCACA-3',5'-ACGCTTCACGAATTTGCGT-3'。
1.2.3 Transwell 实验检测各组SKOV3 细胞的迁移和侵袭能力在实验前,先使用Matrigel 包被Transwell 小室底部膜的上室面,干燥备用。将按照上述方法培养的各组SKOV3 细胞使用无血清的培养基重悬,形成5 × 105个/mL 的细胞悬浮液,吸取200 mL 悬浮液于含Matrigel 的Transwell 小室上室中,下室中添加600 mL 正常培养基。按常规方法培养48 h 后,使用甲醇固定30 min 后,添加0.1%结晶紫染色20 min,同时使用棉签轻轻拭去上层未迁移细胞,使用PBS 轻洗3 遍后在倒置显微镜中拍照记录,随机选择五个视野,计数。
细胞迁移实验需使用无Matrigel 包被Transwell 小室,其余步骤同上。
1.2.4 免疫印迹(Western blot)检测各组SKOV3细胞中EMT 和JAK2/STAT3 通路相关的蛋白水平变化使用RIPA 裂解缓冲液裂解按上述方法培养的各组SKOV3 细胞以获得总蛋白提取物,并使用BCA 试剂盒测量蛋白质浓度。通过SDSPAGE 电泳分离总蛋白提取物(600 mg/泳道)后转移到PVDF 膜上,添加5%牛血清白蛋白封闭2 h,将蛋白质与一抗(稀释浓度1∶1 000):E-cadherin、N-cadherin、Vinmentin、JAK2、STAT3、Slug、Twist 和GAPDH 在4 ℃下过夜孵育,隔天使用HRP 标记的二抗孵育2 h。使用增强型的ECL 发光液将蛋白可视化。并使用凝胶成像系统检测信号并拍照记录,通过Image J 软件分析各组蛋白灰度值。目的蛋白相对表达量=目的蛋白灰度值/内参灰度值。
1.2.5 免疫荧光检测各组SKOV3 细胞中E-cadherin、N-cadherin 和Vinmentin 表达水平将按照上述方法培养的各组SKOV3 细胞接种在细胞爬片上,待爬满细胞后,使用PBS 浸洗3 次。在室温下使用4%多聚甲醛固定后使用0.1% triton X-100 透化,添加山羊血清室温封闭30 min,吸去封闭液后将细胞与一抗(稀释比例1∶500):E-cadherin、Ncadherin 和Vinmentin 在4 ℃下过夜孵育。后将爬片与FITC 荧光二抗在室温下孵育1 h,细胞核在室温下使用DAPI 染色10 min。使用激光扫描显微镜捕获共聚焦荧光图像。
1.2.6 双荧光素酶检测miR-216a 与JAK2 靶向关系经TargetScan 网站预测,miR-216a 与JAK2 3'-UTR 存在相互作用位点,将JAK2 3'-UTR 野生型(WT)或突变型(MUT)连接到萤火虫荧光素酶报告载体上,构成JAK2 WT 或JAK2 MUT。将JAK2 WT 或JAK2 MUT 与miR-NC 或miR-216a 共同转染至SKOV3 细胞,共同孵育48 h 后,经双荧光素酶报告基因检测试剂盒检测相对荧光素酶活性。
1.3 统计学方法所有研究均进行3次独立重复。使用SPSS 软件分析实验数据,用平均值±标准差的方式来表示,采用t检验分析两组差异,使用单因素方差分析多组间差异。P<0.05 认为差异有统计学意义。
2 结果
2.1 miR-216a 在卵巢癌组织和SKOV3 细胞中的表达情况图1A 结果显示,与癌旁正常组织相比,miR-216a 表达水平在卵巢癌组织中的表达降低(t=80.63,P<0.05)。图1B 结果显示,与HOSEpiC细胞相比,卵巢癌细胞系中miR-216a 表达均明显降低(F= 142.089,P<0.05);且在SKOV3 细胞中表达最低,故后续选择SKOV3 细胞作为研究对象。

图1 qRT-PCR 检测miR-216a 在卵巢癌组织和细胞中的表达情况Fig.1 qRT-PCR detection of miR-216a expression in OC tissues and cells
2.2 miR-216a 过表达促进SKOV3 细胞迁移和侵袭5 组SKOV3 细胞中miR-216a 表达、迁移和侵袭细胞数量差异均有统计学意义(F= 93.172、199.616、185.908,均P<0.05)。与miR-NC 组相比,miR-216a 组SKOV3 细胞中miR-216a 表达升高,迁移和侵袭数量减少(P<0.05);与miR-216a+EV 组比,miR-216a+JAK2 组SKOV3 细胞中表达变化无统计学意义(P>0.05),而迁移和侵袭数量增多(P<0.05)。见图2。

图2 miR-216a 过表达对SKOV3 细胞迁移和侵袭的影响Fig.2 Effects of miR-216a overexpression on migration and invasion of SKOV3 cells
2.3 miR-216a 过表达抑制SKOV3 细胞的EMT5 组SKOV3 细胞中E-cadherin、N-cadherin 和Vinmentin 蛋白水平差异均有统计学意义(F=49.612、66.773、102.396,均P<0.05)。与miR-NC 组相比,miR-216a 组SKOV3 细胞中E-cadherin 蛋白水平增高,N-cadherin 和Vinmentin 蛋白水平降低(P<0.05);与miR-216a+EV 组相比,miR-216a+JAK2 组SKOV3 细胞中E-cadherin 蛋白水平降低,N-cadherin 和Vinmentin 蛋白水平增高(P<0.05)。免疫荧光进一步证实了以上各组SKOV3 细胞中E-cadherin、N-cadherin 和Vinmentin 蛋白水平变化结果(图3)。
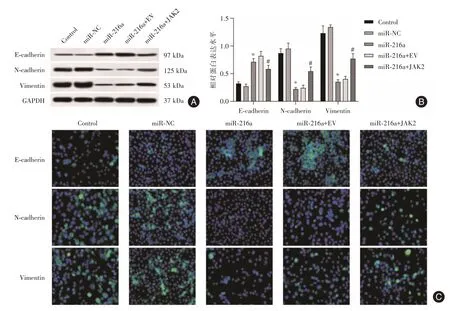
图3 miR-216a 过表达对SKOV3 细胞中E-cadherin、N-cadherin 和Vimentin 水平的影响Fig.3 Effects of miR-216a overexpression on the levels of E-cadherin,N-cadherin and Vimentin in SKOV3 cells
2.4 miR-216a 过表达抑制SKOV3 细胞中JAK2/STAT3通路激活5组SKOV3细胞中JAK2、STAT3、Slug 和Twist 蛋白水平差异均有统计学意义(F=113.889、63.837、89.688、74.773,均P<0.05)。与miR-NC 组相比,miR-216a 组SKOV3 细胞中JAK2、STAT3、Slug 和Twist 蛋白水平均降低(P<0.05);与miR-216a+EV 组比,miR-216a+JAK2 组SKOV3 细胞中JAK2、STAT3、Slug 和Twist 蛋白水平均增高(P<0.05,图4)。

图4 miR-216a 过表达对JAK2、STAT3、Slug 和Twist 蛋白水平的影响Fig.4 Effects of miR-216a overexpression on the protein levels of JAK2,STAT3,Slug and Twist
2.5 双荧光素酶实验检测SKOV3 细胞中miR-216a 与JAK2 靶向关系生物学预测,JAK2 3'-UTR 存在与miR-216a 相互作用的靶向结合位点(图5A),经双荧光素酶实验证实,与miR-NC 组相比,miR-216a 组SKOV3 细胞中转染JAK2 WT 可显著降低荧光素酶活性(t= 16.333,P<0.05),而转染JAK2 MUT 则对荧光素酶活性的影响差异无统计学意义(t=16.333,P=0.332,图5B)。

图5 miR-216a 与JAK2 靶向关系验证Fig.5 Validation of the targeting relationship between miR-216a and JAK2
3 讨论
miRNAs 是一组长度为20-22 个核苷酸的非编码小RNA,可在转录后调控靶基因的表达,并在调节组织特异性蛋白表达方面发挥着重要作用[11]。越来越多的研究证实,异常miRNA 表达通过充当致癌基因或肿瘤抑制因子而与人类癌症的发展和进展直接相关。此外,miRNAs 已被公认为是最有潜力的生物标志物和包括卵巢癌在内的人类癌症的治疗靶点[12-13]。miR-216a 已被发现是人类恶性肿瘤的积极参与者[14-15]。本研究结果显示,miR-216a 在卵巢癌组织和细胞中显著低表达,且在SKOV3 细胞中表达最低,表明miR-216a 在卵巢癌中具有抑癌作用。有研究发现,miR-216a 的表达在胃癌组织和细胞系中受到抑制,低表达的miR-216a 与胃癌患者的恶性临床特征和不良预后相关,且miR-216a 可能通过抑制JAK2/STAT3 通路的激活来抑制胃癌细胞的迁移、侵袭和EMT 过程[16]。然而,在肝细胞癌中,A1BG-AS1 通过直接吸附竞争性内源性miR-216a 表达抑制肿瘤细胞迁移和侵袭,而过表达miR-216a 可逆转A1BG-AS1 对癌细胞的影响,说明miR-216a 在肝细胞癌中具有致癌作用[17]。本结果与之相一致。为了进一步明确miR-216a在卵巢癌细胞中的具体生物学功能,进一步实验证实过表达miR-216a 抑制迁移、侵袭,且表现出高E-cadherin 蛋白水平,低N-cadherin 和Vinmentin蛋白水平。有研究表明,EMT 是上皮细胞获得间充质特征从而获得转移能力的过程,与肿瘤的发生、转移及治疗抵抗有关[18]。以往研究发现,EMT过程发生的标志是高N-cadherin 和Vinmentin 水平,低E-cadherin 水平[19-20]。结合本研究结果表明miR-216a 过表达抑制卵巢癌细胞的迁移、侵袭和EMT 过程,暗示miR-216a 很有可能作为治疗卵巢癌的潜在生物标志物。然而,本研究中发现的miR-216a 在卵巢癌中的功能与现有研究结果并不相同[7],推测其可能有多方面原因,其一:选用的卵巢癌患者组织具有差异,循环中的miRNA 水平不仅与肿瘤类型有关,还可能受到慢性疾病、炎症等的影响;其二,单个miRNA 可以靶向调控上百个mRNA,根据不同靶基因的能力其表达趋势可能不同;其三,miRNA 即使靶向相同的基因,在不同的转移阶段也会具有不同的结果。综上,有必要对miR-216a 在卵巢癌中的作用机制进行深入探究。
本研究经生物信息学预测发现,JAK2 可能是miR-216a 的靶标基因。经双荧光素酶结果证实,miR-216a 与JAK2 存在相互作用。另外,上调miR-216a 可显著降低JAK2 蛋白水平,表明miR-216a 对JAK2 具有负向调控作用。据报道,JAK2 是蛋白酪氨酸激酶JAK 家族的成员之一,在肿瘤细胞中发挥着多种功能[21]。先前的研究表明,JAK2 在各种类型的癌症中通过调节STAT3 发挥致癌基因的作用[22]。有研究表明,在结直肠癌细胞中,JAK2/STAT3 信号被激活后,癌细胞的增殖能力提高[23];在食管鳞状癌细胞中阻断JAK2/STAT3 信号,可明显抑制肿瘤细胞的迁移和侵袭[24]。此外,已有研究证实,JAK2/STAT3 通路在卵巢癌细胞的转移和EMT中起着关键作用[25]。结果显示,上调miR-216a表达可抑制JAK2、STAT3 蛋白水平及其下游靶标Slug 和Twist 蛋白表达。研究显示,转录因子Slug和Twist 是人类卵巢癌中EMT 过程的关键调节因子[26]。因此,笔者假设miR-216a 通过抑制JAK2 表达抑制JAK2/STAT3 通路激活进而抑制卵巢癌细胞的EMT 过程和转移。进一步研究表明,JAK2 过表达部分逆转上调miR-216a 对卵巢癌细胞的抗转移作用,具有增强迁移、侵袭和EMT 进展的作用,这些数据有利地支持了上述假设。
综上,本研究证明了miR-216a 的表达在卵巢癌组织中下调,miR-216a 可能通过抑制JAK2/STAT3 通路抑制卵巢癌细胞的迁移、侵袭和EMT。这些发现为卵巢癌的靶向治疗提供了新的观点。但本研究未在其他卵巢癌细胞系和动物模型中进行同步验证,后续仍需更全面的探究以完善miR-216a 在卵巢癌中的作用机制,以期为卵巢癌的治疗提供新的思路。
