脑内组胺H3受体反向激动剂必妥利生:促醒及治疗睡眠和认知障碍新疗法
2022-11-09林建生缪朝玉
赵 妍,王 治,林建生,缪朝玉
(1.海军军医大学药学系药理学教研室,上海 200433;2.法国国家健康与医学研究院,里昂大学大脑清醒机制研究室,里昂 69675)
睡眠问题困扰大于1/3普通人群,睡眠医学近年已发展为独立临床学科,我国刚起步但进展很快。目前睡眠障碍疗法屈指可数,能改善清醒、治疗嗜睡的莫达非尼在我国于2017年才获准进入临床,属于精神类管控药物。本文介绍和综述新疗法脑内组胺H3受体反向激动剂必妥利生的促醒机制、临床应用和最新研究进展。
1 临床前药理学研究
位于下丘脑后部的组胺神经元通过广泛的解剖投射、清醒时相的特异性紧张放电及突触后的兴奋和易化作用构成脑内重要促醒系统[1-3]。上世纪80年代组胺H3受体的发现及稍后受体基因的克隆,有力推动了中枢组胺药理学的发展。H3受体为G蛋白偶联受体,包括自身受体(autoreceptor)和异身受体(heteroreceptor),组胺(histamine,HA)通过自身受体的负反馈作用调节自身合成、释放及神经元的活动;也通过异身受体调节脑内其它神经递质的释放,包括乙酰胆碱(acetylcholine,ACh)、多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,NE)、5-羟色胺(serotonin,5-HT)和某些神经肽(Fig 2)。H3受体分布于与调控睡眠-清醒、注意力、学习记忆等相关脑区,如下丘脑后部、丘脑、大脑皮层、海马和纹状体等[1-3]。1990年Lin等[4]研究第一代H3受体配体对猫的睡眠-清醒效应后提出组胺H3受体能作为治疗睡眠-清醒障碍靶标的理论。此后,众多基础和临床研究聚焦于研制作用强、选择性高、无毒性及适合临床的H3受体拮抗剂/反向激动剂。然而,全球多个机构多年研制并在动物实验中有突出表型的H3受体配体[1-3],最终未能进入临床。直到2008年,Bioprojet集团合成了H3受体反向激动剂Pitolisant,Lin等在正常猫和小鼠中发现和鉴定了Pitolisant的促醒作用[2-3,5],继而成功用于睡眠障碍动物模型及患者[6],终于使H3受体靶标从理论概念转化为临床应用[2,3,7]。Pitolisant化学名为1-{3-[3-(4-氯苯基)丙氧基]丙基}哌啶盐酸盐(结构式如Fig 1),当初Bioprojet的编号为BF2.649,临床测试时命名为Tiprolisant[6],欧盟批准上市时定名为Pitolisant,国内曾根据Tiprolisant暂译为替洛利生,我们认为根据最终命名译为必妥利生才恰当。此外,必妥利生针对发作性睡病和阻塞性睡眠呼吸暂停相关的白天过度嗜睡(EDS)的专用剂型商品名分别为Wakix®和Ozawade®。目前临床应用的是必妥利生盐酸盐片剂。
Fig 1 Schematic illustration showing 2D and 3D chemical structure of pitolisant hydrochloride
必妥利生对中枢组胺H3受体具有高选择性,而对H1、H2和H4受体亲和力低。前期研究发现:必妥利生通过反转H3自身受体的组成活性,即H3受体的强力“刹车”作用增强HA释放,从而促进皮层激活,发挥促醒作用[2-6]。此外,必妥利生增加NE释放,是缓解发作性睡病患者猝倒症状(Cataplexy)的可能机制[6-8]。在食欲素基因敲除的发作性睡病小鼠模型中,尽管治疗EDS的一线药物莫达非尼改善清醒,但猝倒和发作性异相睡眠未能药到病除。相反,必妥利生不仅增强清醒,还抑制猝倒和发作性异相睡眠,与莫达非尼联用还具有显著协同作用。这项概念验证研究更发现了必妥利生明显改善发作性睡病成人患者的EDS[2,6],开创了其抗发作性睡病治疗的先河。
清醒状态是大脑进行所有高级认知活动的基础。动物实验发现与莫达非尼和精神兴奋剂如安非他命不同,只有必妥利生的促醒效应伴随有高级神经活动(注意力、警觉和学习记忆等)所必须的皮层快节律增强[1-2,5]。此外,必妥利生还通过H3异身受体调控其他与认知相关的神经递质(如ACh)的释放(Fig 2)。值得一提的是,近年研究揭示必妥利生与sigma-1受体的亲和力接近H3受体,目前已知sigma-1受体与学习和记忆等认知活动相关[9]。这些提示必妥利生不仅促醒,还能改善和增强警觉性和认知活动,而且,在动物模型和患者身上都观察到促认知效应[2,5,10]。
此外,近年报道[11]莫达非尼可通过缝隙连接引发抗发作性睡病作用,本机制是否参与必妥利生的促醒或其他药理作用尚待研究。
2 药代动力学特点
必妥利生的药代动力学呈线性关系,口服后吸收迅速,约3 h达血浆峰浓度,剂量与药物吸收和血浆浓度成正比,范围在每日9~36 mg之间,半衰期为10~12 h,应把握好治疗时间窗优化使用。一般每天晨起服一次,以改善白天清醒、警觉和认知,傍晚血浆水平一般会降低,从而最大限度地保证夜间睡眠。重复服药5~6 d后,必妥利生达到稳态血浆浓度,维持疗效。个体化选择合适剂量能保证持续用药而无明显外周和中枢神经系统副作用。必妥利生在肝脏由CYP 2D6代谢,小部分由CYP 3A4代谢,代谢产物均无药理活性,由肾脏排出(原形<2%)。肝肾功能不全可显著改变其半衰期和血药浓度,应减量或禁用。当其与强效CYP 2D6抑制剂或者诱导剂合用时,应调整剂量。(http://www.ema.europa.eu/;https://wakix.com/)。
3 临床应用现状:首选治疗发作性睡病,潜在适应症正在扩大
基于上述临床前期和临床II期[6]及近期临床III期[12]研究,必妥利生被欧洲EMA(2016年)和美国FDA(2019年)推荐为治疗成人发作性睡病患者EDS和猝倒的首选药物。2021年扩大用于治疗阻塞性睡眠呼吸暂停引起的EDS。针对帕金森病等神经系统疾病的EDS和认知障碍正在临床研究中。
3.1 发作性睡病引发的EDS和猝倒发作性睡病(Narcolepsy)是一种致残性终身睡眠障碍,多为儿童时期发病。典型症状为EDS和猝倒(肌张力突然丧失),以及睡眠幻觉和夜间睡眠障碍。严重影响学习、生活、情绪及认知功能。目前认为该病由自身免疫性炎症所致,主要用药物对症治疗。包括:中枢兴奋剂治疗EDS、抗抑郁药改善猝倒以及镇静催眠药处理夜间睡眠异常。
必妥利生治疗发作性睡病的疗效主要取证于两项以安慰剂和莫达非尼为对照的多中心研究,疗程8周的结果均表明它改善EDS的疗效与莫达非尼相似,显著优于安慰剂[12]。Szakacs等[13]对高频率猝倒的发作性睡病患者进行了7周的治疗,与安慰剂相比,必妥利生对EDS和猝倒均有显著改善作用。而莫达非尼对猝倒无效[14]。动物实验显示长期应用H3受体反向激动剂可增强抗发作性睡病的作用[15],Dauvilliers等证实了必妥利生能够长期保持疗效[16]。由于发作性睡病多发于儿童,必妥利生的儿科应用尤为重要。仅发表的一项研究显示,几位学龄期严重EDS的儿童服用其他中枢兴奋药无效后,使用必妥利生能维持清醒、减少猝倒、正常上学完成学业[17]。儿科III期多中心临床试验也将展示显著治疗效应(发表中)。
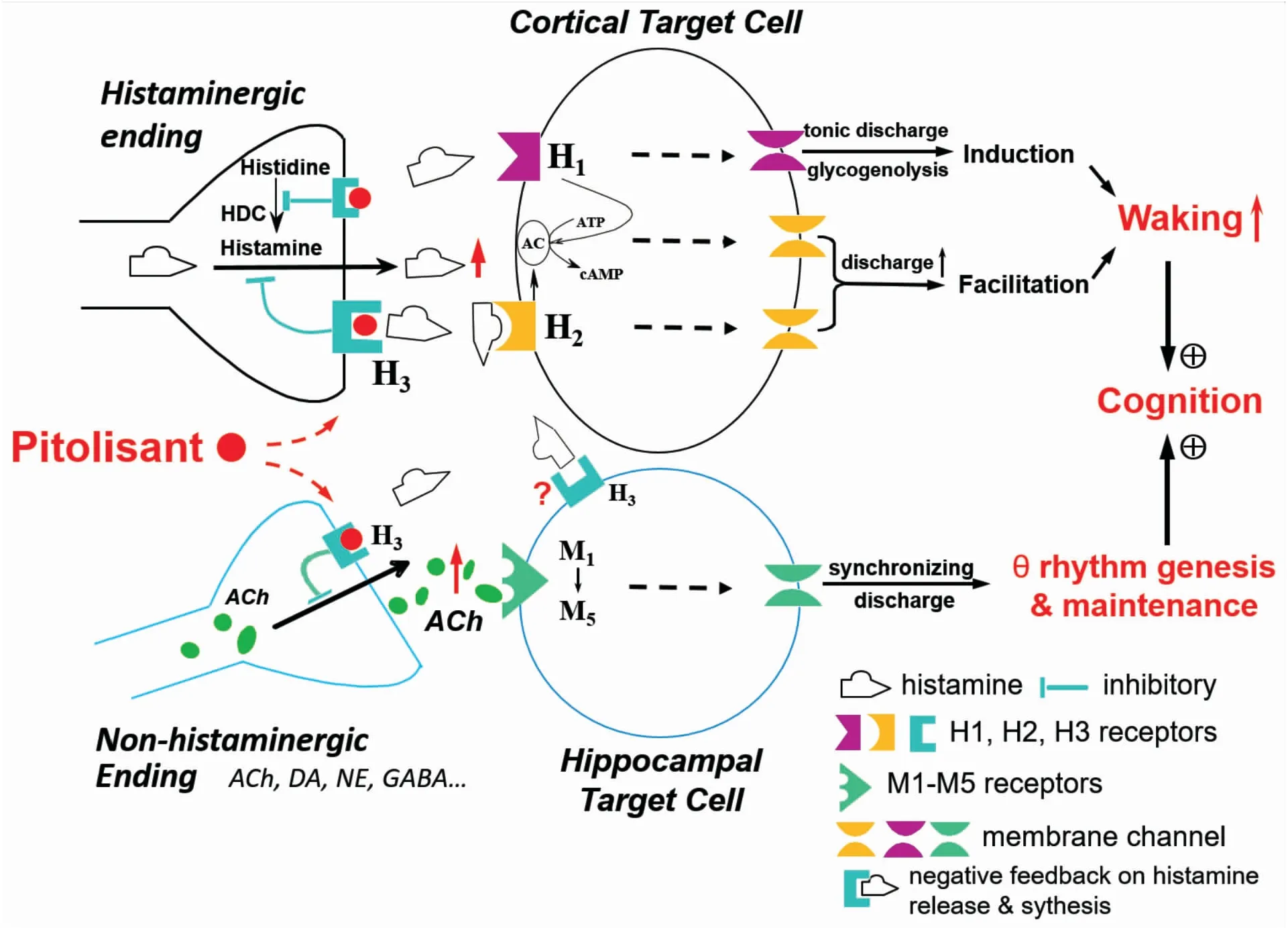
Fig 2 Schematic illustration summarizing cellular mechanisms involved in histamine- and pitolisant-induced enhancement of wakefulness and cognition via histamine H3 autoreceptor and heteroreceptor
3.2 阻塞性睡眠呼吸暂停引发的EDS阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种以睡眠过程中反复发生的上气道松弛塌陷致阻塞为特点的慢性睡眠障碍。EDS是大多OSA患者就诊的主诉,可导致认知功能和注意力下降。持续气道正压通气(continuous positive airway pressure,CPAP)是中重度OSA的一线疗法,能显著改善EDS,提高病人生活质量。然而15%的OSA患者拒绝CPAP治疗,20%~30%无法持续使用。Dauvilliers等对268例拒绝或者无法坚持CPAP的OSA患者进行了12周的治疗后发现必妥利生组的EDS主客观评估均明显改善。Pépin等对244名坚持使用CPAP但依旧存在EDS的OSA患者进行12周治疗也显示患者接受必妥利生治疗后主客观EDS均明显改善。然而Trotti对以上结论提出了不同看法,对于无法耐受CPAP治疗的OSA患者使用必妥利生后改善了EDS症状,可能会更减弱其对使用CPAP的动力,增加并发症风险。但目前临床上使用获准的促醒药物(必妥利生、莫达非尼、solriamfetol)仍是改善OSA患者EDS,尤其CPAP疗法欠佳或不耐受患者的安全有效治疗手段。
3.3 帕金森病引发的EDS帕金森病(Parkinson’s disease,PD)是常见的神经退行性疾病,除典型的运动症状外,患者的非运动症状如睡眠、情绪和认知等障碍尤为突出。约75%有睡眠障碍的PD患者存在EDS,且EDS与患者的病程进展和生活质量下降密切相关,逐渐成为PD的治疗重点。在一项探索性单盲试验中,26名PD患者接受必妥利生治疗后EDS显著改善。大多数继续3个月的开放式治疗,其EDS持续改善。在首批Ⅲ期临床试验中,必妥利生明显改善PD患者的EDS和运动参数,还减少左旋多巴的每日剂量。目前必妥利生对PD患者EDS的疗效已进入多中心临床Ⅲ期试验,主要挑战为测定个性化剂量以应对病人不同程度的退行性变引起的EDS。
3.4 抗癫痫辅助治疗癫痫(epilepsy)是一种常见的神经系统疾病,全球累及7 000多万人,目前抗癫痫药物不能完好控制病情。临床前研究证据表明,中枢HA系统在调节神经兴奋性中起重要作用[18],低水平的HA与癫痫发作和发病机制有关[19]。因此,组胺H3受体反向激动药增强中枢HA释放被认为是开发新型抗癫痫药物的潜在途径。事实上,包括必妥利生在内的许多H3受体拮抗剂/反向激动药已在动物模型和临床试验中显示抗癫痫作用[20]。一项针对光敏性癫痫患者的早期临床Ⅱ期研究揭示了必妥利生抗癫痫潜能。另一项针对局灶性耐药性癫痫的临床Ⅱ期研究中,1/3患者在接受必妥利生治疗后的癫痫发作次数减少。由于患者人数较少,这项研究尚待大样本证实,以判断必妥利生治疗癫痫的有效性和安全性。
3.5 改善神经精神科疾患所致的认知障碍上述内科疾病,还有精神分裂症和阿尔茨海默病(Alzheimer′s disease,AD)等均伴随不同程度的皮层激活和认知障碍。鉴于脑组胺在促醒和促认知中的作用,H3受体拮抗剂/反向激动剂治疗认知障碍的概念一直颇受关注[1-3,7]。早期的咪唑基H3受体拮抗剂ciproxifan增强小鼠的空间记忆和大鼠的记忆识别[21]。Thioperamide逆转PD小鼠的记忆和睡眠障碍[22],并通过调节神经胶质增生和抑制炎症改善AD小鼠的认知障碍,还有助于β-淀粉样蛋白清除[23]。非咪唑基H3受体拮抗剂ABT-288能增加大鼠皮质中的HA、ACh和DA水平[24],对AD和精神分裂症患者的研究也似有阳性反应。GSK239512在动物模型和AD患者中均能改善注意力和记忆。所有这些使用拮抗剂/反向激动剂的临床前研究对奠定H3受体作为改善认知靶点的概念难能可贵,然都止于临床Ⅱ或Ⅲ期。
目前只有必妥利生一枝独秀,进入临床,故在改善认知治疗中被寄予厚望。至此单独针对认知障碍的必妥利生临床试验还较少,但已发表的研究均展现了较好前景。动物研究显示必妥利生改善记忆[25];它不仅可以提高大鼠前额叶皮质的HA、ACh和DA水平,还能显着增强猫和小鼠的清醒状态及脑电图的皮层快节律;在物体识别测试中,必妥利生改善了东莨菪碱诱导或自然遗忘小鼠的记忆缺陷[5]。临床上必妥利生改善Prader-Willi综合征患者的认知障碍和EDS[10]。一例合并发作性睡病的精神分裂症病人在使用必妥利生3周后,其EDS和认知功能均有改善。必妥利生正被视为新型认知促进剂的候选药物,基础和大样本临床测试正在展开。
另外,能够增加脑内组胺能和胆碱能神经传递的化合物应被视为最有前景的选项。比如,H3受体和胆碱酯酶的双重抑制剂,即UW-MD-71剂量依赖性地增强记忆恢复并逆转地佐西平诱导的大鼠记忆障碍[26],有望用于AD。又如,H3受体兼并组胺代谢酶(N-甲基转移酶,N-methyltransferase)、5-HT转运蛋白或sigma-1受体的双重抑制剂,也有望构成新型的促认知剂[9,27]。
最后,由于H3受体独特的药理特性,使之成为近年开发中枢疾病药物的重要靶标。有证据显示拮抗H3受体可通过非组胺依赖性机制保护缺血性损伤,表明H3受体抑制可作为脑缺血的潜在治疗手段[28]。此外,H3受体反向激动剂降低了饮酒和酒精诱导的位置偏好以及线索诱导的酒精恢复,这为治疗酒精成瘾和滥用提供了新思路[29]。
上述各提及的临床研究还显示必妥利生耐受性良好,偶有轻中度不良反应,主要为剂量较高所致,如失眠、头痛、恶心、焦虑和易怒,且治疗后未检测到戒断综合征。目前暂无严重心脑血管不良事件及伤亡报道。尤其动物及人体实验均未发现必妥利生的成瘾性和滥用风险,这个特性明显有别于经典中枢兴奋剂,后者不同程度地通过抑制多巴胺转运蛋白增加中枢多巴胺神经传递,产生运动过度、行为致敏化、食欲不振、滥用和成瘾。相比之下,必妥利生对纹状体多巴胺、运动或食物摄入没有影响,还减弱了莫达非尼或 solriamfetol引起的过度运动[30]。
4 小结和展望
综上,必妥利生为组胺H3受体反向激动剂的促醒药物,在欧美和其它一些国家投入临床应用已数年,我国也即将引进。其靶标明确、机制新型,且高效安全,剂量适当可维持日间清醒,还增强大脑警戒性、改善认知。与安非他命或莫达非尼相比,必妥利生无成瘾性,应成为有优势的非精神类管控药,临床能持续使用,不会像安非他命等中枢兴奋剂引发过度行为兴奋和认知功能减退造成安全事故。在未来研究中,有必要开展大样本临床试验以探索必妥利生对认知缺陷为主的神经精神疾病如AD的治疗效果。同时,以必妥利生小分子药为探针,研究组胺传递激活后的清醒和认知调控的新脑区及神经环路,为睡眠和认知障碍精准治疗开拓新的治疗策略。
