小麦根际微生物群落结构和多样性对水分胁迫的响应
2022-11-09张江伟薛佳欣柴晓甜李莉威张斯佳贾丽娟张建恒王贵彦
张江伟,薛佳欣,李 慧,柴晓甜,赵 帅,李莉威,张斯佳,贾丽娟,张建恒,王贵彦
小麦根际微生物群落结构和多样性对水分胁迫的响应
张江伟,薛佳欣,李 慧,柴晓甜,赵 帅,李莉威,张斯佳,贾丽娟,张建恒*,王贵彦*
(河北农业大学 农学院,华北作物改良与调控国家重点实验室,农业农村部 华北节水农业重点实验室,河北 保定 071000)
【目的】探明小麦根际微生物群落结构和多样性对水分胁迫的响应。【方法】以小麦品种“济麦22”为试验材料,采用单因素完全随机盆栽试验,以小麦开花期充分供水(CK)为对照,设置轻度水分胁迫(L)、中度水分胁迫(M)和重度水分胁迫(S)3个处理。每个处理于开花期取根际土,利用Illumina高通量测序技术测定微生物群落结构和多样性,分析根际土壤酶活性、微生物群落组成和多样性对不同水分胁迫的响应。【结果】与CK相比,轻度水分胁迫显著提高了土壤蔗糖酶活性,重度水分胁迫显著降低了蔗糖酶和脲酶活性,水分胁迫对碱性磷酸酶活性没有显著影响。水分胁迫对细菌和真菌多样性指数的影响不同,与CK相比,细菌的Shannon多样性指数受水分胁迫影响显著降低,而真菌的Shannon指数只有重度水分胁迫时显著下降;细菌和真菌的ACE、Chao1和辛普森多样性指数只在重度水分胁迫时显著改变。水分胁迫处理细菌优势菌属为地杆菌属()、马赛菌属()和属;水分胁迫时真菌优势属为赤霉菌属()、被孢霉属()、油壶菌属()、布氏白粉属()、枝孢菌属()、属、链格孢菌属()和菌属,其中油壶菌属()和链格孢菌属()的相对丰度均高于CK,链格孢菌属()的相对丰度在轻度水分胁迫时显著高于CK;重度水分胁迫时油壶菌属()和布氏白粉属()的相对丰度比其他处理显著提高,被孢霉属()相对丰度则显著降低。冗余分析表明,土壤含水量和蔗糖酶活性与细菌群落类诺卡氏菌属()、马赛菌属(Massilia)、属、属和地杆菌属()均呈极显著负相关(<0.01);与真菌优势菌属被孢霉属()和属呈极显著正相关,与赤霉菌数()、油壶菌属()和枝孢菌属()呈极显著负相关。【结论】小麦开花期轻度水分胁迫提高了根际土壤蔗糖酶活性,不同程度的水分胁迫改变了根际微生物群落结构及多样性,细菌和真菌优势菌属的相对丰度受土壤含水量和蔗糖酶活性的共同影响。
冬小麦;水分胁迫;土壤酶活性;土壤微生物群落结构和多样性
0 引言
【研究意义】土壤微生物是土壤形成和养分循环的驱动力,在土壤有机质和矿物质分解、土壤结构的形成等方面发挥着重要作用[1]。土壤酶是土壤生态系统的重要组成部分之一,参与土壤中的各种生化反应,是测定土壤生物活性的有机组成部分之一,反映了土壤中各种生化过程的强度[2]。水分作为土壤各种生化反应的溶剂,适宜的水分状态有利于植物-土壤-微生物系统营养物质的循环与转化,促进植物根系对土壤养分的吸收与利用,同时植物在生长过程中通过光合作用和根系分泌物促进土壤酶及微生物活性的提高[3]。因此,从生理节水角度出发,系统分析水分胁迫对小麦开花期根际土壤微生物群落结构和多样性及土壤酶活性的影响有助于揭示水分调控对小麦生长的影响机制。【研究进展】根际是作物和土壤相互作用最活跃的区域,能快速响应土壤环境变化[4],土壤含水量是影响土壤环境的主要因子之一,土壤水分变化必然会影响土壤微生物活动和碳氮循环[5-6],从而影响土壤各种生化反应、酶促反应以及微生物群落结构[7]。研究表明,土壤微生物活性受土壤水分、pH值、温度、有机质和土壤孔隙等多种因素影响[8],水分胁迫作为非生物胁迫中较普遍的因素之一,对根际微生物以及土壤酶活性有显著影响[9-10]。周芙蓉等[11]研究表明轻微水分胁迫可有效促进土壤酶活性,也能够刺激植物根系分泌更多的酶数量[12]。微生物具有一些独特的缓解胁迫的作用, 主要通过提高寄主植物对水分和养分的摄取来实现,根际微生物可协助宿主植物抵御干旱胁迫[13]。研究发现,土壤干旱使水稻等作物根际微生物群落组成发生明显变化,但对多样性影响不大[14-15],而间歇灌溉有利于提高水稻土壤微生物功能多样性[16]。另外,还有研究表明,干旱胁迫会降低土壤微生物代谢速率,降低其活性和数量[17],但可以提高温室葡萄根际土壤微生物活性,强化碳源代谢强度[18]。总之,在土壤-植物根系-微生物交互系统中,其相互关系较为复杂,如细菌能产生植物调节因子或改变激素水平等提升植物的耐旱水平,而真菌可调控水通道蛋白和干旱相关基因促进植物在干旱胁迫下的代谢和生长[13]。【切入点】目前,由于华北平原资源性缺水现状,限水灌溉影响小麦生长、土壤酶活性和提高水分利用效率等方面研究较多[19-20],但水分胁迫对小麦根际土壤微生物群落结构及多样性的影响尚需进一步研究。【拟解决的关键问题】为进一步阐明水分胁迫对根际土壤微生物群落结构和多样性的影响,采用旱棚盆栽方法,严格控制土壤含水率,系统分析小麦开花期根际土壤酶活性、微生物群落组成及多样性对开花期不同水分胁迫程度的响应,以期为研究小麦关键生育期应对水分胁迫机制、调控和优化根际环境提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2019年10月—2020年6月在河北农业大学(38.49°N,115.26°E)自动防雨旱棚内进行。小麦品种为济麦22,采用盆栽种植,盆口直径28.5 cm,底直径25 cm,盆高33.5 cm,侧面灌水。盆装土取自大田耕作层土壤,自然风干后过筛,土壤类型为壤土,田间持水率为27.2%,体积质量为1.48 g/cm3,有机质量为15.35 g/kg,全氮量为0.8 mg/g,速效磷量为22.16 mg/g,速效钾量为67.4 mg/g。2019年10月15日播种,总施肥量为N 210 kg/hm2、P2O5150 kg/hm2和K2O 90 kg/hm2,氮基追比为5∶5,磷钾肥底施,拔节期追氮,播种30粒,三叶期定苗18株/盆,2020年6月2日收获。
1.2 试验设计
试验共设4个处理,采用称质量差值法,正常供水(CK,开花期土壤含水率保持在田间持水率的75%~80%)、轻度胁迫(L,开花期土壤含水率保持在田间持水率的60%~65%)、中度胁迫(M,开花期土壤含水率保持在田间持水率的40%~45%)和重度胁迫(S,开花期土壤含水率保持在田间持水率的30%~35%)[21],每个处理设6次重复。拔节期前正常水分管理,拔节期后采用称质量法控制盆内土壤含水率为田间持水率的75%,保证植株正常生长,待土壤含水率下降至田间持水率的30%~35%时开始水分胁迫,开花期前分别按照相应水分胁迫程度进行胁迫,其他时期均维持正常水分管理,随机排列。水分梯度控制采用称质量差值法[22],每隔1天称质量1次,于当天18:00用电子天平称质量进而控制土壤含水量以达到相应的水分梯度。取样结束后,在防雨棚下灌水使土壤相对含水率恢复至75%左右,直至成熟收获。
1.3 测定项目与方法
1.3.1 土壤样品采集
开花期是小麦的需水关键期,同时也是土壤中微生物和土壤酶最活跃的时期,故在小麦开花期取根际土。水分胁迫后,每个处理各取6株,采用抖落分离法,取根际土混匀,迅速过2 mm筛,装入提前编号的5 mL离心管中,每个处理设6次重复,放到冰盒中带回实验室,一部分采用烘干法测定土壤水分,一部分放入-80 ℃超低温冰箱中保存,用于土壤微生物多样性测定,另一部分于4 ℃冰箱保存,用于测定土壤酶活性[23]。
1.3.2 测定方法
1)土壤微生物多样性:委托上海美吉生物医药科技有限公司通过对16S/ITS rRNA特定区段PCR产物进行高通量测序处理。具体测试过程为:土壤样品→抽提质检样品DNA→经过PCR扩增、混样、建库并做相应的检测→检测合格的文库采用Illu-mina Hiseq PE250测序平台对样品进行测序→测序得到下机数据→数据拼接质控→优化数据→OTU聚类→进行微生物多样性数据分析[24-25]。
2)土壤酶活性:蔗糖酶、脲酶和磷酸酶活性的测定方法参照关松荫的《土壤酶及其研究法》[26]。
1.4 数据统计分析
数据和图表用Excel 2010进行处理,采用SPSS 25.0对数据进行方差分析和差异显著性检验(=0.05)。采用Canoco 5.0软件对微生物群落与土壤环境因子进行RDA冗余分析,利用 mothur计算不同随机抽样下的 Alpha 多样性指数,利用R语言工具绘制Venn图。
2 结果与分析
2.1 水分胁迫对小麦根际土壤酶活性的影响
相比CK,随着水分胁迫程度的增加,根际土壤蔗糖酶、脲酶和碱性磷酸酶活性均呈先增加后降低的变化趋势(表1)。与CK相比,L处理土壤蔗糖酶活性显著增加,提高了8.56%,脲酶和碱性磷酸酶活性虽然也有所提高,但差异不显著;随着水分胁迫程度增大,与CK相比,M处理和S处理土壤蔗糖酶、脲酶活性有所降低,但M处理与CK差异不显著,S处理比CK显著降低,碱性磷酸酶活性与CK没有显著差异。与充分供水相比,L处理显著提高了土壤蔗糖酶活性。
2.2 不同水分胁迫土壤微生物多样性指数特征
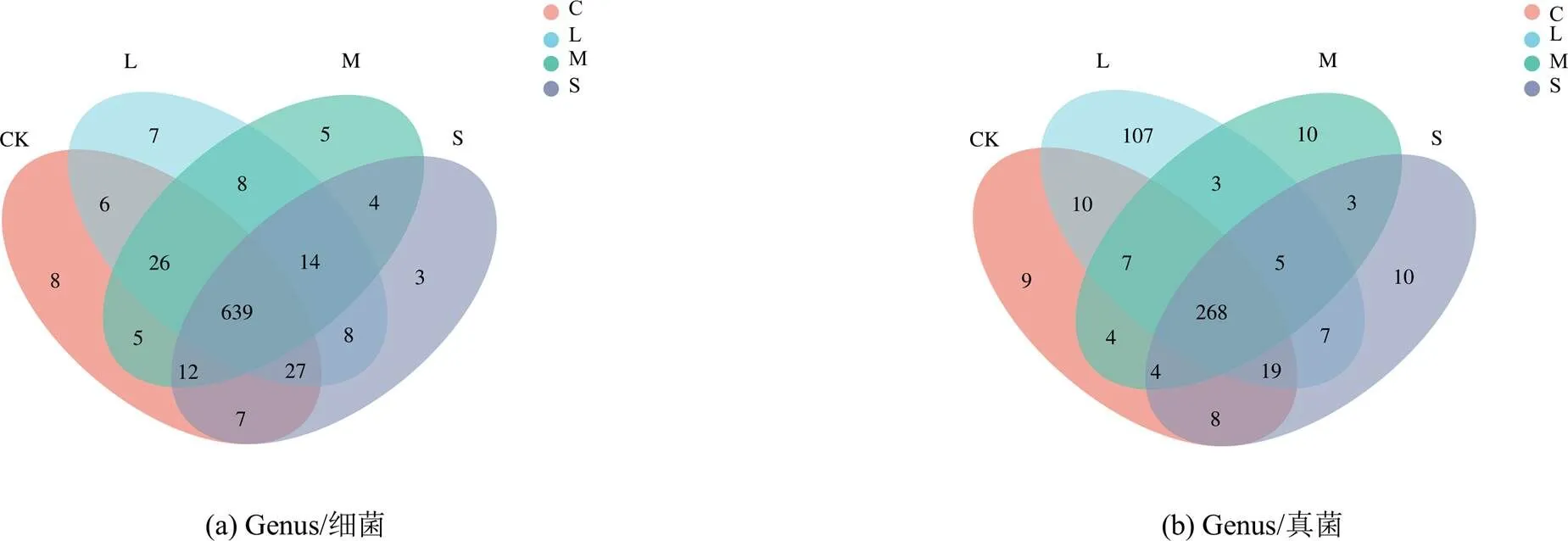
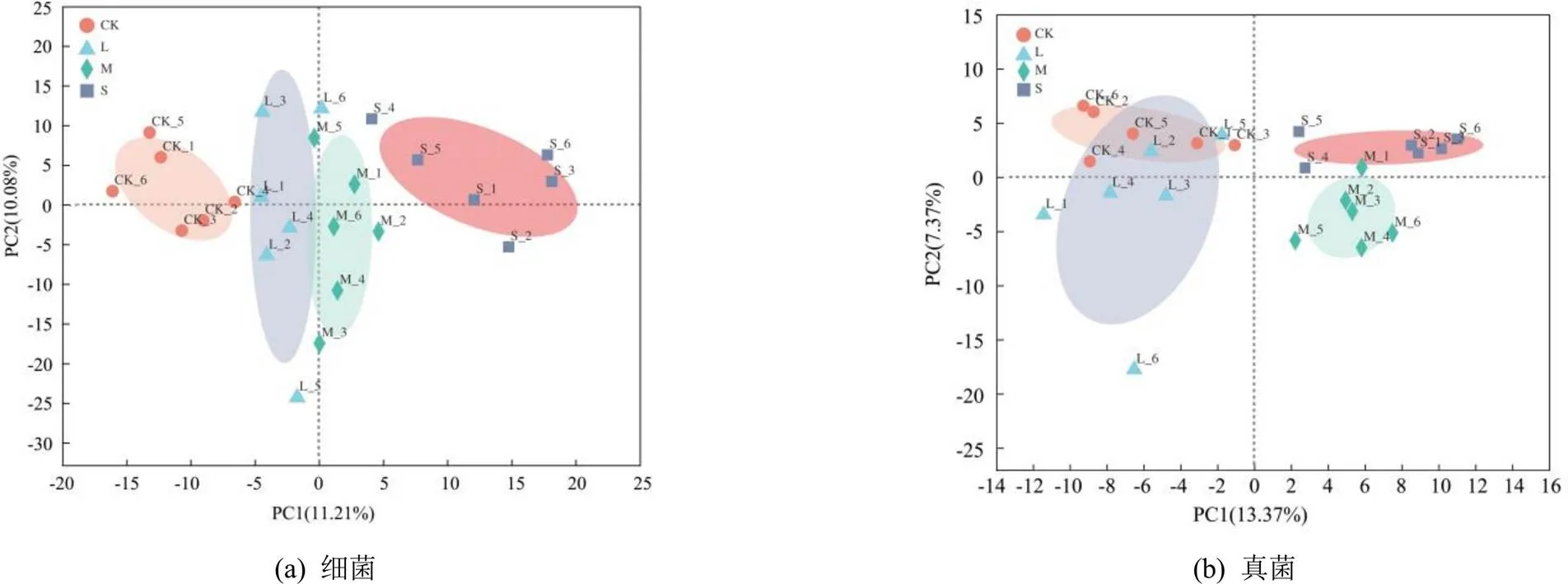
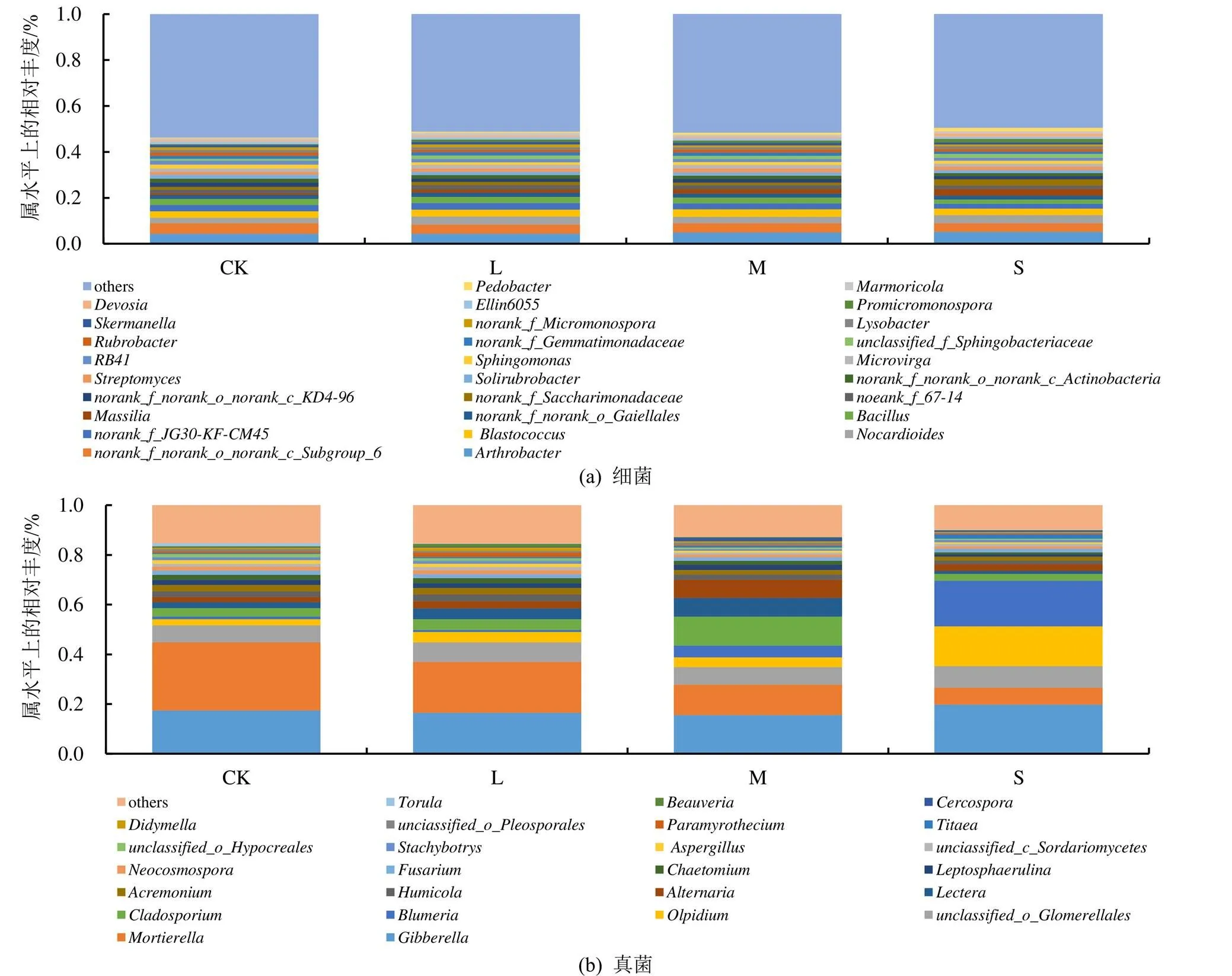
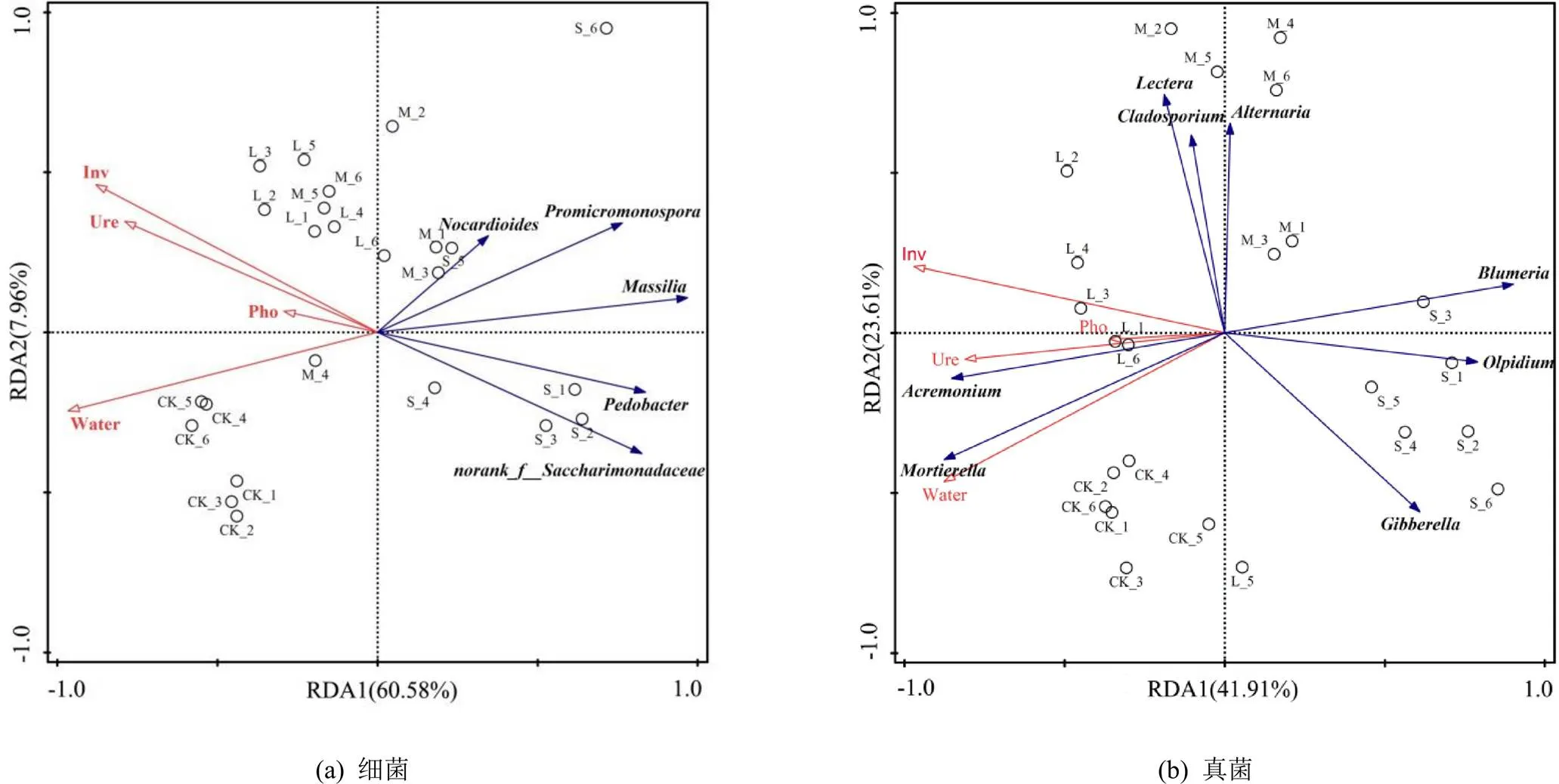
各处理的覆盖度均大于95%,说明能够反映根际土壤中微生物的真实情况(表2)。通过对ACE、Chao1、Simpson、Shanon多样性指数分析可知,水分胁迫显著降低了细菌Shannon多样性指数,而Simpson多样性指数则相比CK有所提高,ACE和Chao1指数S处理显著小于CK;各处理真菌多样性的Simpson指数排序为L处理 表1 不同水分胁迫处理小麦根际土壤酶活性 注 表中不同小写字母表示差异显著(<0.05),下同。 表2 水分胁迫处理根际微生物群落多样性指数特征 注 同列数字后不同小写字母表示差异显著(<0.05)。 由图1可知,不同处理共有的细菌属为639,占总细菌属的82.03%。不同处理小麦根际土壤特有细菌属均表现为CK>L处理>M处理>S处理,S处理显著低于CK和L处理,表明根际土壤微生物特有细菌属随水分胁迫程度的提高而减少;各处理共有的真菌属为268,占总真菌属的71.09%,各处理真菌属数目均无显著性差异。 图1 根际土壤细菌和真菌群落的Genus Venn图 由图2(a)可知,不同水分处理对根际土壤微生物群落组成的相似性或差异性有显著影响。在细菌群落组成中,PC1轴和PC2轴的累计贡献率为21.29%,其中PC1轴的贡献率为11.21%,PC2轴的贡献率为10.08%,第一主成分PC1大于第二主成分PC2对群落的贡献率,因此以PC1为主,分析各处理微生物细菌群落组成。CK和L处理位于PC1轴的负方向,M处理、S处理位于PC1轴的正方向,且L处理和M处理样点距离较近,表明L处理和M处理之间细菌群落组成更为相似,而CK与S处理的样品间差异较大。 从图2(b)可知,PC1轴和PC2轴累计贡献率达到20.74%,其中PC1轴的贡献率为13.37%,PC2轴的贡献率为7.37%,第一主成分PC1对群落的贡献率远大于第二主成分PC2,因此根据PC1轴比较不同处理样本间群落组成的相似性。图中,CK和L处理均在PC1轴的负方向,M处理和S处理均在PC1轴的正方向,表明不同水分胁迫对土壤根际微生物群落组成影响显著,其中CK和L处理样点距离较近,S处理和M处理样品点距离较近,表明充分供水与轻度胁迫之间小麦根际微生物真菌群落组成更为相似,中度与重度胁迫之间小麦根际微生物真菌群落组成相似。 图2 根际土壤细菌和真菌的群落结构主成分分析 不同处理细菌优势种属分布及相对丰度不同(图3(a)),随着水分胁迫的加剧,排名前30的优势属总相对丰度之和L、M处理和S处理分别为48.78%、48.39%和50.46%,显著高于CK。节杆菌属()在所有处理中所占比值最高,且相对丰度较高,是根际土壤重要的优势种属。正常供水(CK)时,_KD4-96属、属、属、鞘氨醇单胞菌属()、RB41属、红色杆菌属()和Ellin6055属在CK下的占比最高,说明开花期水分胁迫对以上细菌属有明显的抑制作用。当发生水分胁迫时,节杆菌属()、类诺卡氏菌属()、马赛菌属()、链霉菌属()、属、属、戴沃斯氏菌属()、大理石雕菌属()和地杆菌属()的相对丰度占比均高于CK,说明水分胁迫条件下这类细菌的相对丰度具有优势。与CK相比,类诺卡氏菌属()、马赛菌属()和菌属相对丰度增加,而且差异显著(<0.05);不同组微生物群落之间的物种post-hoc检验结果进一步表明(图4(a)),马赛菌属()的相对丰度在所有处理间均显著或极显著,菌属只有S处理和CK、L处理和M处理差异显著,其他处理间差异不显著,类诺卡氏菌属()只有S处理和CK间差异显著。 图3(b)为不同处理真菌优势种属和相对丰度。不同水分处理下赤霉菌属()、被孢霉属()和属的平均相对丰度分别占总群落的15.54%~19.70%、6.92%~27.41%和6.92%~8.62%,是根际土壤极为重要的真菌优势属。赤霉菌属()、被孢霉属()、油壶菌属()、布氏白粉属()、枝孢菌属()、属、链格孢菌属()和菌属在处理间差异显著(图3(b)),其中油壶菌属()和链格孢菌属()等在水分胁迫时相对丰度均高于CK,说明水分胁迫有利于这2类真菌的生长。从post-hoc检验结果(图4(b))来看,枝孢菌属()、属、链格孢菌属()的相对丰度在M处理下极其显著高于CK;油壶菌属()和布氏白粉属()在S处理下高于CK、L处理和M处理,说明重度水分胁迫可显著提高油壶菌属()和布氏白粉属()的平均相对丰度;被孢霉属()的相对丰度在CK条件下高于L、M处理和S处理,且L、M处理和S处理间具有显著性差异,表明水分胁迫对被孢霉属()的生长具有明显的抑制作用;L处理下属的平均相对丰度最高,显著高于M处理和S处理,但与CK无显著差异。 图3 土壤细菌/真菌群落属分类水平上的组成和相对丰度及差异 RDA分析可以直观地反映样本分布和环境因子间的关系。由表3可知,土壤环境因子对细菌和真菌群落方差解释率和贡献率大小排序分别为:含水率>蔗糖酶>碱性磷酸酶>脲酶和蔗糖酶>碱性磷酸酶>脲酶。分析结果表明(图5(a)),环境因子对细菌群落的累计贡献率为68.54%,其中第一轴的贡献率为60.58%,第二轴的贡献率为7.96%,可分别解释土壤环境因子和细菌群落之间的关系。土壤含水率、土壤蔗糖酶、脲酶和碱性磷酸酶活性与类诺卡氏菌属()、马赛菌属()、属、属和地杆菌属()均呈负相关,其中,土壤含水率和蔗糖酶与上述优势细菌菌属均达极显著水平,贡献率分别为82.7%和15.8%,由此说明水分胁迫时有利于以上细菌属的繁殖,从而调控根际微环境。此外,图中红色箭头标记的3种土壤酶活性和含水率之间均呈正相关。从图5(b)可以看出,第一轴和第二轴累计贡献率达65.52%,其中第一轴的贡献率为41.91%,第二轴的贡献率为23.61%,分别解释土壤环境因子和真菌群落之间的关系,土壤含水量与属和被孢霉属()均呈极显著正相关,与赤霉菌属()、属、油壶菌属()、布氏白粉属()、枝孢菌属()、属、链格孢菌属()和腐质霉属()呈负相关,与赤霉菌属()、油壶菌属()和枝孢菌属()达极显著水平,土壤水分对优势真菌菌属的贡献率为33.2%;3种土壤酶活性与属、被孢霉属呈正相关,其中蔗糖酶活性与枝孢菌属()和属呈极显著正相关,蔗糖酶活性对优势真菌菌属的贡献率为60.3%。 表3 交互式正向选择分析结果 图5 土壤酶活性与微生物群落属分类水平上的RDA分析 土壤酶是通过土壤微生物活动、植物根系以及动物残体分泌而来,其活性能够反映土壤中各种生化反应的过程和程度[27-28]。相关研究表明,水分胁迫会改变根际土壤酶活性及土壤微生物群落结构与功能[29]。本研究结果表明,小麦根际土壤蔗糖酶、脲酶和碱性磷酸酶均在轻度水分胁迫时活性有所增强,其原因可能是轻度水分胁迫能够刺激根系分泌更多的酶[12]或通过影响土壤理化性状和有机质的有效性等进而影响酶的生产[20];随着胁迫程度加剧,蔗糖酶和脲酶活性显著降低,碱性磷酸酶活性降低不显著,与周来良等[30]发现刺槐、柠檬桉、大叶相思随着胁迫程度增加土壤酶活性呈减小趋势的研究结果基本一致,Wang等[31]研究结果也说明当土壤水分降低到某一阈值形成干旱时会抑制酶活性。 土壤含水率变化可引起土壤微生物、土壤理化性质和植物养分之间关系的变化,从而对土壤微生物群落结构产生直接或间接的影响[32],根际土壤微生物对外界环境变化敏感,能够对土壤水分变化快速做出响应,进而影响根际微生物群落结构[33]。本研究表明,与CK相比,轻度水分胁迫没有明显降低细菌和真菌群落的ACE、Chao1多样性指数,细菌的Shannon多样性指数显著降低,与水分胁迫明显增加了圆叶决明根际土壤细菌、真菌、放线菌以及固氮菌的数量结果有所不同[34],与高彦婷等[35]轻度胁迫较充分灌水可显著提高葡萄根际土壤微生物群落多样性和丰富度研究结果也不一致,其原因可能是因为植物根际土壤微生物对植物种类和不同水分胁迫反应异常敏感,与植物种类、胁迫程度和胁迫时间等有关[36-37]。此外,本研究发现,节杆菌属()在不同水分处理中所占比例最高,且相对丰度较大,是促进植物快速适应干旱环境的重要优势种属,轻度水分胁迫细菌优势菌属地杆菌属()、马赛菌属()、属相对丰度均显著或极显著高于CK,说明地杆菌属()、马赛菌属()、属均能适应水分胁迫环境,适度的水分胁迫可有效提高其相对丰度,与以往研究水分胁迫可能会刺激植物对特定的菌群做出选择并和它们建立联系以抵御环境变化有关[38]。本研究发现,枝孢菌属()、链格孢菌属()和属均在M处理中达到最大,显著高于其他处理,说明在中度水分胁迫下这3种菌属丰度的增加可适应当前土壤根际微生态,另外被孢霉属()在CK下极其显著高于L、M处理和S处理,表明水分胁迫对被孢霉属()的生长具有抑制作用,可能与受胁迫影响时间不同导致不同类群的微生物丰度相继受到抑制有关[39]。此外,本研究还通过PCA分析可知,不同水分处理根际土壤微生物群落结构差异明显,与张传更等[25]不同水分管理措施对麦田土壤微生物群落结构的影响结果一致。 根际土壤微生物群落与土壤环境因子密切相关,适宜的土壤水分有利于土壤微生物对作物根系养分的吸收与转化[40]。本试验条件下,交互式正向选择分析结果显示土壤含水量和蔗糖酶活性是影响细菌和真菌群落结构的主要驱动因素,说明了水分胁迫下微生物类群丰度变化与酶活性之间的相关关系[39]。随着水分胁迫程度的加剧,细菌类诺卡氏菌属()、马赛菌属()、属、属和地杆菌属()相对丰度均增大,真菌类油壶菌属()、布氏白粉属()的相对丰度也增加,而被孢霉属()则显著降低,其原因可能与水分胁迫对各类微生物造成的生理胁迫和获取碳源能力不同,使各类微生物耐受干旱的能力也有所不同[41]。此外,土壤含水量、蔗糖酶、脲酶和碱性磷酸酶活性与属和被孢霉属()呈正相关,说明脲酶和蔗糖酶活性的增强会促进属和被孢霉属()的繁殖,脲酶是促进有机化合物碳氢键水解的关键酶,其活性的增强会提高土壤的供氮能力,从而影响微生物群落结构,蔗糖酶有助于土壤有机质的转化利用,为微生物的生长提供充足的营养物质,从而促进微生物繁殖[42]。研究表明,被孢霉属()可引起植物体发生病害,不利于作物生长发育,因此水分胁迫可有效抑制被孢霉属()的繁殖[43]。水分胁迫下根际微生物受土壤水分及由水分变化引发的各种生理生化产物等多因素影响,因此应从生理节水角度针对水分胁迫下小麦根际土壤微生物、根系和土壤生态环境的响应机制进行更深入的研究。 1)水分胁迫对根际土壤酶活性具有明显的调控效应,轻度水分胁迫显著提高了根际土壤蔗糖酶活性,重度水分胁迫显著降低了蔗糖酶和脲酶活性。 2)水分胁迫明显改变了根际土壤微生物群落结构,重度胁迫显著降低了细菌和真菌群落多样性、均匀度和丰富度。轻度胁迫较充分供水显著提高细菌优势菌属地杆菌属、马赛菌属、属相对丰度;与CK相比,水分胁迫显著提高了油壶菌属和链格孢菌属的相对丰度,而被孢霉属()则显著降低。 3)土壤水分和蔗糖酶活性是影响细菌和真菌群落结构的主要驱动因素。细菌群落结构受土壤水分的影响较大,贡献率为83.7%,蔗糖酶活性贡献率为15.8%;真菌群落结构主要受蔗糖酶活性影响,贡献率为60.3%;其次受土壤水分的影响,贡献率为33.2%。 [1] ZENG J, LIU X J, SONG L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41-49. [2] 王理德, 王方琳, 郭春秀, 等. 土壤酶学硏究进展[J]. 土壤, 2016, 48(1): 12-21. WANG Lide, WANG Fanglin, GUO Chunxiu, et al. Review: progress of soil enzymology[J]. Soils, 2016, 48(1): 12-21. [3] 陈旭. 水分和间距对枣棉间作复合系统土壤微生物及酶活性的影响[D]. 阿拉尔: 塔里木大学, 2019. CHEN Xu. Effects of water stress on the soil microbial and enzyme activities in intercropping cotton field[D]. Alaer: Tarim University, 2019. [4] LAKSHMANAN V, RAY P, CRAVEN K D. Toward a resilient, functional microbiome: Drought tolerance-alleviating microbes for sustainable agriculture[J]. Methods in Molecular Biology (Clifton, N J), 2017, 1 631: 69-84. [5] SARTO M V M, BORGES W L B, BASSEGIO D, et al. Soil microbial community, enzyme activity, C and N stocks and soil aggregation as affected by land use and soil depth in a tropical climate region of Brazil[J]. Archives of Microbiology, 2020, 202(10): 2 809-2 824. [6] 郭强, 于玲玲, 韩静然. 保护性耕作对玉米田土壤呼吸及水分利用效率的影响[J]. 灌溉排水学报, 2018, 37(11): 57-62. GUO Qiang, YU Lingling, HAN Jingran. Soil respiration and water use efficiency of corn field under conservative tillage with and without straw incorporation[J]. Journal of Irrigation and Drainage, 2018, 37(11): 57-62. [7] MA H K, BAI G Y, SUN Y, et al. Opposing effects of nitrogen and water addition on soil bacterial and fungal communities in the Inner Mongolia steppe: A field experiment[J]. Applied Soil Ecology, 2016, 108: 128-135. [8] 王庆贵, 张晓莹. 土壤微生物对大气氮沉降的响应研究进展[J]. 河南师范大学学报(自然科学版), 2021, 49(6): 11-18. WANG Qinggui, ZHANG Xiaoying. Response of soil microorganisms to atmospheric nitrogen deposition:A review[J]. Journal of Henan Normal University (Natrual Science Edition), 2021, 49(6): 11-18. [9] VURUKONDA S S K P, VARDHARAJULA S, SHRIVASTAVA M, et al. Multifunctional Pseudomonas putida strain FBKV2 from arid rhizosphere soil and its growth promotional effects on maize under drought stress[J]. Rhizosphere, 2016, 1: 4-13. [10] 薛冉. 生长早期小麦根际土壤养分及微生物对不同水分供应模式响应及其机制的研究[D]. 兰州: 兰州大学, 2017. XUE Ran. Responses and mechanisms of rhizospheric nutrients and microbial activity to water supply patterns in early growth stage of wheat[D]. Lanzhou: Lanzhou University, 2017. [11] 周芙蓉, 王进鑫, 杨楠, 等. 水分和铅胁迫对土壤酶活性的影响[J]. 草地学报, 2013, 21(3): 479-484. ZHOU Furong, WANG Jinxin, YANG Nan, et al. Effects of water and lead stress on soil enzyme activities[J]. Acta Agrestia Sinica, 2013, 21(3): 479-484. [12] GRAMSS G, VOIGT K D, KIRSCHE B. Oxidoreductase enzymes liberated by plant roots and their effects on soil humic material[J]. Chemosphere, 1999, 38(7): 1 481-1 494. [13] 庞志强, 余迪求. 干旱胁迫下的植物根系-微生物互作体系及其应用[J]. 植物生理学报, 2020, 56(2): 109-126. PANG Zhiqiang, YU Diqiu. Plant root system-microbial interaction system under drought stress and its application[J]. Plant Physiology Journal, 2020, 56(2): 109-126. [14] HARTMAN K, TRINGE S G. Interactions between plants and soil shaping the root microbiome under abiotic stress[J]. The Biochemical Journal, 2019, 476(19): 2 705-2 724. [15] SANTOS-MEDELLÍN C, EDWARDS J, LIECHTY Z, et al. Drought stress results in a compartment-specific restructuring of the rice root-associated microbiomes[J]. mBio, 2017, 8(4): 764-717. [16] 李强, 李超, 方宝华, 等. 灌溉方式对稻田土壤微生物群落功能多样性的影响[J]. 基因组学与应用生物学, 2020, 39(4): 1 632-1 641. LI Qiang, LI Chao, FANG Baohua, et al. Effect of different irrigation modes in paddy soil on microbial community functional diversity[J]. Genomics and Applied Biology, 2020, 39(4): 1 632-1 641. [17] 叶德练, 齐瑞娟, 管大海, 等. 免耕冬小麦田土壤微生物特征和土壤酶活性对水分调控的响应[J]. 作物学报, 2015, 41(8): 1 212-1 219. YE Delian, QI Ruijuan, GUAN Dahai, et al. Response of soil microbial characteristics and soil enzyme activity to irrigation method in no-till winter wheat field[J]. Acta Agronomica Sinica, 2015, 41(8): 1 212-1 219. [18] 高彦婷, 杨昌钰, 张芮, 等. 水分胁迫对温室滴灌葡萄根际土壤微生物碳源代谢活性的影响[J]. 灌溉排水学报, 2022, 41(1): 9-18. GAO Yanting, YANG Changyu, ZHANG Rui, et al. The effect of water stress on carbon metabolism in the rhizospheric microbiome of greenhouse grape[J]. Journal of Irrigation and Drainage, 2022, 41(1): 9-18. [19] 薛佳欣. 小麦生长发育特性和土壤微生物群落多样性对限水灌溉的响应[D]. 保定: 河北农业大学, 2021. XUE Jiaxin. Response of wheat growth and development characteristics and soil microbial community diversity to limited irrigation[D]. Baoding: Hebei Agricultural University, 2021. [20] 马守臣, 张伟强, 段爱旺. 不同亏缺灌溉方式对冬小麦产量及水分利用效率的影响[J]. 灌溉排水学报, 2019, 38(8): 9-14. MA Shouchen, ZHANG Weiqiang, DUAN Aiwang. Effects of different deficit irrigation modes on grain yield and water use efficiency of winter wheat[J]. Journal of Irrigation and Drainage, 2019, 38(8): 9-14. [21] 乐章燕, 廖荣伟, 刘晶淼, 等. 水分胁迫对华北平原冬小麦地上部分及产量的影响[J]. 气象与环境学报, 2014, 30(6): 120-124. LE Zhangyan, LIAO Rongwei, LIU Jingmiao, et al. Effects of water stress on stem, plant and yield of winter wheat over North China plain[J]. Journal of Meteorology and Environment, 2014, 30(6): 120-124. [22] 张娜, 赵宝平, 任鹏, 等. 水分胁迫对不同抗旱性燕麦品种根部生理特性的影响[J]. 中国农学通报, 2012, 28(21): 63-69. ZHANG Na, ZHAO Baoping, REN Peng, et al. Effect of water stress on physiological characteristics in root of different oat cultivars[J]. Chinese Agricultural Science Bulletin, 2012, 28(21): 63-69. [23] 孙倩, 吴宏亮, 陈阜, 等. 不同作物轮作对谷田土壤酶活性和土壤细菌群落的影响[J]. 生态环境学报, 2020, 29(12): 2 385-2 393. SUN Qian, WU Hongliang, CHEN Fu, et al. Effects of soil enzyme activity and bacterial community under different crop rotations[J]. Ecology and Environmental Sciences, 2020, 29(12): 2 385-2 393. [24] 姜雪薇, 马大龙, 臧淑英, 等. 高通量测序分析大兴安岭典型森林土壤细菌和真菌群落特征[J]. 微生物学通报, 2021, 48(4): 1 093-1 105. JIANG Xuewei, MA Dalong, ZANG Shuying, et al. Characteristics of soil bacterial and fungal community of typical forest in the Greater Khingan Mountains based on high-throughput sequencing[J]. Microbiology China, 2021, 48(4): 1 093-1 105. [25] 张传更, 高阳, 张立明, 等. 水分管理措施对施用有机肥麦田土壤酶活性和微生物群落结构的影响[J]. 灌溉排水学报, 2018, 37(2): 38-44. ZHANG Chuangeng, GAO Yang, ZHANG Liming, et al. Effects of water management on soil enzyme activitiesand microbial community structure in wheat fields with organic fertilizer application[J]. Journal of Irrigation and Drainage, 2018, 37(2): 38-44. [26] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 274-340. Guan Songyin. Soil enzymes and their research methods [M]. Beijing: China Agriculture Press, 1986: 274-320. [27] 李宽莹, 王泽林, 徐兴有, 等. 不同施肥处理对日光温室内土壤微生物数量与酶活性的影响[J]. 西北林学院学报, 2019, 34(2): 56-61. LI Kuanying, WANG Zelin, XU Xingyou, et al. Effects of fertilization pattern on soil microorganism quantity and soil enzyme activity under the greenhouse grape-cultivating system[J]. Journal of Northwest Forestry University, 2019, 34(2): 56-61. [28] 陈明, 朱建雯, 盛建东, 等. 塔河中游柽柳灌丛土壤酶活性及微生物数量变化的研究[J]. 西南农业学报, 2008, 21(1): 103-109. CHEN Ming, ZHU Jianwen, SHENG Jiandong, et al. Study on soil enzyme activities and soil microorganisms under canopy of Tamarix spp. shrubs at Tarim Middle River[J]. Southwest China Journal of Agricultural Sciences, 2008, 21(1): 103-109. [29] 樊利华, 周星梅, 吴淑兰, 等. 干旱胁迫对植物根际环境影响的研究进展[J]. 应用与环境生物学报, 2019, 25(5): 1 244-1 251. FAN Lihua, ZHOU Xingmei, WU Shulan, et al. Research advances on the effects of drought stress in plant rhizosphere environments[J]. Chinese Journal of Applied and Environmental Biology, 2019, 25(5): 1 244-1 251. [30] 周来良. 干旱对根际土壤酶、氮磷钾及根部有机酸的影响[D]. 重庆: 西南大学, 2009. ZHOU Lailiang. Effects of drought stress on rhizosphere enzyme, N, P, K and root organic acid[D]. Chongqing: Southwest University, 2009. [31] WANG R Z, DORODNIKOV M, YANG S, et al. Responses of enzymatic activities within soil aggregates to 9-year nitrogen and water addition in a semi-arid grassland[J]. Soil Biology and Biochemistry, 2015, 81: 159-167. [32] 张乃莉, 郭继勋, 王晓宇, 等. 土壤微生物对气候变暖和大气N沉降的响应[J]. 植物生态学报, 2007, 31(2): 252-261. ZHANG Naili, GUO Jixun, WANG Xiaoyu, et al. Soil microbial feedbacks to climate warming and atmospheric n deposition[J]. Journal of Plant Ecology, 2007, 31(2): 252-261. [33] 刘方春, 邢尚军, 马海林, 等. 干旱生境中接种根际促生细菌对核桃根际土壤生物学特征的影响[J]. 应用生态学报, 2014, 25(5): 1 475-1 482. LIU Fangchun, XING Shangjun, MA Hailin, et al. Effects of inoculating plant growth-promoting rhizobacteria on the biological characteristics of walnut(Juglans regia) rhizosphere soil under drought condition[J]. Chinese Journal of Applied Ecology, 2014, 25(5): 1 475-1 482. [34] 王义祥, 任丽花, 翁伯琦, 等. 土壤干旱胁迫对圆叶决明土壤微生物的生态效应[J]. 厦门大学学报(自然科学版), 2005, 44(S1): 66-68. WANG Yixiang, REN Lihua, WENG Boqi, et al. Ecological effect of drought stress on microbial groups in the soil with chamaecrista rotundifolia[J]. Journal of Xiamen University (Natural Science), 2005, 44(S1): 66-68. [35] 高彦婷, 黄珍, 张芮, 等. 单生育期水分胁迫对温室葡萄根际土壤酶活性及微生物群落的影响[J]. 干旱地区农业研究, 2021, 39(3): 59-68. GAO Yanting, HUANG Zhen, ZHANG Rui, et al. Effects of water stress during single growth period on soil enzyme activities and microbial communities in the rhizosphere of greenhouse grape[J]. Agricultural Research in the Arid Areas, 2021, 39(3): 59-68. [36] PEIFFER J A, SPOR A, KOREN O, et al. Diversity and heritability of the maize rhizosphere microbiome under field conditions[J]. PNAS, 2013, 110(16): 6 548-6 553. [37] HAYDEN H L, SAVIN K W, WADESON J, et al. Comparative metatranscriptomics of wheat rhizosphere microbiomes in disease suppressive and non-suppressive soils for rhizoctonia solani AG8[J]. Frontiers in Microbiology, 2018, 9: 859. [38] 孔钰凤. 野生和栽培大豆根际微生物对干旱胁迫的响应及反馈[D]. 哈尔滨: 中国科学院大学(中国科学院东北地理与农业生态研究所), 2017. KONG Yufeng. The feedback and response of rhizospheric microbial communities of wild and cultivated soybean to drought stress[D]. Harbin: Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, 2017. [39] 邱丽丽, 张佳宝, 赵炳梓. 土壤干旱对两品种小麦根际土壤微生物群落组成和酶活性的影响[J]. 干旱区资源与环境, 2022, 36(2): 116-122. QIU Lili, ZHANG Jiabao, ZHAO Bingzi. Effect of soil drought on microbial community composition and enzyme activities in the rhizosphere soils growing two wheat cultivars[J]. Journal of Arid Land Resources and Environment, 2022, 36(2): 116-122. [40] ZHAO Y N, MAO X X, ZHANG M S, et al. Response of soil microbial communities to continuously mono-cropped cucumber under greenhouse conditions in a calcareous soil of North China[J]. Journal of Soils and Sediments, 2020, 20(5): 2 446-2 459. [41] NAYLOR D, COLEMAN-DERR D. Drought stress and root-associated bacterial communities[J]. Frontiers in Plant Science, 2018, 8: 2 223. [42] 彭有才, 刘挺, 赵俊杰, 等. 连作对土壤性状影响的研究进展[J]. 江西农业学报, 2009, 21(9): 100-103. PENG Youcai, LIU Ting, ZHAO Junjie, et al. Research advances in effect of continuous cropping on soil characteristics[J]. Acta Agriculturae Jiangxi, 2009, 21(9): 100-103. [43] 刘泽. 中国被孢霉属及近缘属的分类与分子系统发育研究[D]. 北京: 北京林业大学, 2020. LIU Ze. Studies on the taxonomy and molecular phylogeny of mortierella and allied genera in China[D]. Beijing: Beijing Forestry University, 2020. Effect of Water Stress on Microbial Community and Diversity in the Rhizosphere of Winter Wheat ZHANG Jiangwei, XUE Jiaxin, LI Hui, CHAI Xiaotian, ZHAO Shuai, LI Liwei, ZHANG Sijia, JIA Lijuan, ZHANG Jianheng*, WANG Guiyan* (College of Agronomy, Hebei Agricultural University, State Key Laboratory of North China Crop Improvement and Regulation, Key Laboratory of Water-saving Agriculture in North China, Ministry of Agriculture and Rural Affairs, P. R. China, Baoding 071000, China) 【Objective】Winter wheat at anthesis stage is sensitive to water stress and in this paper, we elucidate how enzymatic activity, microbial community and diversity in its rhizosphere respond to change in water stress.【Method】The cultivar Jimai 22 was used as the model plant; we compared three water stresses: mild water stress (L), moderate water stress (M), and severe water stress (S), all occurring at the flowering stage. Sufficient irrigation was taken as the control (CK). In each treatment, we sampled the rhizosphere soil and then measured the enzymatic activities, microbial community and diversity in each sample using the Illumina high-throughput sequencing technology. 【Result】Compared with CK, mild water stress increased and the severe water stress reduced the activity of sucrase, both at significant level, while the activity of the alkaline phosphatase remaining unchanged in the treatments. Water stress affected the diversity index of bacteria and fungi differently. Compared with CK, water stress reduced the Shannon index of bacteria significantly, while the Shannon index of fungi decreased significantly only under severe water stress. ACE, Chao1 and Simpson diversity indices of bacteria and fungi showed significant change only under severe water stress. It was found that water stress increased the relative abundance of,and(<0.05). The abundance of,,,,,,andvaried with water stress. The relative abundance ofandwas higher in CK, while the relative abundance ofin the mild water stress was significantly higher than that in CK. Severe water stress significantly increased the abundance ofand, while reducing the abundance of. Redundancy analysis showed that soil water content and the activity of sucrose enzyme were negatively correlated with bacterial communities of,,,,,,and(<0.01), and were positively correlated withand. 【Conclusion】Mild water stress at flowering stage increased the activity of sucrase in the rhizosphere of winter wheat. Water stress altered microbial community and diversity, the activity of sucrose enzymes, and the relative abundance of dominant bacteria and fungi in the rhizosphere. winter wheat; water stress; soil enzymatic activity; soil microbial community structure and diversity 张江伟, 薛佳欣, 李慧, 等. 小麦根际微生物群落结构和多样性对水分胁迫的响应[J]. 灌溉排水学报, 2022, 41(10): 41-50. ZHANG Jiangwei, XUE Jiaxin, LI Hui, et al. Effect of Water Stress on Microbial Community and Diversity in the Rhizosphere of Winter Wheat[J]. Journal of Irrigation and Drainage, 2022, 41(10): 41-50. 1672 - 3317(2022)10 - 0041 - 10 S365;S154.3 A 10.13522/j.cnki.ggps.2022116 2022-01-16 “十三五”国家粮食丰产增效科技创新专项(2018YFD0300504) 张江伟(1994-),男。硕士研究生,主要从事节水种植制度研究。E-mail: 1486141089@qq.com 王贵彦(1971-),女。教授,硕士生导师,主要从事集约持续农作制度研究。E-mail: wanggy@hebau.edu.cn 张建恒(1970-),男。副研究员,硕士生导师,主要从事农业生态环境研究。E-mail: nxyzjh@hebau.edu.cn 责任编辑:韩 洋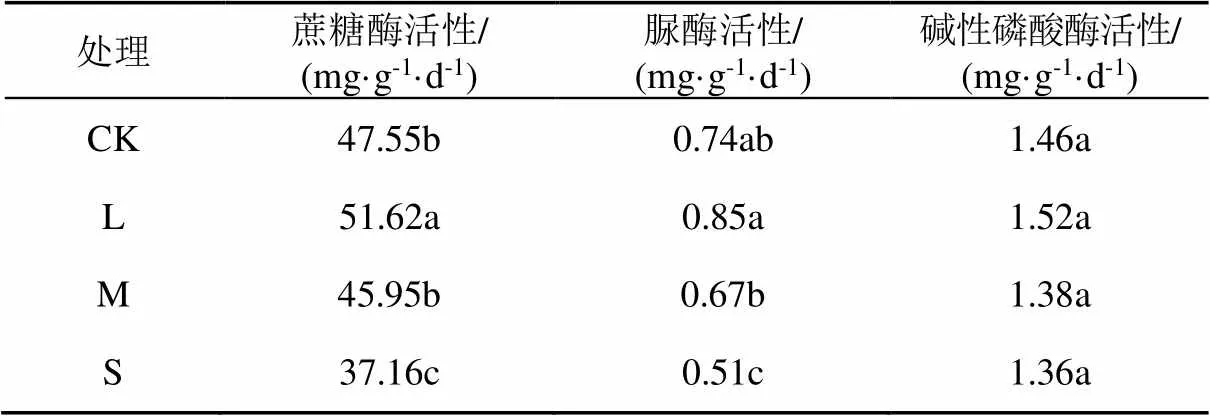

2.3 干旱胁迫对小麦根际土壤微生物类群的相关分析
2.4 根际土壤微生物主成分分析
2.5 水分胁迫对小麦根际土壤微生物群落结构及物种差异的影响

2.6 土壤微生物群落与土壤环境因子的相关性

3 讨论
4 结论
