小麦苗期盐胁迫下DREB基因的表达
2022-11-09魏爱丽张晓军畅志坚乔麟轶
张 蕾,魏爱丽,张晓军,畅志坚,乔麟轶*
(1 太原师范学院 生物系,山西晋中 030619;2 山西农业大学 农学院/作物遗传与分子改良山西省重点实验室, 太原 030031)
土壤盐渍化是威胁农业生产的主要非生物胁迫之一。全世界近10亿hm2土地受到不同程度的盐渍化影响,中国盐渍土面积达1亿hm2,且受灾面积逐年增加[1-2]。过多的土壤盐分会对农作物造成渗透胁迫和离子毒害,引起植株生理干旱和代谢紊乱而导致减产[2]。发掘耐盐相关基因、选育抗逆品种是缓解土壤盐害和保障粮食安全最为经济、有效的措施。
近年来,植物中报道了多种盐胁迫响应基因,并被提出可用于改善作物的耐盐性[3-5]。其中,脱水反应元件结合蛋白(dehydration responsive element binding,DREB)是一类响应逆境胁迫的重要转录因子,可通过结合DRE/CRT顺式元件进一步调控RD29(responsive to desiccation)[6]、GLOS(galactinol synthase)[7]和CKX(cytokinin oxidases/dehydrogenases)[8]等下游靶基因的表达,进而提高对不良环境的耐受能力。在拟南芥中,DREB家族包含1个AP2结构域,并且其第14位和第19位氨基酸分别是缬氨酸(14-V)和谷氨酸(19-E)[9],部分DREB蛋白可被RING型E3连接酶结合并移至泛素途径降解[10]。1999年,拟南芥AtDREB1A最先被证实受盐胁迫后上调,过表达植株对NaCl的耐受性增强[11],其表达水平还受其他DREB蛋白[12]或MYB[13]等上游转录因子的抑制。之后,水稻[14]、大豆[15]、玉米[16]等作物中的耐盐DREB基因也陆续被鉴定。
小麦是全球种植面积最广的粮食作物,目前小麦中已有9个DREB基因被鉴定功能[17-22],其中3个基因TaDREB1、Wdreb2和TaDREB3-AI与盐胁迫相关。TaDREB1在小麦苗期受NaCl处理后表达水平上调[23],但也有研究显示TaDREB1的表达水平与苗期耐盐表型无关[24],而在萌发期受到盐胁迫后,小麦种子中只检测到TaDREB1-D的表达水平[25];Wdreb2的表达受盐胁迫诱导,并且其转录水平和可变剪切均受到盐胁迫的调控[24,26];TaDREB3-AI也受盐胁迫诱导,过表达TaDREB3-AI的拟南芥植株耐盐性增强[27]。除此以外,小麦其余DREB基因受盐胁迫后的响应情况暂无报道。
本研究对1份小麦耐盐材料进行转录组测序,根据转录组数据和qRT-PCR,分析小麦DREB基因受盐胁迫诱导后表达水平和转录剪切的变化情况,并对其靶基因进行预测,以期发掘盐胁迫响应基因,为后续功能验证或耐盐分子育种提供参考信息。
1 材料和方法
1.1 植物材料
耐盐小麦材料CH7034由山西农业大学(原山西省农业科学院)畅志坚研究员选育[28],用于盐胁迫处理、转录组测序以及qRT-PCR。
1.2 方 法
1.2.1 盐胁迫处理将小麦种子用1%的双氧水消毒后放置于培养皿中萌发,待胚根伸长至2~3 cm时,选择长势一致的种子转移到培养箱中的1/2霍格兰氏营养液中生长,参数设置为16 h光照/8 h黑暗,24 ℃/16 ℃;待幼苗生长至3叶期时更换含250 mmol·L-1NaCl的1/2霍格兰氏营养液进行盐胁迫,在0、1、6和24 h时剪取幼苗根,于-80 ℃保存。
1.2.2 转录组测序与数据处理将盐胁迫处理前后的根组织送北京百迈客生物科技有限公司构建cDNA文库,库检合格后用Illumina平台进行测序。将质检过滤后的测序数据比对小麦品种‘中国春’参考基因组IWGSCv1.1 (http://wheat-urgi.versailles.inra.fr/)获得具有基因注释信息的序列;利用TopHat+Cufflinks+edgeR[29-30]方法获得上述注释序列在不同处理时间点的表达水平值,并以|log2(FPKMt/FPKMt0)|≥1为标准筛选差异表达基因(differentially expressed genes,DEGs),相关结果用Circos[31]输出。基于百迈客云服务器工具(https://international.biocloud.net/)获得上述DEGs的可变剪接情况和GO富集信息;利用PlantCARE工具[32]分析DEGs起始密码子上游2 000 bp序列中的DRE/CRT等顺式作用元件。
1.2.3 序列分离与分析利用AP2超家族的隐马尔可夫模型文件(编号PF00847.20,下载自Pfam数据库,http://pfam.xfam.org/)在nhmmer软件(https://www.mankier.com/1/nhmmer)中检索普通小麦品种‘中国春’IWGSCv1.1注释蛋白序列 (下载自URGI数据库,http://wheat-urgi.versailles.inra.fr/),获得包含AP2结构域的小麦序列,从结果中进一步筛选包含DREB家族特征(14-V和19-E)的序列作为小麦DREB序列;根据小麦DREB编码序列检索转录组测序数据中的Mapped Data,获得对应的表达水平值、可变剪接情况和起始密码子上游2 000 bp序列中的顺式作用元件信息。利用MEGA6.0[33]构建系统发育树。利用STRING工具[34]预测蛋白互作。
1.2.4 qRT-PCR利用RNA提取试剂盒(北京天漠,TR205-200)提取样品总RNA,用反转录试剂盒(大连宝生物, RR047A)将总RNA反转录为cDNA。根据CH7034盐胁迫转录组结果选择差异表达的TaDREB成员,在A/B/D组间的保守序列设计定量引物,引物信息列于表1。在ABI QuantStudio5 PCR仪上进行qRT-PCR,使用的酶为Premix Ex TaqⅡ(大连宝生物, RR820A),内参基因为小麦GADPH,每反应重复3次,参考2-ΔΔCT法[35]分析结果。

表1 用于qRT-PCR的引物
2 结果与分析
2.1 小麦DREB基因分布
从‘中国春’小麦蛋白库中检索出559条包含AP2结构域的序列,从中进一步筛选结构域第14位和第19位氨基酸分别是缬氨酸V和谷氨酸E的序列,最终获得204条DREB序列,分布于小麦21条染色体。其中,在小麦A、B、D亚基因组中的数目为65、66和73,在第1至第7同源群分布数目依次为21、31、12、12、62、41和25。根据亚基因组同源关系将其归为48个成员,根据在1~7号染色体上的物理排列顺序对其依次编号(图1,图2),命名为TaDREB1~TaDREB48。分析结果显示,TaDREB11、TaDREB12、TaDREB25、TaDREB32、TaDREB41和TaDREB43-D经历过串联重复事件,TaDREB25重复次数最多,在A/B/D亚基因组中形成3个分别包含17、17和20个DREB序列的基因簇。序列分析表明,TaDREB3是已报道的小麦耐盐基因Wdreb2[26]和TaDREB3-AI[27],TaDREB16是耐盐基因TaAIDFa[17]、TaDREB1[25],而成员TaDREB17、TaDREB21、TaDREB24、TaDREB25.9、TaDREB35、TaDREB41和TaDREB42则是已知耐寒、耐旱等其他抗逆基因[17-22](图1)。

*表示串联重复基因,灰色表示本研究中受NaCl胁迫处理后转录水平无显著变化的基因;小麦中已报道的耐盐和其他抗逆DREB基因分别用方框和下划线表示[17-27]
2.2 盐胁迫下TaDREBs转录水平变化
多重序列比对结果将TaDREB家族分为14组(G1~G14,图2)。CH7034转录组测序结果显示,位于G2、G5、G10和G14的TaDREB成员受NaCl胁迫1、6和24 h后转录水平均无显著变化,其余组中共有25个TaDREB成员表现出对盐胁迫不同程度地响应。其中,有8个成员(TaDREB3、TaDREB6、TaDREB19、TaDREB21、TaDREB23、TaDREB31、TaDREB37和TaDREB41)在盐胁迫后持续上调,而有3个成员(TaDREB25、TaDREB35和TaDREB44)表现为持续下调(图2)。总体来看,每条染色体上均有响应盐胁迫的DREB基因(图1)。
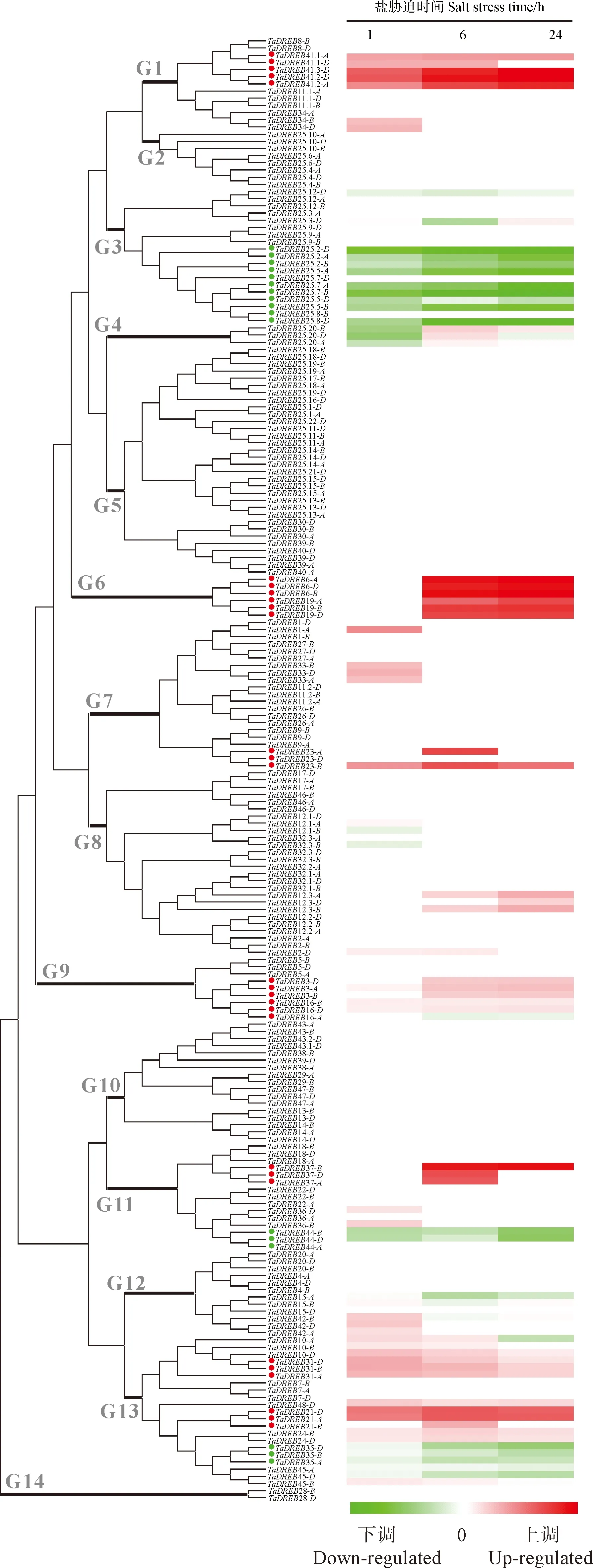
基因在0、1和24 h均缺失转录数据表示其在取样时期不表达;圆形标签标注的基因用于qRT-PCR验证
2.3 盐胁迫下TaDREB可变剪切变化
对TaDREB家族受盐胁迫后的可变剪切情况进行分析,结果如图3所示,48个TaDREB成员中有9个成员的可变剪切数目受盐处理后发生了变化。TaDREB3和TaDREB16的B基因组拷贝可变剪切数目分别表现出持续降低和持续升高的趋势,其余亚基因组拷贝的剪切变化则无明显规律;TaDREB6、TaDREB19和TaDREB21在胁迫前均无可变剪切,受盐胁迫后A基因组拷贝均发生了2次剪切事件;类似的还有TaDREB24和TaDREB25.12,在胁迫后其B/D组和D组拷贝分别产生了可变剪切;剩余的TaDREB43和TaDREB47在胁迫前后的剪切变化无明显规律。
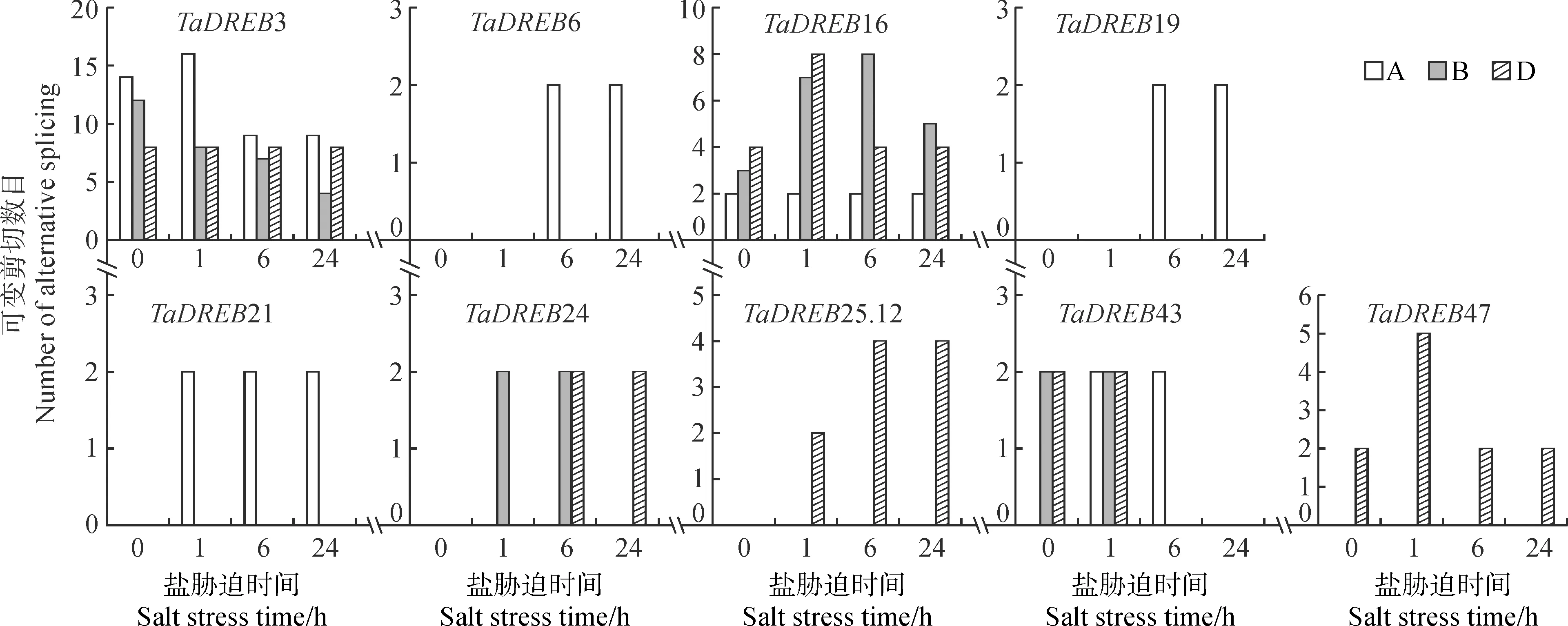
图3 NaCl处理后可变剪切发生变化的TaDREB成员
2.4 TaDREB盐胁迫相关靶基因预测
从转录组测序结果中筛选出4 189个受盐胁迫后1、6和24 h持续上调或下调的DEGs,从中进一步鉴定出2 354个起始密码子上游2 000 bp区含有DRE/CRT元件的DEGs,GO富集结果将其划分为生物学过程、细胞组分和分子功能3大类(图4,A)。在生物学过程类别中,属于刺激响应(response to stimulus)和代谢过程(metabolic process)的基因最多,分别富集到203和109个;在细胞组分类别中,属于膜组分(membrane part)和膜(membrane)的基因最多,分别为380和239个;在分子功能类别中,较多的基因种类有催化活性(catalytic activity)、结合(binding)、抗氧化活性(antioxidant activity)和转录因子活性(transcription factor activity),数目分别为532、349、324和198个。
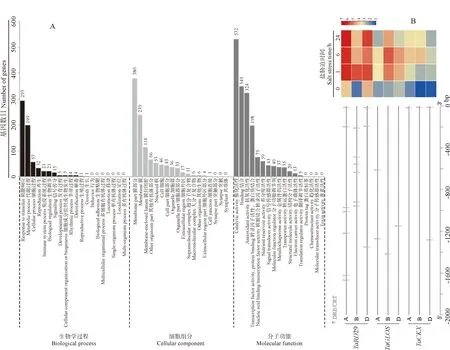
A.启动子区含DRE/CRT元件的DEGs的GO富集结果;B.3个预测靶基因的起始密码子上游2 000 bp序列中DRE/CRT元件以及基因对盐胁迫的响应。标尺为起始密码子上游序列长度(5′-3′方向),图例为顺式作用元件
根据GO注释信息,从中选出分别与已报道RD29、GLOS和CKX编码结构相似的3类DEGs,每类再选择响应盐胁迫程度最大、且在A/B/D亚基因组中表达趋势一致的基因(暂命名为TaRD29、TaGLOS和TaCKX)作为TaDREB的候选靶基因(图4,B)。
2.5 盐胁迫响应TaDREB及其预测靶基因的验证
基于上述分析结果,我们将盐胁迫后转录水平持续上调的8个成员(TaDREB3、TaDREB6、TaDREB19、TaDREB21、TaDREB23、TaDREB31、TaDREB37和TaDREB41)和持续下调的3个成员(TaDREB25、TaDREB35和TaDREB44),以及TaDREB16(即已知耐盐基因TaAIDFa/TaDREB1)和3个预测靶基因(TaRD29、TaGLOS和TaCKX)进行qRT-PCR验证。结果如图5所示,上调成员中,TaDREB19在盐处理1 h的表达量略有下降,之后持续上升;其余成员以及TaDREB16均表现出持续上升趋势。而在下调成员中,只有TaDREB25和TaDREB35的表达量呈现下降趋势,而TaDREB44的表达水平变化则没有明显规律。3个预测靶基因的表达量均持续上升,与转录组测序结果一致。
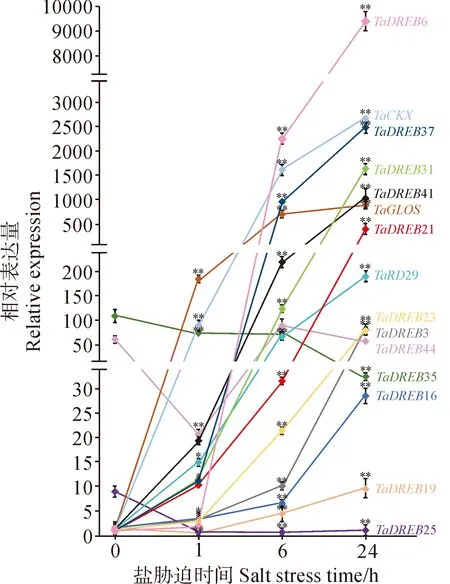
t检验用于检测基因在1/6/24 h和0 h的表达量之间的差异程度,*和**分别表示显著(P<0.05)和极显著差异(P<0.01)
2.6 盐胁迫下调TaDREB成员分析
进一步分析了盐胁迫后下调成员TaDREB25和TaDREB35的起始密码子上游2 000 bp序列,该区段包含DREB和MYB的结合位点(图6,A),猜测这2个成员的表达可能受到转录因子的抑制。接着对其编码蛋白的降解可能性进行分析,从转录组结果中调取了209个GO注释为RING型E3泛素连接酶(RE3L)的序列,将这些序列的编码蛋白与TaDREB25和TaDREB35的编码蛋白进行互作预测。结果未检测到TaDREB25的互作蛋白,与TaDREB35可能存在互作则有11个RE3L序列,属于4个基因RE3L1~4的不同亚基因组拷贝(图6,B),而RE3L1~4是小麦中与拟南芥DREB降解蛋白AtDRIP1序列相似度最高的蛋白(图6,C)。其中RE3L1的A/B/D亚基因组拷贝受盐胁迫后均显著上调(图6,D),推测TaDREB35可能会被RE3L1结合后经泛素途径降解。
3 讨 论
3.1 TaDREB受盐胁迫后的响应模式
基因转录水平变化是植物受非生物胁迫后发生的主要响应事件之一,并引起一系列植株生理和生化反应[36]。本研究分离的48个TaDREB家族成员在受NaCl处理后,表现出不同的表达响应模式。首先,23个(48%)TaDREB成员的转录水平没有发生变化,这种模式常见于成员众多的基因家族中,部分成员会逐渐退化或维持低转录水平,或者只在特定时空或受到特定胁迫后转录,以减少功能冗余[37]。本研究中该模式在部分旁系基因对(paralog pair)中也有出现,例如G1中的TaDREB8(不响应)-TaDREB41(响应)、TaDREB11(不响应)-TaDREB34(响应)和G11中的TaDREB18(不响应)-TaDREB37(响应);其次,结合qRT-PCR验证结果,在胁迫后有9个成员表达量持续上升、2个成员持续下降。这11个(23%)成员的亚基因组拷贝表现出一致的转录变化趋势,表明这些拷贝受到共同的调控网络控制,该比例与六倍体小麦中亚基因组协同表达模式基因的总比例(28%)[38]接近;最后,剩余基因成员的不同亚基因组拷贝对盐胁迫表现出不同程度的转录水平变化,最近有研究将这种模式定义为表达失调(dysregulation),基因A/B/D不同拷贝间的这种表达量差异可能会对农艺性状产生影响[39];其中2个成员TaDREB12和TaDREB32是经历过串联重复的基因簇,除了显示盐胁迫后表达失调以外,还发生了重复成员表达沉默和亚基因组拷贝停止响应的情况。
3.2 盐胁迫相关TaDREB可能的分子机制
在鉴定出的11个盐胁迫响应成员中,TaDREB6、TaDREB19和TaDREB21的A基因组拷贝在NaCl处理6 和24 h产生了新的可变剪切,发生位置均为调控位点较多的TSS(transcription start site)和TTS(transcription terminal site)。TaDREB3和TaDREB16则发生了更多的剪切事件,其中TaDREB3与已报道Wdreb2受盐胁迫后剪切变化情况类似[26],这些可变剪切可能是造成上述5个基因表达水平上调的原因。此外,bHLH等转录因子也会造成DREB基因的上调[40];而某些DREB或MYB则会抑制DREB的转录[12-13],造成基因表达量降低。本研究中TaDREB25和TaDREB35在盐胁迫后下调,可能也受到了上游转录因子的负调控,其具体的生物学意义暂时无法得知,初步猜测这2个TaDREB成员与拟南芥AtDREB2A[41]类似,在逆境响应通路中起负调控作用,或者其调控的下游生理生化反应不利于植株在逆境下生存,因此在受到非生物胁迫后,其表达被抑制。其中,TaDREB35的编码产物还可能会被泛素途径降解;而TaDREB35即已报道的耐旱相关基因TaWXPL2[21],TaWXPL2在脱水条件下的叶片中上调,但在某些品种中或受到重度干旱胁迫后也表现为下调,表明该基因的表达会受材料遗传背景、非生物胁迫种类或胁迫程度等因素的影响。
作为转录因子,DREB会调控下游靶基因进而激活一系列抗逆反应来应对外界胁迫。本研究筛选出2 354个启动子区含有DRE/CRT元件的、与TaDREB共表达的DEGs作为候选靶基因库,富集到较多基因的类别有:生物学过程中的刺激响应和代谢过程、细胞组分中的膜组分、分子功能中的催化活性、结合、抗氧化活性和转录因子活性等。该结果与已知的耐盐下游通路反应一致,如合成大量脯氨酸等有机物以提高原生质渗透压、强化膜蛋白功能以将过多Na+排出或隔离到液泡、提高细胞对过氧化物的清除能力以缓解胁迫造成的损害等[42]。
3.3 盐胁迫响应上调成员TaDREB21
在TaDREB成员中,TaDREB21在耐盐品系CH7034受胁迫前后的转录水平差异显著,qRT-PCR结果证实TaDREB21在受到NaCl处理1、6、24 h后表达水平显著上调;此外,CH7034的耐盐性由多个QTL共同调控[28],而TaDREB21的B基因组拷贝 (4B:541.9 Mb)位于耐盐位点QSI.sxau_4B.2 (4B:445.1~624.5 Mb)区段内,这些结果表明TaDREB21可能在小麦抗逆信号通路中发挥作用。接下来将利用遗传转化等技术验证TaDREB21的功能,如最终证实其耐盐性,可将TaDREB21以及CH7034用于小麦品种改良。
目前在中国盐碱地区小麦生产中,除了利用栽培技术提升产量以外[43],选育并推广耐盐品种已逐渐成为主要措施,展示出广阔前景。DREB基因已被开始用于小麦耐盐性改良,转入大豆GmDREB1的小麦品种‘鲁麦22’和‘济麦19’均表现出很好的耐盐性[44-45]。本研究鉴定的TaDREB21等11个小麦盐胁迫响应DREB成员经过进一步功能验证后,将为小麦抗逆分子育种提供候选基因。
