美洲商陆PaENO基因克隆及其表达分析
2022-11-09朱畇昊宋梦瑶冯卫生郑晓珂
赵 乐,朱畇昊,许 姣,宋梦瑶,冯卫生,郑晓珂*
(1 河南中医药大学 药学院,郑州 450046;2 呼吸疾病中医药防治省部共建协同创新中心,郑州 450046)
烯醇化酶(enolase,ENO)是糖酵解途径的一个关键酶,能够催化2-磷酸甘油酸(2-phosphoglycerate,2-PGA)转变为磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)的可逆反应。烯醇化酶广泛存在于原核和真核生物中,氨基酸序列保守程度较高,参与生物体内的能量代谢,而且是细胞中含量最丰富的胞质蛋白之一[1]。人体内有3种烯醇化酶,分别是α、β、γ-ENO,其中α-ENO普遍分布在各个组织,β-ENO主要存在于肌肉组织,γ-ENO只分布在神经组织[2],其中对α-ENO研究较为深入,除了具有糖酵解的酶活性以外,α-ENO还与多种疾病的发生有关,如癌症、自身免疫性疾病、缺血和细菌感染等[3]。在拟南芥中也有3种烯醇化酶AtENO1、AtENO2(LOS2)和AtENO3(AtENOC),其中AtENO2与人的α-ENO相似性较高,都含有烯醇化酶N端保守结构域和DNA结合区[4]。
近年来,在植物中的研究表明,ENO除了作为一种糖酵解的酶,在植物的生长发育以及应对非生物胁迫过程也发挥重要作用。敲除拟南芥AtENO2基因,会导致细胞变小和细胞分化缺陷,使根、芽和维管等组织的发育出现障碍、花器官形成受到损伤[1, 5]。AtENO2还能够以转录因子的形式调控STZ/ZAT10基因的表达,参与植物应对低温胁迫[6]。植物蛋白质组学分析也发现,ENO在多种植物中参与逆境胁迫,如盐胁迫、干旱和冷胁迫,在受到干旱胁迫时玉米中ENO活性和mRNA的转录水平都明显上升,蛋白表达水平也升高[7],镉(cadmium,Cd)胁迫处理后,酵母和拟南芥中ENO蛋白的表达丰度显著提高[8]。
美洲商陆(PhytolaccaamericanaL.)又名垂序商陆,是商陆科商陆属多年生草本植物,对重金属锰(manganese,Mn)和Cd具有超富集作用[9],是一种比较理想的可用于植物修复的超富集植物[10]。前期美洲商陆应答Cd胁迫的蛋白质组学和转录组学结果研究表明,Cd处理后PaENO蛋白的表达水平显著升高,Western blot的结果也表现出相同的趋势[11-12],说明PaENO可能参与美洲商陆应对Cd胁迫。本研究从美洲商陆叶中克隆了PaENO基因,进行了序列分析、原核表达与纯化、表达模式以及抗Cd分析,为今后研究PaENO基因在美洲商陆应对Cd胁迫过程中的分子机制奠定了基础。
1 材料和方法
1.1 材料及处理
美洲商陆种子采自河南省中药植物园,根据河南中医药大学生物制药工程实验室前期报道方法[12],种子分别用98%硫酸和70%乙醇进行表面消毒各15 min,再用无菌水漂洗3次,然后将种子放置于1/2 MS培养基上,在人工气候箱中生长,培养条件为光照16 h、23 ℃,黑暗8 h、20 ℃。3周后种子萌发长成幼苗,将幼苗转移到含1/2 Hoagland营养液的培养瓶中继续生长,每2 d更换1次营养液。培养3周后,美洲商陆幼苗长出2片子叶和6片真叶,在Hoagland营养液加入400 μmol/L CdCl2,进行Cd胁迫处理,对照和处理都有3个独立的生物学重复,然后分别在Cd处理0、2、12、24 h采集美洲商陆幼苗的根、茎、叶等组织,用于RNA的提取。
1.2 方 法
1.2.1PaENO基因克隆使用植物总RNA提取试剂盒(天根)提取美洲商陆根、茎、叶的总RNA,经检测完整后,使用TransScriptⅡ反转录酶试剂盒(全式金)提取得到的美洲商陆根、茎、叶组织的总RNA为模板,Oligo(dT)20为引物,反转录得到美洲商陆各组织的cDNA。
根据河南中医药大学生物制药工程实验室获得的美洲商陆转录组数据(SRA No. SRP105831),设计1对特异性引物PaENO-F(ATGGTTACCATCAAGTGCGTCAAAG)和PaENO-R(TTAGTAGGGCTCAACAGGCTGG),用PrimerSTAR HSTaq(TaKaRa)扩增PaENO基因,PCR程序为:95 ℃ 2 min;95 ℃ 10 s,59 ℃ 15 s,72 ℃ 1 min 30 s,35个循环;72 ℃延伸8 min。PCR结束后,在反应体系中加入rTaq(TaKaRa),在72 ℃反应10 min进行平末端加A反应,然后进行琼脂糖凝胶电泳检测,回收纯化与目的基因大小一致的条带,进行T-A克隆,将其连接到pMD19-T载体上,转化Trans5α感受态细胞,挑单克隆进行菌落PCR鉴定,阳性克隆进行测序。
1.2.2PaENO基因的序列分析利用NCBI blastx,将PaENO的基因序列与nr(non-redundant)数据库进行序列比对。用DNAMAN 6.0将PaENO蛋白与其他植物的ENO蛋白进行氨基酸序列比对,使用ProtParam tool预测PaENO蛋白的理化性质,用InterPro Scan分析PaENO蛋白的保守结构域,用SWISS-MODEL预测PaENO蛋白的三维结构,使用TargetP 1.1、SignalP 5.0和TMHMM 2.0等软件分别预测PaENO蛋白的亚细胞定位、信号肽和跨膜域,利用MEGA 7软件 NJ(Neighbor-Joining)法构建系统进化树。
1.2.3PaENO基因的原核表达和纯化根据PaENO基因的序列信息,选择合适的酶切位点,将其连接到原核表达载体pET-28a上,设计1对原核表达引物PaENO-Exp-F(CGGAATTCATGGTTACCATCAAGTGCG,划线序列为EcoRⅠ酶切位点),PaENO-Exp-R(CCGCTCGAGTTAGTA-GGGCTCAACAGGC,划线序列为XhoⅠ酶切位点),以1.2.1中测序正确的pMD19-T-PaENO质粒为模板,用PrimerSTAR HSTaq(TaKaRa)扩增PaENO基因的ORF序列,PCR程序为:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 15 s,72 ℃ 1 min 30 s,30个循环;72 ℃延伸8 min。经电泳检测回收PCR产物,然后用EcoRⅠ和XhoⅠ对原核表达载体pET-28a和PCR回收产物进行双酶切,双酶切完成后回收载体和目的基因,用T4DNA 连接酶在16 ℃过夜连接载体和目的基因,然后取连接产物转化BL21(DE3)感受态细胞,挑单克隆进行菌液PCR和双酶切鉴定,将鉴定正确的单克隆送上海生工进行测序。
将测序正确的单克隆接种到LB液体培养基中过夜培养,根据生物制药工程实验室已发表的诱导纯化方法[13],加入IPTG使其终浓度为0.4 mmol/L,然后在28 ℃、150 r/min条件下诱导PaENO蛋白的表达,用SDS-PAGE 检测目的蛋白的表达。用Ni亲和层析试剂盒(康为世纪)纯化目的蛋白,然后用含不同浓度咪唑(50、100、200、300、400和500 mmol/L)的缓冲液梯度洗脱目的蛋白,经SDS-PAGE检测后,收集含有单一条带的蛋白样品进行透析和超滤。
1.2.4PaENO基因表达模式分析将美洲商陆各组织的cDNA稀释10倍,作为实时荧光定量PCR(qRT-PCR)的模板,以美洲商陆的α-TUBLIN基因[12,14]作为内参基因(α-TUBLIN-qF:ATTGG-GTAGATTGCCAGGAG和α-TUBLIN-qR:AG-TTTGTGGACTGGTGCTCCAC),检测PaENO基因在美洲商陆根、茎、叶等组织中的表达,以及在Cd处理0、2、12和24 h叶片中的表达。PaENO基因的qRT-PCR引物为PaENO-qF(AGAGTCCAAAAGGCCATCGA)和PaENO-qR(CCACAGAAAGGTCAGCGATG)。每个样品重复3次,在ABI QuantStudio 5 实时荧光定量PCR系统进行分析。qRT-PCR的反应体系为:cDNA模板2 μL,正反向引物各0.8 μL,2×TransStartTop Green qPCR SuperMix (TransGen) 10 μL,加ddH2O至20 μL,反应程序设定为:94 ℃ 30 s;94 ℃ 5 s,56 ℃ 15 s,72 ℃ 30 s,40个循环,用ABI Q5系统自带软件,采用2-ΔΔCT方法进行基因相对表达量的分析。
1.2.5 大肠杆菌抗Cd分析为了检测PaENO对Cd的抗性,将含有pET-28a和pET28a-PaENO质粒的大肠杆菌BL21 (DE3)菌株,在37 ℃、200 r/min条件下过夜培养,然后将其稀释到OD600为0.1,在LB液体培养基中加入IPTG(终浓度为0.4 mmol/L)和CdCl2(终浓度为1 mmol/L),每隔1 h在600 nm处测定吸光度,检测大肠杆菌在Cd胁迫条件下的生长速率。同时各取100 μL含有pET-28a和pET28a-PaENO质粒的大肠杆菌,均匀涂布在LB固体培养基上(含有0.4 mmol/L IPTG和1 mmol/L CdCl2),在37 ℃培养48 h,观察大肠杆菌在Cd胁迫下的生长状况。
2 结果与分析
2.1 PaENO基因克隆
通过分析本实验室的美洲商陆转录组数据,有一条注释为ENO的转录本,长度为1 855 bp,包含一个完整的开放阅读框(ORF),根据ORF序列信息,设计特异性引物,扩增得到一个长度约为1 300 bp的PCR产物(图1),测序后获得美洲商陆PaENO基因的ORF序列信息,大小为1 335 bp,编码444个氨基酸,GenBank登录号为JN656932.1。
2.2 PaENO蛋白序列分析
ProtParam预测结果显示,PaENO蛋白的分子量为48.16 kD,理论等电点是5.39。InterPro保守结构域分析结果表明,PaENO蛋白属于烯醇化酶家族(IPR036849),在N端4~139 aa为烯醇化酶N端结构域(IPR020811),在C端147~440 aa是烯醇化酶C端TIM 桶状结构域(IPR020810)。TargetP预测结果表明PaENO可能位于细胞质,SiganlP预测PaENO不含信号肽,TMHMM预测显示PaENO蛋白没有跨膜结构域。用PredictProtein预测PaENO蛋白二级结构,结果显示PaENO蛋白由35.36% α-螺旋、13.06% β-折叠和51.58%的无规则卷曲组成。以人的γ-ENO晶体结构(1TE6)为模板,根据SWISS-MODEL三维结构的预测结果,PaENO可能具有四级结构,以同源二聚体的形式在发挥功能,Mg2+是其激活剂。
根据NCBI Blastp的比对结果,PaENO与冰叶日中花(Mesembryanthemumcrystallinum,McENO,AAA21277)、甜菜(Betavulgaris,BvENO,XP_010683886)、菠菜(Spinaciaoleracea,SoENO,XP_021857227)等植物的ENO蛋白氨基酸序列相似性较高,分别为93.47%、92.34%和92.12%,而与拟南芥(Arabidopsisthaliana,AtENO2,NP_181192)、烟草(Nicotianatabacum,NtENO,NP_001312148)、酿酒酵母(Saccharomycescerevisiae,ScENO,1ONE_A)等物种的ENO蛋白氨基酸序列相似性为88.06%、87.84%和59.56%。将这7条ENO蛋白进行氨基酸多序列比对分析,发现ENO蛋白含有4个保守金属离子结合位点(39S、250D、300E、327D)以及3个保守基序(Motif 1、Motif 2、Motif 3)(图2)。
系统进化分析也表明,PaENO与冰叶日中花、甜菜、菠菜等植物的ENO蛋白亲缘关系较近,处于同一进化分支上,然后与大豆、拟南芥、海岛棉、烟草等植物聚为一大类,属于双子叶植物,水稻、小麦、玉米等单子叶植物聚为一类,与苔藓、藻类、酵母等物种的ENO蛋白亲缘关系较远(图3)。
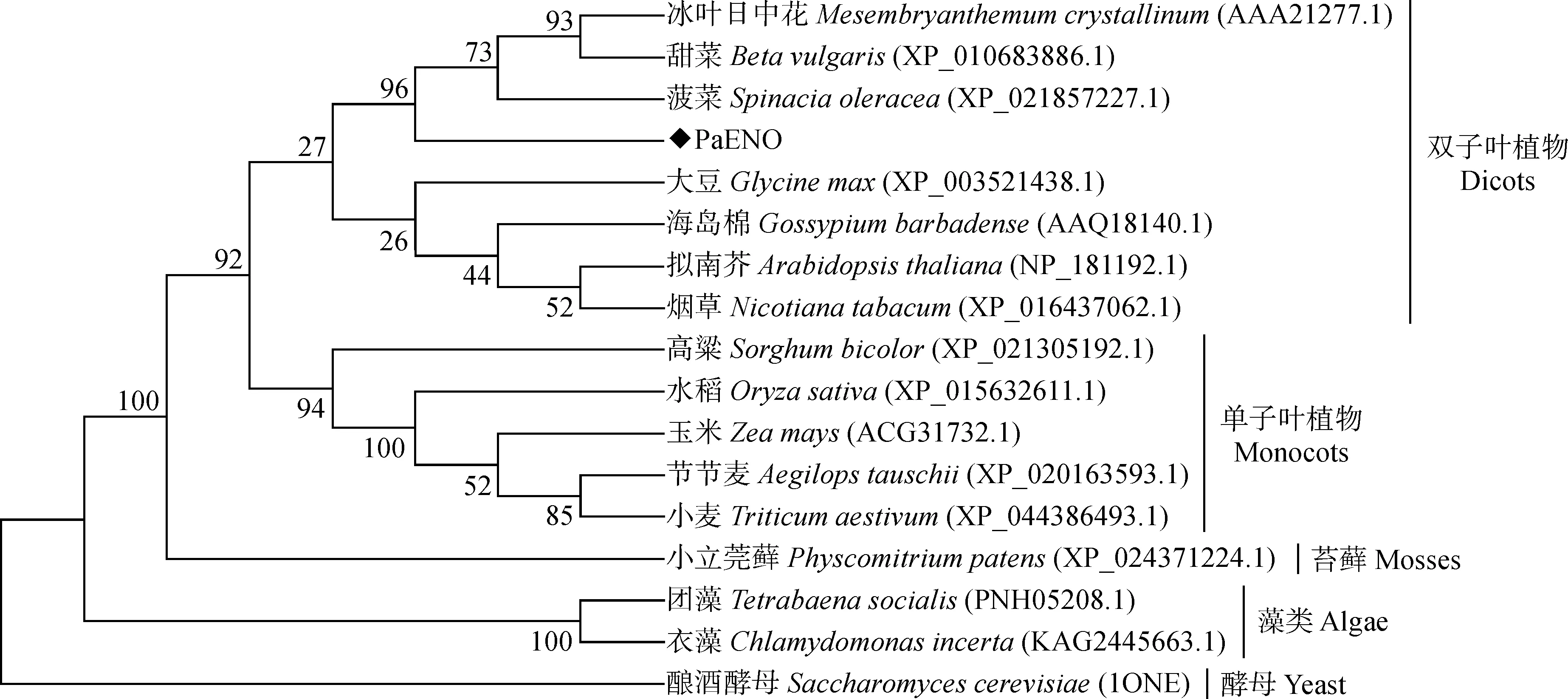
图3 PaENO蛋白的系统进化分析
2.3 PaENO蛋白的原核表达和纯化
使用pET-28a表达载体,选择合适的酶切位点(EcoRⅠ和XhoⅠ),构建pET-28a-PaENO原核表达载体,经双酶切验证和DNA测序,确定PaENO基因序列没有发生突变。将构建成功的原核表达载体pET-28a-PaENO转化大肠杆菌BL21(DE3)感受态细胞,过夜培养后加入IPTG诱导目的蛋白的表达,用SDS-PAGE检测PaENO蛋白的表达。结果如图4所示,经IPTG诱导后,在50 kD左右出现目的条带(图4,A),然后用超声破碎大肠杆菌细胞,离心后分别取上清和沉淀进行SDS-PAGE检测,发现PaENO在上清和沉淀中都有表达,而且在上清中PaENO蛋白的表达量较高(图4,A)。
使用Ni亲和层析试剂盒纯化PaENO蛋白,用含不同浓度咪唑的缓冲液梯度洗脱目的蛋白,然后进行SDS-PAGE检测,结果表明低浓度咪唑(50、100、200 mmol/L)洗脱样品中,PaENO蛋白含量较少,PaENO蛋白主要集中在高浓度咪唑(300、400、500 mmol/L)洗脱样品中,其中以400 mmol/L咪唑洗脱效果最好(图4,B)。收集高浓度咪唑(300、400、500 mmol/L)洗脱样品,进行透析和超滤,最终获得纯化的PaENO蛋白(图4,C)。

M. Marker;A.原核表达及可溶性分析:1. 未诱导的E. coli(含pET-28a-PaENO);2. IPTG诱导的E. coli(含pET-28a-PaENO);3. 上清;4. 沉淀。B. 咪唑梯度洗脱: 1. IPTG诱导的E. coli(含pET-28a-PaENO);2. 流穿峰;3-8. 50、100、200、300、400和500 mmol/L咪唑洗脱。C. SDS-PAGE纯化分析:1. 未诱导的E. coli(含pET-28a-PaENO);2. IPTG诱导的E. coli(含pET-28a-PaENO);3纯化的PaENO蛋白
2.4 PaENO基因表达分析
qRT-PCR结果显示,PaENO基因在美洲商陆的根、茎、叶中都有表达,在叶中表达量最高,为根的2.5倍,其次是根,茎中表达量最低,仅为根中1/5。用400 μmol/L Cd处理后,在不同时间点(0、2、12和24 h)检测PaENO基因在美洲商陆叶片中表达量的变化,结果(图5)表明,Cd胁迫后2 h,PaENO基因表达量迅速升高,达到0 h的9.54倍,到12、24 h,PaENO的表达量降低,为0 h的3.12和2.89倍,说明Cd处理后PaENO基因的表达量迅速升高,参与美洲商陆应对Cd胁迫。

A.组织表达分析;B. Cd处理后叶中表达变化。不同小写字母表示在不同组织(A)或Cd处理后不同时间点(B)PaENO基因表达差异显著(P<0.05)
2.5 大肠杆菌抗Cd分析
为了进一步研究表达PaENO蛋白的大肠杆菌对镉的抗性,将表达空载体(pET-28a)和PaENO(pET-28a-PaENO)的大肠杆菌分别均匀涂布在含1 mmol/L CdCl2的LB平板生长48 h,发现表达PaENO的大肠杆菌比转空载体的大肠杆菌要明显抗镉(图6,A)。通过细胞计数,表达PaENO蛋白的大肠杆菌在LB平板上有(2 163±45)个单菌落,而转空载体的大肠杆菌只有(10±2)个单菌落。在含1 mmol/L CdCl2的LB液体培养基中的生长曲线也表明,表达PaENO蛋白的大肠杆菌比转空载体的大肠杆菌要明显抗镉。表达空载体的大肠杆菌在LB液体培养基中(含1 mmol/L CdCl2)从3 h到22 h,其吸光度OD600一直维持在0.6左右,基本没有生长,而表达PaENO的大肠杆菌在含1 mmol/L CdCl2的LB液体培养基中却能够一直生长,其OD600从0 h的0.1一直上升到22 h的1.7(图6,B)。

A. LB固体平板; B. LB液体培养基
3 讨 论
根据环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》,全国土壤镉污染状况不容乐观,已成为一个严重的环境问题[15]。镉水溶性高,且极易被植物吸收进入食物链,危害人类健康[16-17]。植物修复是利用超富集植物恢复重金属污染土壤生产力的有效方法之一[18-19]。中国野生植物资源丰富,生长在天然污染环境中的超富集植物数量也很多,目前有正式报道的镉超富集植物有天蓝遏蓝菜[20]、东南景天[21]、美洲商陆[9]、龙葵[22]、宝山堇菜、长柔毛委陵菜、伴矿景天和皖景天等,在修复镉污染土壤方面各有特色。在重金属污染区生长的美洲商陆能够在叶片中积累高达402 mg/kg的镉[23],且植物体内的镉含量与土壤中镉浓度呈正相关。与其他镉超富集植物相比,美洲商陆不仅能够积累大量的镉,而且还具有生物量大(野外最高可达3 m)和生长时间短(3个月,一年可收两季)等优点,这些显著的优点使美洲商陆不仅是修复镉污染土壤的潜力物种,而且是研究植物镉超富集分子机制的有价值材料。
前期研究第一次发现糖酵解途径的PaENO与美洲商陆镉胁迫应答反应有关,镉胁迫后美洲商陆PaENO的蛋白表达水平提高了3.14倍,western blot结果也表现出相同的趋势,而糖酵解途径的其他酶蛋白表达水平则显著受到抑制[11]。后续研究美洲商陆应对镉胁迫的转录组学变化,一共获得了5 054个差异表达基因,表明细胞壁的固定化、螯合作用、液泡区隔化以及硫醇化合物含量的升高,可能是美洲商陆耐受镉胁迫的重要机制,而且在镉处理后,PaENO基因的表达水平显著升高[12]。本研究克隆了美洲商陆的PaENO基因,进行了生物信息学分析并使用原核系统在大肠杆菌中表达和纯化了PaENO蛋白,为后续研究PaENO酶促动力学参数以及通过氨基酸点突变研究PaENO关键催化位点奠定了基础; qRT-PCR分析发现,镉胁迫后2 h内PaENO基因的表达量迅速升高为0 h的9.54倍,随着镉处理时间的延长,其表达量降低,但仍高于0 h,这与转录组学变化趋势一致;通过镉抗性实验,初步证实了表达PaENO蛋白能够显著提高大肠杆菌对镉的抗性。
拟南芥AtENO2(LOS2)除了作为一种糖酵解的酶,在拟南芥应对冷胁迫中还能作为转录因子发挥功能。LOS2蛋白同时位于细胞核和细胞质中,能够和拟南芥STZ/ZAT10基因的启动子结合,LOS2基因突变破坏了冷响应相关基因的转录,导致拟南芥对冷胁迫的敏感性[6]。最近研究发现,拟南芥能够从LOS2基因的第二个起始密码子ATG(对应第93位甲硫氨酸)选择性翻译为转录因子AtMBP-1,AtMBP-1能够抑制STZ/ZAT10基因的表达,参与ABA信号通路的响应[24]。这些结果表明AtMBP-1蛋白是LOS2蛋白的转录因子形式,作为一种负调控因子,参与拟南芥的生长发育以及应对逆境胁迫。
结合前期的研究基础以及本研究结果,镉处理后美洲商陆PaENO的蛋白和基因表达水平都显著升高,以及表达PaENO蛋白能够显著提高大肠杆菌对镉的抗性,说明PaENO这一在正常条件下负责糖代谢的酶,可能以转录因子(PaMBP-1)的形式在美洲商陆应对镉胁迫过程中发挥调控作用,但这种功能具体是通过何种机制实现的,具体调控下游哪些信号通路的相关基因,还有待进一步研究阐明。
