香鳞毛蕨 1-脱氧-D-木酮糖-5-磷酸合酶基因的克隆及表达分析
2022-11-09苏佳萌张冬瑞
苏佳萌,袁 强,张冬瑞,汤 珣,常 缨
(东北农业大学 生命科学学院,哈尔滨 150030)
萜类化合物是一类具有不同结构和生物学功能的天然产物,由异戊二烯单元构成,多数属于次级代谢物,在植物生长发育过程中的氧化还原反应、光吸收、生长调控等发挥着重要作用[1-2]。除此之外,萜类化合物可应用于化妆品、生物燃料、医药等领域,拥有巨大的经济效益显著[3-4]。萜类化合物的生物合成起始于两种通用五碳前体,异戊烯基二磷酸(IPP)和二甲基丙烯基二磷酸(DMAPP),二者可通过位于细胞质的甲羟戊酸途径(MVA pathway)及质体中的甲基-D-赤藓醇-4-磷酸途径(MEP pathway)合成。一般倍半萜、三萜的前体(FPP)由MVA途径合成,而MEP途径则提供了单萜、二萜和四萜等化合物的前体物质(GPP、GGPP)[5-6]。
MEP途径中,在1-脱氧-D-木酮糖-5-磷酸合酶(DXS)催化下甘油醛-3-磷酸(GAP)与丙酮酸缩合形成1-脱氧-D-木酮糖-5-磷酸(DXP),DXS合成酶作为限速酶控制着DXP的供应,从而对植物体内萜类化合物的合成产生影响[7]。目前已在多种植物中对DXS基因进行了克隆分析,如,构建长春花(Catharanthusroseus)CrDXS转基因毛状根使得萜类生物碱的积累量增加[8],丹参(Salviamiltiorrhiza)毛状根中过表达SmDXS2产生了比对照组水平更高的丹参酮[9],桑树(Morusnotabilis)MnDXS1的过表达转基因株系开花时间早、GA积累增加[10],烟草(Nicotianatabacum)中表达大豆(Glycinemax)GmDXS的转基因株系叶绿素等光合作用色素含量显著升高[11]。此外,过表达DXS基因可以间接提高植物的抗逆性,杨树(Populustrichocarpa)幼苗在ABA、NaCl、10%聚乙二醇6000和H2O2处理下,PtDXS的表达增加,推测PtDXS能够提高杨树抗盐、抗旱能力。非生物胁迫处理下的马尾松(Pinusmassoniana)中也出现了相似的表达模式,表明PmDXS与马尾松的抗逆性呈正相关[12-13]。
香鳞毛蕨(Dryopterisfragrans)属于鳞毛蕨科(Dryopteridaceae)鳞毛蕨属(Dryopteris),为多年生蕨类,揉碎略有香味,故有香鳞毛蕨之称,在中国以黑龙江省为主要生长区域[14-16]。香鳞毛蕨生境特殊,火山喷发后形成的熔岩台地或岩浆缝隙中多见其生长。作为药用植物其活性成分分离鉴定为萜类化合物、黄酮类化合物和间苯三酚类等。从香鳞毛蕨中提取得到的一种倍半萜Albicanol已被证明具有抗衰老和抗氧化活性,且香鳞毛蕨具有的抑菌活性与间苯三酚类物质相关[17-20]。
在香鳞毛蕨萜类代谢的研究中,已对其倍半萜,三萜合成途径中的主要关键酶法尼基焦磷酸合酶DfFPPS、角鲨烯合酶DfSQS[21]基因进行了克隆及功能奠定。考虑到MEP途径在单萜、二萜合成的重要作用,本研究克隆得到了香鳞毛蕨2条DfDXS的cDNA全长,分别命名为DfDXS1和DfDXS2,对其进行生物信息学分析,并利用qRT-PCR检测DfDXS基因不同胁迫处理下的表达模式,为深入研究香鳞毛蕨DfDXS基因的生物学功能奠定基础,进一步了解香鳞毛蕨萜类化合物的合成机理,也为探索香鳞毛蕨的抗逆机制提供参考。
1 材料和方法
1.1 材 料
植物材料采用的是人工快繁培育的香鳞毛蕨孢子体幼苗,培养温度条件设置为22 ℃,相对湿度50%,光周期条件(光照/黑暗)为16 h/8 h[22]。
待香鳞毛蕨长至幼苗期时,用流水将幼苗叶片表面轻轻冲洗并吸干水分。激素处理实验组分别对叶片喷洒100 μmol·L-1水杨酸(SA)、10 μmol·L-1脱落酸(ABA)、100 μmol·L-1茉莉酸甲酯(MeJA)和500 μmol·L-1乙烯利(Eth);非生物胁迫实验组分别进行20%聚乙二醇(PEG)模拟干旱,200 mmol·L-1NaCl整株浇灌,42 ℃高温 (HT)和4 ℃低温(LT)处理,对照组喷施蒸馏水。所采取浓度为前期试验得出。在处理0、0.5、1、3、6、12、24和48时分别取样,样品剪成1 cm小段装袋,液氮速冻保存并放入-80 ℃的冰箱备用,每次样品处理包含至少3次生物学重复。
1.2 方 法
1.2.1 总RNA提取及cDNA合成对实验组及对照组的香鳞毛蕨孢子体叶片采用Trizol法提取获得RNA(擎科,中国哈尔滨),参考说明书进行。以总RNA为模板,使用反转录试剂盒(诺唯赞,中国南京),参照说明书进行cDNA合成。
1.2.2DfDXS基因克隆及生物信息学分析根据香鳞毛蕨转录组数据库进行本地Blast筛选,获得2条DfDXS基因,在NCBI网址中利用Blastp对其它物种的DXS蛋白氨基酸序列检索,比对结果显示出较高的相似性,于是分别将其命名为DfDXS1、DfDXS2。设计正、反向引物 (表1),进行PCR扩增。PCR模板为反转录获得的香鳞毛蕨cDNA,体系为模板cDNA 1 μL,正、反向引物各1 μL,2×Taq酶缓冲液10 μL,ddH2O补至20 μL。PCR反应程序设置:95 ℃ 5 min;95 ℃ 30 s,57 ℃15 s,72 ℃ 30 s,35 个循环;4 ℃保温。对扩增产物进行琼脂糖凝胶电泳,并按照说明书纯化回收特异性条带,随后连接到克隆载体pEASY-T18并转化至DH5α感受态细胞中,经菌落及菌液PCR检测后送往哈尔滨睿博生物技术有限公司测序。
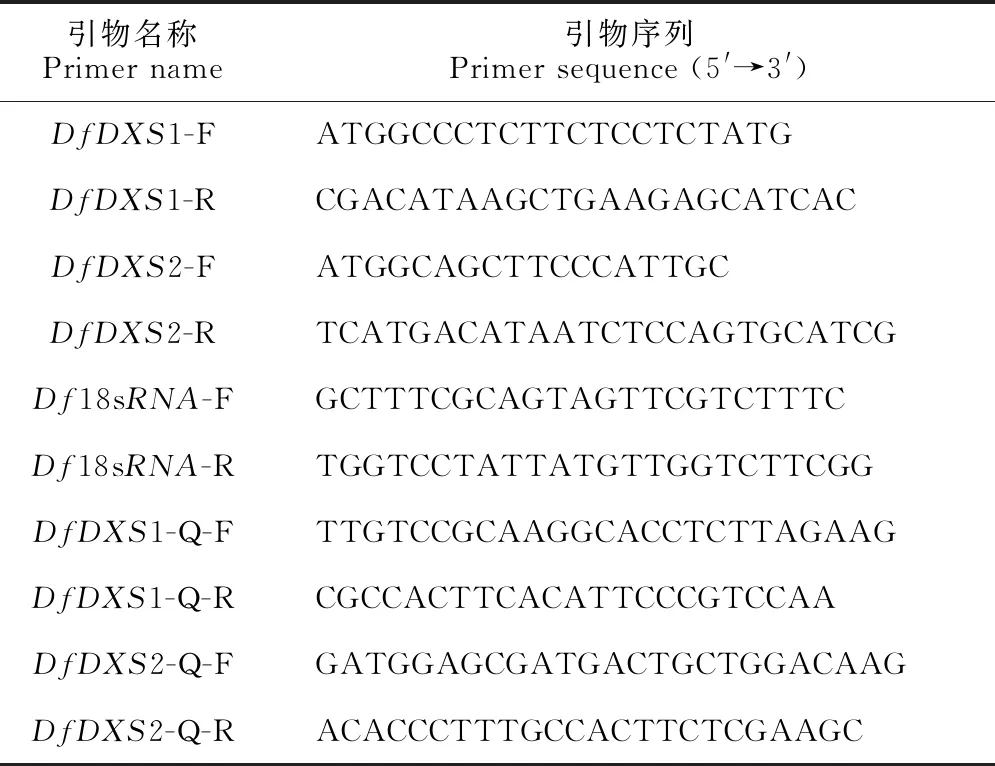
表1 引物序列
通过ExPASy-ProtParamtool在线分析DfDXS氨基酸序列,获得其组成成分及理化性质;利用在线软件(表2)预测DfDXS蛋白结构、亚细胞定位及保守基序 (Motif)。

表2 生物信息学分析网址
运用NCBI的Blastp工具,检索数据库中DfDXS基因同其他植物的DXS基因的同源氨基酸序列,使用DNAMAN对下载的氨基酸序列进行同源比对。利用MEGA7.0 软件绘制系统进化树,采用邻位相连算法(Neigh borjoining)分析DfDXS1、2与其他植物DXS的系统进化关系,Bootstrap值设置为1 000。
1.2.3DfDXS的表达分析使用PrimerPremier6.0软件设计DfDXS基因的qRT-PCR特异引物,内参基因为Df18sRNA,所用引物序列详见表1。qRT-PCR体系为SYBR Green荧光染料10 μL,上下游引物各0.8 μL,cDNA1 μL,ddH2O补至20 μL,反应程序参考试剂说明书(诺唯赞,中国南京)。PCR反应系统为Mx-3000p Real-Time PCR System,采用2-ΔΔCt法计算DfDXS基因相对表达量,反应体系及程序参考试剂说明书,每个样品重复3次。数据使用Excel 2016和DPS数据处理系统分析统计。引物为哈尔滨擎科生物技术有限公司合成。
2 结果与分析
2.1 香鳞毛蕨DfDXS基因克隆及序列分析
根据实验室香鳞毛蕨孢子体叶片的转录组数据,经Blastp找到2条DfDXS基因序列,分别命名为DfDXS1和DfDXS2,设计引物并进行目的基因扩增,发现在2 000 bp左右出现特异片段,与预期大小基本一致(图1)。DfDXS1基因长2 139 bp,编码712个氨基酸;DfDXS2基因长2 160 bp,编码719个氨基酸。

M.DL2000;1.DfDXS1;2.DfDXS2
2.2 DfDXS蛋白质的理化性质及蛋白结构分析
经ExPASy在线软件预测分析,DfDXS1蛋白质的相对分子质量为76.49 kD,DfDXS2蛋白质的相对分子质量为76.74 kD。理论等电点分别为6.64和6.62,是弱酸性蛋白;不稳定系数为89.92和90.00,属于不稳定蛋白质;脂肪族系数为41.34和35.39,总平均亲水系数为-0.050和-0.029,预测该蛋白是亲水蛋白。利用Softberry 在线程序预测DfDXS蛋白亚细胞定位,结果显示其位于叶绿体。保守结构域分析显示DfDXS蛋白具有PLNO2582活性位点,为1-脱氧-D-木酮糖-5-磷酸合酶的特征序列,证明香鳞毛蕨DfDXS蛋白结构完整。
使用NPS@ server在线预测DfDXS蛋白的二级结构发现,两个蛋白质二级结构近似,均为alpha-beta型(图2,A)。为进一步了解预测DfDXS的蛋白特性,使用SWISS-MODEL分析系统在线预测构建三维模型(图2,B),氨基酸序列相似性分别为82.62%和82.95%,低聚糖状态下为同源二聚体。
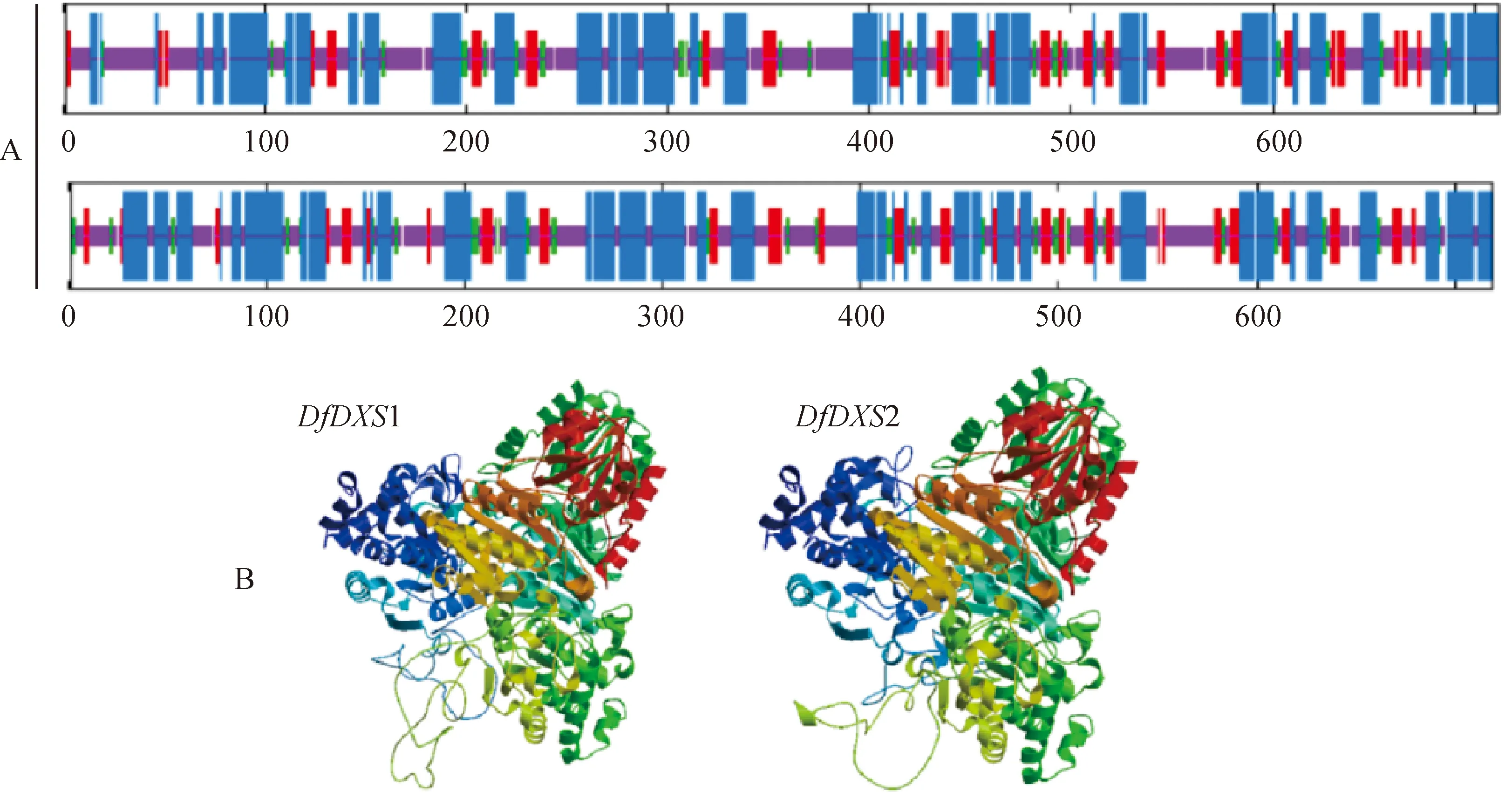
A.二级结构;B.三级结构;蓝色表示α-螺旋,红色表示β-折叠,绿色表示β-转角,紫色表示无规则卷曲
2.3 DfDXS蛋白质系统进化和序列比对及结构分析
通过Blastp对香鳞毛蕨DfDXS1和DfDXS2编码氨基酸进行同源比对,并利用MEGA7.0软件进行系统进化分析。结果表明,香鳞毛蕨DXS与银杏(Ginkgobiloba)DXS、北美乔柏(Thujaplicata)DXS1、马尾松(Pinusmassoniana)DXS1等聚在一支,亲缘关系较近,与苍术(Atractylodeslancea)等植物的DXS关系较远(图3)。
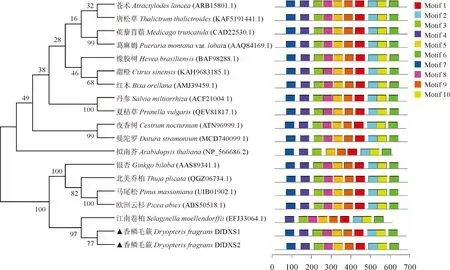
右侧Motif 1-10表示香鳞毛蕨DfDXS基因编码氨基酸的保守基序,Motif图下方标尺表示蛋白长度
DNAMAN软件进行多序列比对(图4)显示,DfDXS1、DfDXS2蛋白质与银杏,北美乔柏、马尾松、欧洲云杉和江南卷柏的DXS蛋白质相似性均在82%以上,与马尾DXS1蛋白质的相似性达到86.69%。结构域分析显示DfDXS1、2蛋白具有典型的转酮醇酶保守域,包含焦磷酸硫胺素结合位点和转酮醇酶结构域在内。

红线为焦磷酸硫胺素结合位点,蓝线为转酮醇酶结构域
MEME在线网站进行Motif功能分析,DfDXS蛋白含有10个Motif,除Motif9外长度均为50 aa。Motif1、2中含有二磷酸硫胺结合位点(Transket_pyr),Motif3、4、5、7、8与1-脱氧-D-木酮糖-5-磷酸合酶(DXP_synthase_N)功能行使相关,Motif6、10含有转酮酶C-末端结构域(Transketolase_C),Motif9长度为46 aa,属于Choline_bind_3,与胆碱结合相关。
2.4 激素处理下香鳞毛蕨DfDXS基因的表达
利用qRT-PCR分析外源激素SA、ABA、MeJA和Eth处理下香鳞毛蕨叶片中DfDXS的表达模式。结果(图5)表明,SA处理下,香鳞毛蕨叶片中DfDXS1、2表达总趋势为先升高后降低,分别在处理1和3 h达到峰值,约为0 h的4.5和2.6倍。在ABA处理下,DfDXS1和DfDXS2的表达情况有所不同,DfDXS1除在1 h其相对表达量有所升高外,均低于0 h;DfDXS2则为下降趋势。DfDXS1、2对MeJA 处理响应强烈,相对表达都表现为先升高后降低,且表达量显著高于对照。值得注意的是,DfDXS2对MeJA的响应高且晚于DfDXS1。MeJA处理1 h时DfDXS1达到峰值,约为对照的6.7倍;DfDXS2于6 h时达到峰值,约为对照的12倍。Eth处理下,DfDXS1除3 h高于对照,其他时间点相对表达量低于对照;而DfDXS2相对表达量在Eth所有处理时间下均明显下调且显著低于对照。
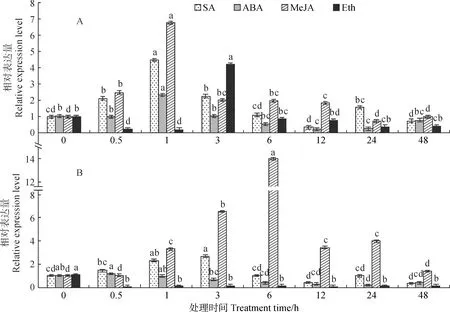
处理内不同小写字母表示处理时间之间在0.05水平存在显著性差异,下同
2.5 非生物胁迫下香鳞毛蕨DfDXS基因的表达
在PEG、NaCl、高温(HT)和低温(LT)处理下,对香鳞毛蕨叶片中DfDXS表达进行qRT-PCR分析。结果如图6所示,PEG模拟干旱处理,DfDXS1除3 h相对表达量略低于对照外,其他处理时间均高于对照,最高的表达量约为0 h的18.6倍;DfDXS2在1、3 h相对表达较低,其余处理时间均高于对照。DfDXS对NaCl模拟的盐胁迫处理响应不明显,在3 h时DfDXS1的表达水平略有上升,NaCl抑制DfDXS2基因的表达。高温处理下,DfDXS1和DfDXS2均在0.5 h相对表达水平最高,分别为0 h的5和19倍,随后表达量下降。低温处理下DfDXS1和DfDXS2的相对表达水平呈先升高后降低的趋势,1 h似乎是DfDXS面对冷胁迫的时间节点,相对表达水平骤降后提高。本研究结果显示,非生物胁迫处理下DfDXS1和DfDXS2的表达水平产生了显著变化,且DfDXS2对温度变化的响应高于DfDXS1。

图6 不同非生物胁迫处理香鳞毛蕨叶片中DfDXS1(A)和DfDXS2(B)的相对表达
3 讨 论
DXS是MEP途径下游产物的关键调控位点,在光合色素叶绿素和类胡萝卜素的合成,植物抗病和抗逆等方面发挥着重要作用[23-25]。DXS基因家族已被广泛研究,于多种植物中得到鉴定,但香鳞毛蕨DXS基因的生物学作用尚待研究。本研究克隆并鉴定了香鳞毛蕨中DfDXS1、DfDXS2,并对其进行生物信息学及表达模式分析。结构域分析显示DfDXS蛋白具有典型且完整的转酮醇酶保守域,证实DfDXS1、DfDXS2属于香鳞毛蕨DXS基因家族。在线预测DfDXS蛋白亚细胞定位结果显示其位于叶绿体,这与番茄(Lycopersiconesculentum)叶片DXS蛋白质的亚细胞定位结果一致[26]。根据已有报道,DXS基因家族根据功能可分为三个分支,Ⅰ型DXS主要作为管家基因,如参与叶绿素的合成;Ⅱ型DXS主要负责植物次生代谢产物的积累;Ⅲ型DXS在细胞中表达水平较低,主要参与含量水平较低的MEP途径衍生物的合成[27]。综合多序列比对和系统发育树,DfDXS蛋白与马尾松PmDXS1(UIB01902.1)、银杏GbDXS1(AAS89341.1)相似性较高。因此DfDXS1、2可能属Ⅰ型DXS,和叶绿素等光合作用涉及的萜类物质合成相关。激素和环境因子能够影响植物DXS基因表达。实验中外源喷施SA、ABA、MeJA、Eth四种激素,观察香鳞毛蕨DXS基因的表达模式。在SA处理下,香鳞毛蕨叶片中DfDXS1、DfDXS2相对表达量升高,分别在1 h和3 h达到峰值,随后降低,这与烟草NtDXS2的表达模式相似[28]。SA是一种重要的信号分子,可以增强植物对生物性病原的抵抗作用。并有研究表明SA调控植物次生代谢物的生物合成,经SA处理24 h后的光果甘草三萜物质甘草酸苷的产量较对照组提高了4.1倍[29]。ABA被定义为一种逆境植物激素,ABA对DfDXS1、DfDXS2基因表达有一定的抑制作用,但在丹参毛状根中ABA处理提高了DXS的转录水平[30],说明DXS基因在不同植物不同部位行使着不同的功能。已有研究表明MeJA可提高萜类物质青蒿素含量及相关基因表达[31],DfDXS对MeJA处理响应强烈,其相对表达水平显著高于对照,这与银杏GbDXS等对MeJA的表达模式相似[32]。DfDXS1对外源MeJA处理响应更快,DfDXS2的相对表达水平更高。关于DfDXS与外源激素和萜类合成三者之间的关系仍需要进一步探索。
干旱、盐分和极端温度等各种非生物压力对植物的持续生长构成了威胁,植物对外界不同程度胁迫产生的防御作用同样是影响萜类物质合成的主要因素[33-34]。有研究表明,MEP途径可能有助于抵御干旱,利用其中间体和产物异戊二烯以某种方式缓解[35]。本研究中,在PEG模拟的干旱处理下香鳞毛蕨DfDXS的相对表达量总体上调,DfDXS1在12 h达到最高表达量约为0 h的18.6倍。然而水分亏缺状态下的两种番茄(Solanumchilense、Solanumlycopersicum)SlDXS的表达趋势与此相反,干旱处理下的云杉(Piceaglauca) DXS活性也降低约50%[36-37]。这可能与香鳞毛蕨的特殊生境相关,长期进化下对干旱的耐受力增强。除此之外高温、低温对DfDXS诱导表达量上调,外界温度变化1 h似乎是香鳞毛蕨DfDXS抵御逆境的时间节点,或许通过增加次生代谢产物的数量,从而抵御不良因素对香鳞毛蕨所造成的伤害,推测其在应激条件的调节中起重要作用[38-39]。对于DfDXS基因如何参与调控香鳞毛蕨抗逆等功能仍需进一步深入研究。
综上,DfDXS1、DfDXS2对激素、温度等胁迫处理的相对表达量呈现不同程度的变化,说明DfDXS可能在萜类物质合成与抗逆机制中发挥作用。这为后续进一步研究提高香鳞毛蕨萜类活性物质产量以及植物激素信号转导途径的响应机制奠定了基础。
