粗枝云杉病程相关蛋白基因PaPR10的克隆及表达分析
2022-11-09刘利娟李成松赵炜栋刘应高杨春琳
梁 芳,刘利娟,李成松,赵炜栋,刘应高,杨春琳
(四川农业大学 林学院,成都 611130)
病程相关蛋白(pathogenesis-related proteins,PRs)是一类在植物体内受生物和非生物胁迫而诱导产生的蛋白质的总称,可通过增厚细胞壁、增强抗菌活性和参与信号转导等多种方式抵御病害侵染[1]。目前,根据PR蛋白家族成员的氨基酸序列相似程度、血清学关系及生物学活性等特征,一般将其分为17个家族[2-3]。PR蛋白家族成员在植物自我防御机制中作为可被诱导的组分发挥作用,包括几丁质酶、葡聚糖苷酶、防御素、蛋白酶抑制剂、内肽酶、类甜蛋白、过氧化物酶和脂质转移蛋白等组分[4-5]。PR10蛋白为类核糖核酸酶,大多数PR10蛋白是一类典型的小分子量、呈酸性、无信号肽的胞内蛋白[6]。根据PR10蛋白的氨基酸序列的相似性、亚细胞定位以及蛋白质功能预测结果,可将其分为以下两种类型:一类是具有核糖核酸酶同源性胞内病程相关蛋白(intracellular pathogenesis-related protein, IPR),另一类是乌药碱合酶(norcoclaurine synthases, NCS)[6]。经研究,PR10蛋白具有体外核糖核酸酶(RNase)活性和抗菌活性,参与植物的次生代谢反应,在植物抵御多种生物和非生物胁迫的防御机制中起着重要作用[7-9]。迄今,人们已从不同植物中发现大量PR10蛋白或者PR10相关蛋白。PR10蛋白广泛存在于被子植物中,在水稻(Oryzasativa)[10]、大豆(Glycinemax)[11]、丹参(Salviamiltiorrhiza)[12]和玉米(Zeamays)[13]等植物中相继发现PR10蛋白的存在。此外,在裸子植物中也发现了PR10蛋白的存在,目前已有西部白松(Pinusmonticola)[14]和北美黄杉(Pseudotsugamenziesii)[15]等裸子植物PR10蛋白的相关研究。
粗枝云杉(Piceaasperata)是松科(Pinaceae)云杉属(Picea)植物,为中国特有种,是多年生常绿乔木,适应性强,材质优良,多分布在川西高原、甘肃南部和陕西西南部的亚高山地带[16]。近年来,西南亚高山地区人工云杉林落针病害发生普遍,导致云杉生长缓慢甚至衰败死亡[17-18]。据2019年全国有害生物普查结果显示,云杉落针病发生面积已超过6.667万hm2,极大地威胁着西南及长江中上游地区的生态屏障建设。筛选和发掘云杉抗落针病基因资源,将为云杉抗病基因工程育种打下基础。目前,已有部分云杉抗病基因被报道,包括云杉PR3家族的几丁质酶PlCHI基因[19]、PR5家族的类甜蛋白基因[20]和PR12家族的防御素基因[21]等,但对于云杉PR10家族则鲜有报道。基于此,本研究以粗枝云杉一年生幼嫩针叶为材料,通过克隆获得响应云杉落针病菌(Lophodermiumpiceae)侵染的PaPR10基因cDNA全长序列,利用生物信息学分析其核苷酸和氨基酸序列,然后将该基因导入大肠杆菌(Escherichiacoli)中进行原核表达,以优化条件进行蛋白表达和纯化,并利用底物法测定纯化蛋白的核糖核酸酶活性,以期为揭示PaPR10基因在云杉抗病中的生物学功能奠定基础。
1 材料和方法
1.1 试验材料
供试粗枝云杉采自四川省甘孜藏族自治州二郎山林场;植物RNA提取试剂盒购自华越洋生物科技有限公司(北京);反转录试剂盒、pMD19-T载体和pET-32a载体均购自TaKaRa生物技术有限公司(大连);DNA纯化回收试剂盒、质粒提取试剂盒均购自天根生化科技有限公司(北京);大肠杆菌E.coliDH5α和BL21(DE3)均购自全式金生物技术有限公司(北京);BamHⅠ、HindⅢ限制性内切酶、T4 DNA连接酶均购自NEB有限公司(北京);His标签蛋白纯化试剂盒购自碧云天生物技术有限公司(上海);其他试剂为国产或进口分析纯。
1.2 方 法
1.2.1PaPR10基因的扩增及克隆以粗枝云杉一年生幼嫩针叶为材料,使用植物RNA提取试剂盒提取粗枝云杉总RNA,1%琼脂糖凝胶电泳检测条带完整性,NanoDrop 2000超微量分光光度计检测其浓度和纯度。以检测合格的总RNA为底物,反转录得到cDNA,-20 ℃保存。根据课题组前期的健康和感云杉落针病菌的粗枝云杉转录组数据,筛选得到一个在感病后显著上调的PaPR10基因,以该基因的CDS区设计特异性引物PaPR10-F和PaPR10-R(表1)。以粗枝云杉cDNA为模板进行PCR扩增,扩增程序为:94 ℃预变性3 min,94 ℃变性30 s,54 ℃退火1 min,72 ℃延伸1 min 30 s,40个循环;72 ℃延伸7 min。PCR产物经过纯化回收后连接至pMD19-T载体,连接产物转入E.coliDH5α感受态细胞中,于LB/Amp/X-gal平板上进行蓝白斑筛选,挑取白色菌落进行PCR鉴定,将PCR鉴定为阳性的克隆菌落送至成都擎科梓熙生物技术有限公司测序。

表1 引物序列
1.2.2PaPR10基因序列及编码蛋白序列分析通过在线软件ORF Finder查找序列的开放阅读框,利用DNAMAN 6.0软件将核苷酸序列翻译为氨基酸序列;使用在线软件NCBI Blast进行核苷酸序列和氨基酸序列比对分析;利用ClustalX 1.81软件将编码蛋白序列与其他植物PR10蛋白序列进行多重对比分析,并通过在线软件ESPript 3.0将多重比对分析结果进行比对注释;使用在线软件ProtParam和TargetP-2.0分别进行蛋白质的理化性质分析和亚细胞定位;在线软件SignalP-5.0和TMHMM-2.0分别进行蛋白质信号肽预测和跨膜域分析;在线软件NetPhos 3.1 server进行蛋白磷酸化位点的预测;在线软件ExPASy-Prosite进行蛋白质功能位点和功能域分析,在线网站PSIPRED进行蛋白质二级结构的预测;在线软件SWISS-MODEL进行蛋白质三级结构的预测;MEGA 5.05软件的相邻连接法(neighbor-joining)绘制系统进化树并利用在线网站Evolview对系统发育树进行着色分析。相关在线网站的网址可参考刘利娟[19]和刘裕峰等[20]的生物信息学分析方法。
1.2.3PaPR10基因原核表达载体的构建及鉴定根据克隆获得的粗枝云杉PaPR10基因序列,设计1对含BamH Ⅰ、Hind Ⅲ酶切位点的特异性引物PaPR10BamH Ⅰ-F和PaPR10Hind Ⅲ-R(表1)。以pMD19T-PaPR10重组质粒为模板,使用BamH Ⅰ和Hind Ⅲ限制性内切酶分别酶切目的片段和pET-32a载体,酶切产物纯化回收后利用T4DNA连接酶16 ℃连接12 h。将获得的连接产物转入E.coliBL21(DE3)感受态细胞中,经Amp抗性筛选后,再进行菌落PCR和双酶切鉴定,挑选阳性克隆送往成都擎科梓熙生物技术有限公司测序。
1.2.4 PaPR10蛋白的诱导表达及SDS-PAGE分析将测序正确的菌液继续进行蛋白诱导表达及优化。IPTG浓度优化:将过夜培养的菌液按照1∶100的比例加入到含有100 μg/mL Amp的LB液体培养基中,37 ℃ 200 r/min活化2.5 h,然后分别加入终浓度为0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG诱导剂诱导表达3 h。参照刘利娟等[19]的方法对诱导后的蛋白进行处理和SDS-PAGE电泳检测。以最适IPTG浓度进行最适诱导时间的优化,设置的时间梯度为2、4、6、8和10 h;然后以最适IPTG诱导浓度和最适诱导时间进行最适诱导温度的优化,设置的温度梯度为20、25、30和37 ℃诱导。诱导得到的蛋白均以相同方法进行SDS-PAGE电泳检测。所有SDS-PAGE电泳检测均以未加IPTG诱导的菌液、IPTG诱导的空载体和未加IPTG诱导的空载体为对照。
1.2.5 PaPR10蛋白的纯化及活性检测以优化的诱导表达体系表达PaPR10蛋白,使用His标签蛋白纯化试剂盒进行纯化。采用底物法[22]检测PaPR10蛋白的体外核酸酶活性。以5 μL 10 mg/mL酵母RNA为底物,分别加入5 μL PaPR10纯化蛋白溶液(实验组)、5 μL DEPC水(对照组)、5 μL蛋白非变性洗脱液(对照组)、5 μL RNA酶清除剂(对照组)和2.5 μL PaPR10纯化蛋白溶液+2.5 μL RNA酶清除剂(对照组),在37 ℃下反应30 min,使用1%琼脂糖凝胶电泳检测酵母RNA的降解结果。
2 结果与分析
2.1 粗枝云杉PaPR10基因全长cDNA扩增
以粗枝云杉cDNA为模板进行PCR扩增,经1%琼脂糖凝胶电泳检测,在约500 bp位置处显示与预期目的基因大小相符的单一条带(图1)。经测序,该核苷酸片段长度为456 bp。将其核苷酸序列通过DNAMAN翻译为氨基酸序列,并上传至GenBank数据库中,登录号为OM743228。
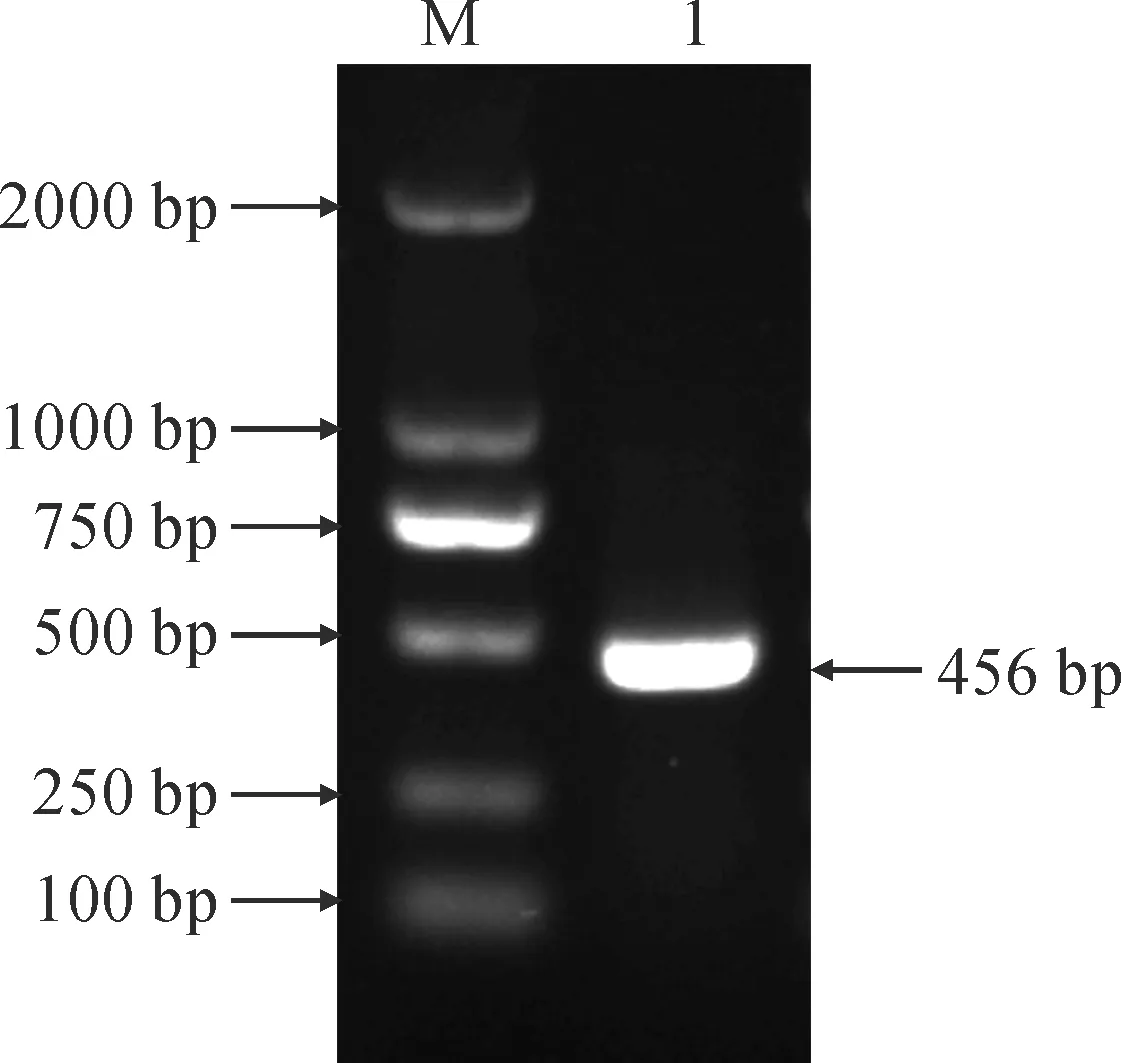
M. DL2000;1.PaPR10
2.2 PaPR10基因核苷酸序列分析
DNAMAN序列分析结果表明,PaPR10基因的开放阅读框(ORF)为456 bp,共编码151个氨基酸(图2)。Blastn比对结果表明,该基因序列与松科植物的PR10基因序列相似性均在90%以上,其中与北美云杉(Piceasitchensis)的PR10基因序列相似性最高,达到98.90%,与白云杉(Piceaglauca)的PR10基因序列相似性达97.95%,表明PaPR10基因序列在进化过程中较为保守。

方框为甘氨酸富集区;下划线为预测的潜在磷酸化位点;*为终止密码子
2.3 PaPR10蛋白的氨基酸序列分析
ProtParam分析结果表明,PaPR10蛋白的分子式为C744H1189N191O222S5,相对分子量为16 522.07 Da,理论等电点为5.73,带负电荷的残基总数(Asp+Glu)为19个,带正电荷的残基总数(Arg+Lys)为17个。该蛋白由20种氨基酸组成,不稳定指数为31.95,是稳定性蛋白;脂肪族氨基酸指数为91.06;亲水性的总平均值为-0.060,属亲水性蛋白。由SignalP 5.0和TargetP 2.0预测结果可知,PaPR10蛋白不含信号肽,且定位于细胞质中,属于胞内蛋白。TMHMM 2.0预测结果表明,PaPR10蛋白不含跨膜结构域。通过NetPhos 3.1 server分析结果可知,PaPR10蛋白中存在6个丝氨酸磷酸化位点和7个苏氨酸磷酸化位点,这些位点可能与生物活性相关。
应用Clustal X 1.81和ESPript 3.0对PaPR10氨基酸序列与其他6种植物的PR10蛋白质序列进行多重比对和注释,结果(图3)显示,PaPR10氨基酸序列在C端(141~147位氨基酸)具有一个保守序列:K-A-X-E-X-Y-L(X代表任意氨基酸)。PR10蛋白的氨基酸序列通常在N端存在富含甘氨酸的P-Loop的保守结构(G-X-G-G-X-G),该结构可能与PR10蛋白家族的核酸酶活性相关[22-23]。而PaPR10蛋白在P-Loop保守结构域中出现了氨基酸代替,结构序列改变为GDGNVGTIRR。
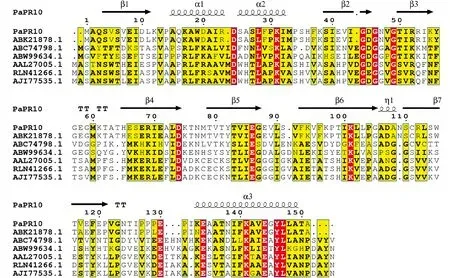
PaPR10.粗枝云杉;ABK21878.1.北美云杉;ABC74789.1.辣椒;ABW99634.1.欧洲李;AAL27005.1.水稻; RLN41266.1.黍;AJI77535.1.紫檀;箭头为β-折叠;大波浪曲线为α-螺旋;字母TT为β-转角;小波浪曲线为η-螺旋
2.4 PaPR10蛋白的结构预测
Blastp分析结果表明,PaPR10蛋白具有病程相关蛋白Bet_v_1疏水结构域(1~150位氨基酸),该结构域富含甘氨酸环(44~52位氨基酸),且有33个疏水配体结合位点(图4)。PaPR10蛋白与桦树(Betula)花粉过敏原十分相似,隶属于SRPBCC(Bet_v_1)超家族,推测其可能具有该基因家族的生物学功能。ScanProsite分析结果表明,PaPR10蛋白含有1个N-糖基化位点(77~80位氨基酸)、1个酪蛋白激酶Ⅱ磷酸化位点(83~86位氨基酸)、3个N-豆蔻酰化位点(46~51位、59~64位和105~110位氨基酸)、4个蛋白激酶C磷酸化位点(分别为50~52位、67~69位、99~101位和110~112位氨基酸)。SOPMA分析结果表明(图5),PaPR10蛋白的二级结构由4部分组成,其中无规则卷曲结构所占比例最大,占39.07%;α-螺旋结构次之,占28.48%;延伸链结构占25.17%;β-转角最少,仅占7.28%。SWISS-MODEL三级结构预测结果表明(图6),PaPR10氨基酸序列的C端包含一个由23个氨基酸组成的α3螺旋,该螺旋被7股反向平行β折叠包围,其N端结构域的2个短α1和α2螺旋处于折叠片层β1和β2之间螺旋,glycine-rich_loop结构域(G-X-G-X-X-G)位于β2和β3之间。粗枝云杉PaPR10蛋白的三级结构与已报道的其他植物PR10蛋白的三级结构具有高度相似性。

图4 PaPR10蛋白保守功能域
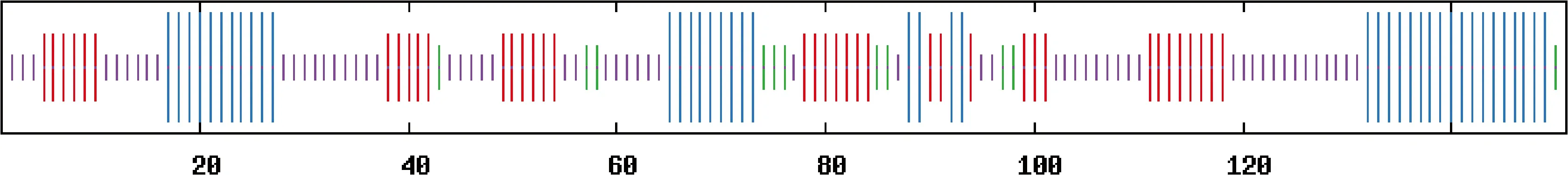
蓝色表示α-螺旋;紫色表示无规则卷曲;红色表示延伸链;绿色表示β-转角;标尺数值表示氨基酸位置
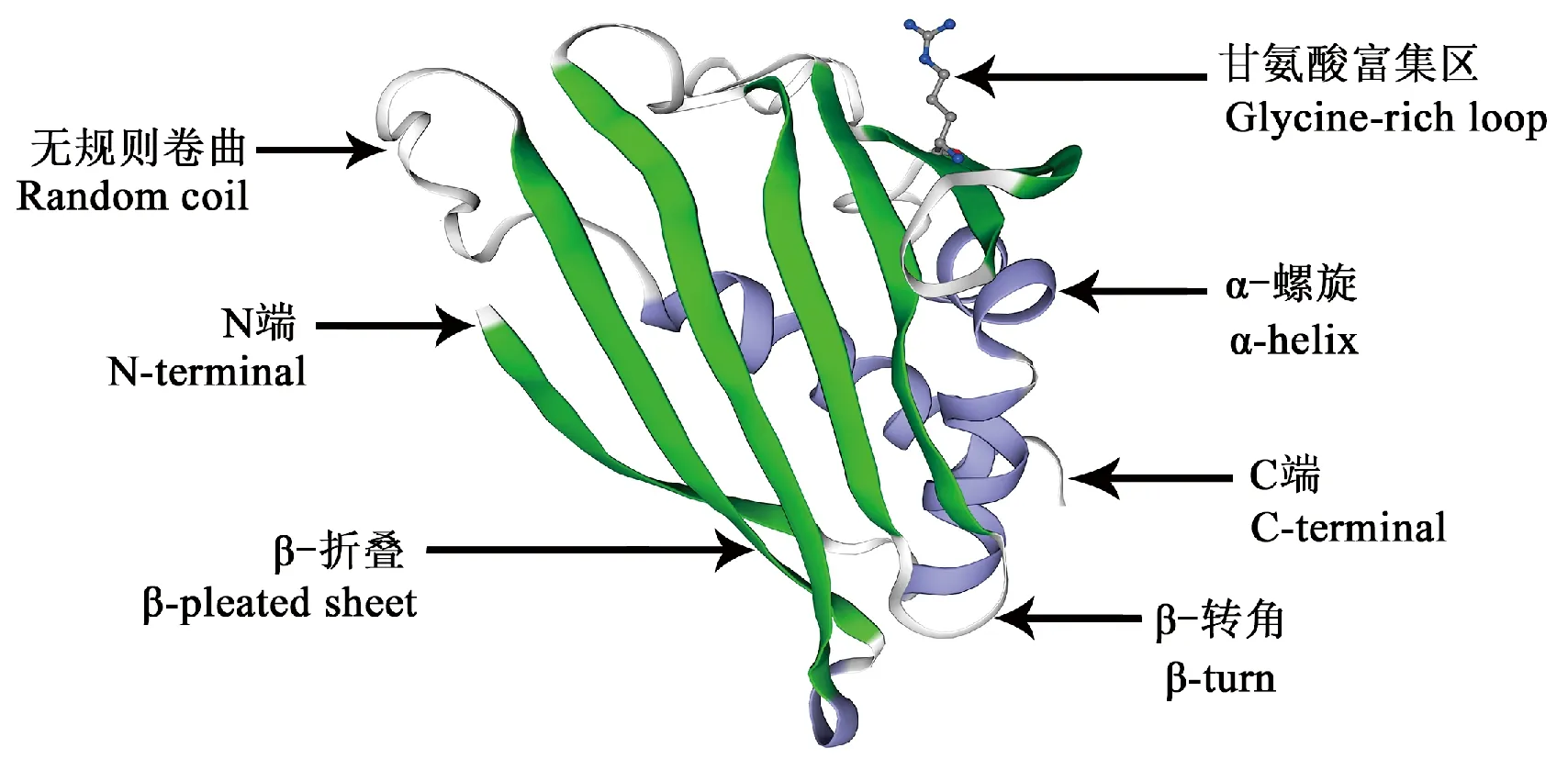
图6 PaPR10蛋白三级结构
2.5 PaPR10蛋白的同源进化分析
利用MEGA 5.05软件构建PaPR10蛋白和不同植物PR10蛋白的系统发育树,结果表明(图7):PR10蛋白的系统发育树由双子叶植物组、单子叶植物组、裸子植物和苔藓植物组三大分支构成。PaPR10蛋白归属于IPR类,与北美云杉(P.sitchensis)PR10蛋白聚为一支,亲缘关系最近,有趣的是,PaPR10蛋白与低等植物小立碗苔藓(Physcomitrellapatens)PR10蛋白的亲缘关系次之,比同科植物的海岸松(Pinuspinaster)、西部白松(P.monticola)、白云杉(P.glauca)PR10蛋白的亲缘关系更为亲近。推测粗枝云杉PaPR10蛋白在进化过程中是相对缓慢且高度保守的。
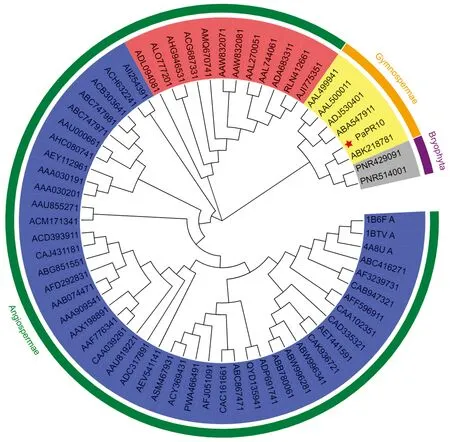
蓝色区域为双子叶植物;红色区域为单子叶植物;黄色区域为裸子植物;灰色区域为苔藓植物;红色星标为粗枝云杉PaPR10蛋白; 1B6F_A、1BTV_A和4A8U_A. 欧洲白桦;ABC41627.1、CAB94732.1.海岛棉;AF323973.1.欧榛;AFF59691.1.栎木;CAA10235.1.山楂;CAD33532.1.红枣;AET44159.1.草莓;CAK93672.1.苹果;ABW99634.1、ABW99628.1和ABB78006.1.欧洲李;ADP69174.1.毛白杨;QYD13594.1.海岛棉;ABC86747.1.华东葡萄;CAC16166.1.葡萄;AFJ05109.1.丹参;PWA46649.1.黄花蒿;ACY36943.1.人参; ASM46793.1.三七;AEV54114.1.麻风树;ADC31789.1.大豆;AAU81922.1.花生;CAA03926.1.白羽扇豆;AAF77634.1.黄羽扇豆; AAX19889.1.绿豆;AAA90954.1.豌豆;AAB07447.1.黄豌豆;AFD29283.1.蚕豆;ABG85155.1、CAJ43118.1和ACD39391.1.花生; ACM17134.1.海岛棉;AAU85527.1.木本棉;AAA03020.1、AAA03019.1.马铃薯;AEY11296.1.烟草;AHC08074.1.甘蔗;AAU00066.1.野茄果;ABC74798.1、ABC74797.1和ACB30364.1.辣椒;ACH63224.1.藏边大黄;AII25439.1.盐穗木;ADL09408.1.番红花;ALO77720.1.百合杂交品种;AHG94653.1.岷江百合;ACG68733.1.小麦;AMQ67074.1.甘蔗杂交品种;AAW83208.1、AAW83207.1.高粱;AAL27005.1、AAL74406.1.水稻;ADA68331.1.玉米;RLN41266.1.黍;AJI77535.1.斑茅;AAL49994.1、AAL50001.1.西部白松;ADJ53040.1.松树; ABA54791.1.白云杉;PaPR10.粗枝云杉;ABK21878.1.北美云杉;PNR42909.1、PNR51400.1.小立碗藓
2.6 PaPR10基因的原核表达
使用BamH Ⅰ和Hind Ⅲ限制性内切酶分别对带有酶切位点的PaPR10基因片段和原核表达载体pET-32a进行双酶切,酶切产物纯化回收后与T4DNA连接酶连接,将获得的重组质粒pET-32a-PaPR10转入DH5α感受态细胞中。挑取单菌落进行菌液PCR扩增,得到与目的基因大小一致的特异性条带(图8),表明pET-32a-PaPR10表达载体的序列与目的基因序列一致。将构建好的pET-32a-PaPR10表达载体质粒转化至E.coliBL21(DE3)感受态细胞中,电泳结果表明,在500 bp左右位置处得到与目的基因大小一致的条带(图9),经公司测序分析后,验证该序列正确,表明已成功将PaPR10基因连接到原核表达载体pET-32a上。
M. DL2000; 1. pET-32a-PaPR10-DH5α
M. DL2000; 1. pET32a-PaPR10
2.7 PaPR10蛋白的原核诱导表达及条件优化
将IPTG设置为终浓度为0.2、0.4、0.6、0.8、1.0 mmol/L,在37 ℃下诱导3 h,SDS-PAGE电泳分析结果显示(图10,A),不同IPTG浓度梯度均能诱导表达出一条约为30 kD的融合蛋白(含His-tag标签蛋白),终浓度为0.8 mmol/L的IPTG诱导获得的目的蛋白量最多,且对照组均无融合蛋白表达。因此,以终浓度为0.8 mmol/L的IPTG作为最优诱导浓度进行诱导时间的优化。
诱导时间的优化结果。以终浓度为0.8 mmol/L的IPTG在37 ℃下诱导2、4、6、8和10 h,SDS-PAGE电泳分析结果显示(图10,B),不同诱导时间梯度均能诱导表达目的蛋白,随诱导时间的延长,目的蛋白的表达量也在逐渐增加,诱导10 h获得的目的蛋白量最为丰富,且对照组均无融合蛋白表达。因此,以诱导10 h作为最优诱导时间。
诱导温度的优化结果。以终浓度为0.8 mmol/L的IPTG在20、25、30和37 ℃下诱导10 h,分别取上清和沉淀同时检测表达的目的蛋白的可溶性。SDS-PAGE电泳分析结果显示(图10,C),不同诱导温度梯度均能诱导表达大量目的蛋白,在20 ℃下蛋白表达最为丰富,25 ℃下蛋白表达量次之,但二者差异不大。蛋白在上清和沉淀中均有明显存在,以包涵体居多。选择可溶性蛋白存在量最大的温度作为最适诱导温度,即30 ℃。因此,以终浓度为0.8 mmol/L的IPTG在30 ℃下诱导10 h为诱导重组蛋白的最优条件。
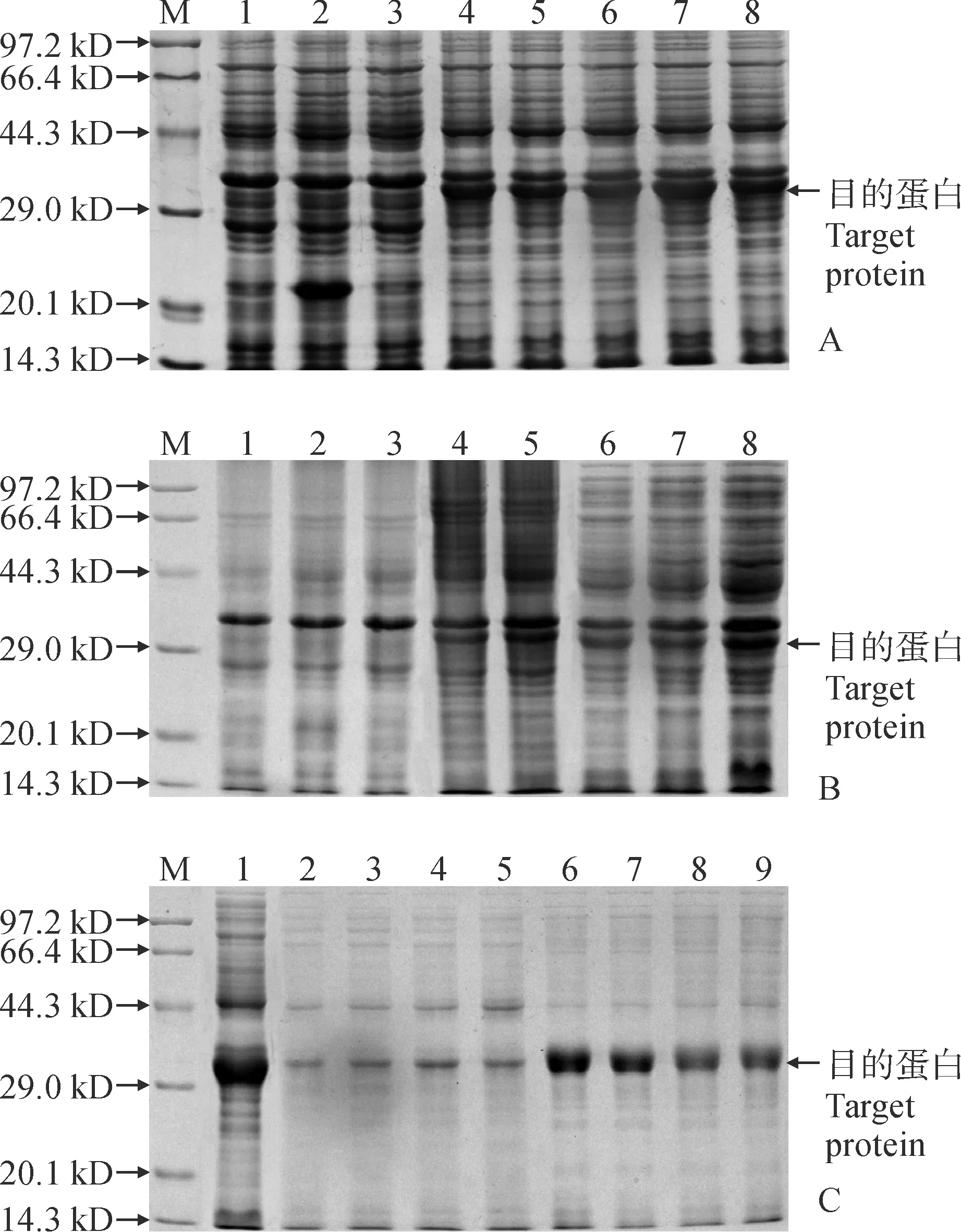
M.蛋白质分子量标准;A.最适IPTG 诱导浓度的优化:1.未加IPTG诱导的pET-32a空载体;2.0.5 mmol/L的IPTG诱导pET-32a空载体;3—8. IPTG 诱导终浓度为 0、0.2、0.4、0.6、0.8和1.0 mmol /L;B.最适诱导时间的优化:1.0.2 mmol/L的IPTG诱导pET-32a空载体10 h;2.未加IPTG诱导的pET-32a空载体;3.未加IPTG诱导的菌液;4—8. 诱导2、4、6、8和10 h;C.最适诱导温度的优化及蛋白可溶性检测:1.诱导全菌液;2—5. 20、25、30和37 ℃诱导上清中蛋白表达;6—9. 20、25、30和37 ℃诱导沉淀中蛋白表达
2.8 PaPR10蛋白的纯化及核酸酶活性检测
以最优诱导条件,即终浓度为0.8 mmol/L的IPTG在30 ℃下诱导10 h将重组蛋白在大肠杆菌中表达,使用His标签蛋白纯化试剂盒纯化蛋白。SDS-PAGE检测蛋白浓度,结果表明(图11,A),在30 kD左右处有条带(含His-tag标签蛋白),没有出现杂带,目的蛋白纯度较高。将纯化后的目的蛋白进行核糖核酸酶(RNase)活性检测。琼脂糖凝胶电泳结果表明(图11,B),PaPR10蛋白同对照一样,对RNA降解作用不明显,表明PaPR10蛋白基本不具备RNase活性。
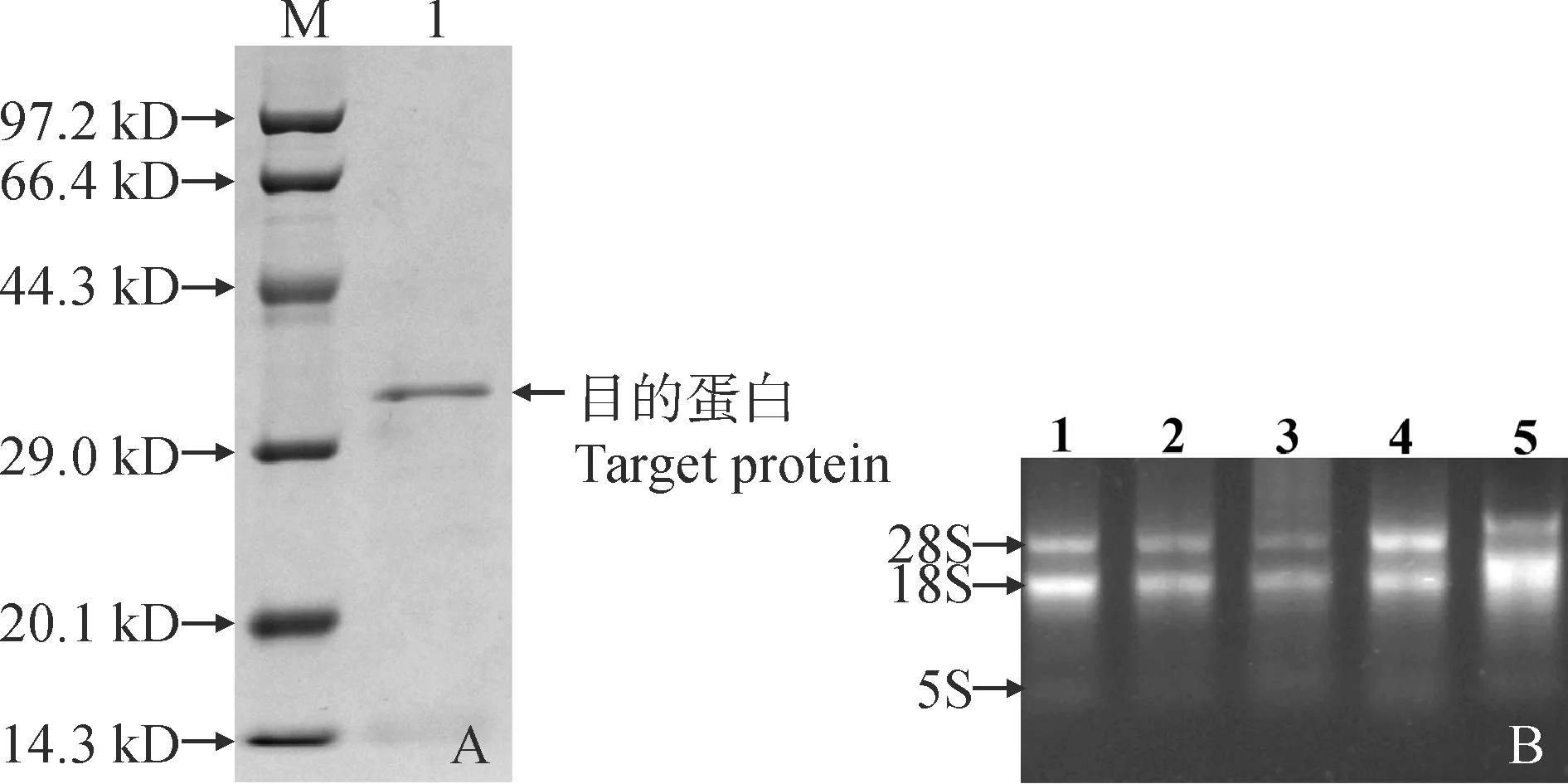
A.SDS-PAGE凝胶检测PaPR10纯化蛋白:M.蛋白质分子量标准;1.PaPR10纯化蛋白。B. PaPR10蛋白核酸酶活性分析:1. DEPC H2O;2. 蛋白非变性洗脱液液;3. RNA酶清除剂+PaPR10纯化蛋白溶液;4. PaPR10纯化蛋白溶液;5. RNA酶清除剂
3 讨 论
西南亚高山针叶林和针阔叶混交林区,是中国第二大天然林区,组成了长江中上游地区重要的生态屏障[24]。作为西南亚高山针叶林区的主要造林树种之一,云杉在涵养水源、土壤保育和生物多样性维持等方面具有重要作用[18]。然而长期以来,云杉林遭受着不同病害威胁,主要包括云杉落针病、云杉锈病和云杉干基白腐病等,极大地威胁着西南及长江中上游地区的生态屏障建设[25-26]。因此,挖掘云杉抗病基因资源,培育抗病云杉品种,才能更为有效地抵御不同病害的侵扰。本研究从粗枝云杉中首次克隆得到一个响应云杉落针病菌(Lophodermiumpiceae)侵染而显著上调的病程相关蛋白,即第10家族基因PaPR10,对其氨基酸序列进行分析发现,PaPR10蛋白是一类分子量约为16.5 kD、酸性、不含跨膜区、无信号肽且与RNase同源的胞内蛋白,属于IPR类,符合PR10蛋白的基本特征。高效率的蛋白质表达系统是阐明蛋白质的结构和功能的重要前提和基础[22],而IPTG浓度、温度和诱导时间是影响原核表达的主要因素[4]。因此,本研究利用pET-32a原核表达载体进行PaPR10蛋白表达,并对IPTG诱导目的蛋白表达的浓度、时间和温度进行了优化,结果表明,在30 ℃下利用0.8 mmol/L IPTG诱导10 h能够获得较为理想的可溶性蛋白,为后续核糖核酸酶活性测定提供充足的蛋白底物[4,19,22]。
Liu等[14,27]收集大量的植物PR10蛋白并对其进行系统发育分析,发现不同植物的PR10蛋白起源相同,多数植物PR10蛋白的氨基酸序列在进化过程中是高度保守的。本研究对PaPR10蛋白和不同植物的65个PR10蛋白序列构建系统发育树,同样也发现PR10蛋白在进化中是相对保守的。另外,研究中还发现,PR10蛋白的系统发育树主要有三大分支,包括双子叶植物分支、单子叶植物分支和裸子植物与苔藓植物聚为一支的分支,这与杨涛等[6]和Lebel等[28]的分析结果一致。从系统发育树还可以看出,PaPR10蛋白归属于裸子植物分支,且与北美云杉PR10蛋白的亲缘关系最近。不过,更有趣的是,PaPR10蛋白与更为低等的苔藓植物的PR10蛋白的亲缘关系比同科的海岸松、西部白松和白云杉PR10蛋白亲缘关系更近。以上结果表明裸子植物的PR10蛋白在进化中可能比被子植物更为缓慢。
生物信息学分析可知,PaPR10蛋白的C端含有保守序列(K-A-X-E-X-Y),该序列被认为是RNase催化作用的反应位点,该保守序列中E、Y被认为是影响RNase活性的最重要的两个氨基酸残基[27]。此外,PR10蛋白的P-Loop的保守结构域(G-X-G-G-X-G)被认为是核苷酸结合位点,其与PR10蛋白的RNase活性密切相关[29]。对于一些PR10蛋白,如辣椒CaPR10[30]、人参PgPR10[31]和麻风树JcPR-10a[23]等已确认其P-Loop结构域完整且具有RNase活性。然而,本实验中,该结构序列在PaPR10蛋白序列中改变为:GDGNVG,即第3个G碱基突变为了N碱基。对该蛋白的RNase活性进一步测定后发现,该蛋白水解RNA的活性甚微,这与从亚洲棉[28]和马铃薯[32]中分离出的同样存在P-Loop结构碱基突变的PR10蛋白的RNase检测结果一致,进一步说明了“P-Loop”结构与RNase活性的相关性。另外,Liu等[14]对西部白松的PR10蛋白家族的14个成员进行克隆表达后发现,发现该家族一员PmPR10-1.10蛋白虽具有完整的“P-Loop”结构域,但却不具有RNase活性。因此,推测“P-Loop”结构不是决定PR10蛋白RNase活性的唯一因素,而其他影响因素还有待研究。P-Loop保守结构域中氨基酸残基的缺失、插入、突变可能会导致PR10在进化过程中发生变异,形成新的催化位点,进一步提高植物在胁迫条件下的生存能力[33]。但P-Loop保守结构域的氨基酸残基的变化和作用,以及对RNase活性的影响还有待于今后进一步研究。
