PD-1/PD-L1通路在脓毒症晚期免疫抑制作用中的研究进展
2022-11-08蔡威,范骏
蔡 威,范 骏
(南昌大学第二附属医院急诊科,南昌 330006)
脓毒症是由于宿主对感染的反应失调而导致的威胁生命的器官功能障碍。随着人口老龄化的加剧其发病率逐年上升,每年消耗大量的医疗资源[1]。脓毒症是几种途径复杂相互作用的结果,包括炎症、免疫激活、缺氧等。目前缺少针对性治疗方案,前期的“集束化”治疗,虽可帮助部分患者平稳过渡,但部分患者会因晚期低免疫状态导致的凶险性感染而死亡[2-3]。有研究[4]通过对比多例ICU脓毒症与非脓毒症死亡患者的生化、流式细胞计数和免疫组织化学染色结果后,指出晚期脓毒症患者存在免疫抑制的现象,表现为脾脏CD4、CD8等T淋巴细胞高表达程序性细胞死亡受体1(PD-1)并广泛凋亡缺失。ZHANG等[5]研究发现,脓毒症动物T细胞、B细胞和单核细胞PD-1的高表达,在应用抗PD-1及抗程序性细胞死亡配体1(PD-L1)抗体后,可逆转脓毒症时T淋巴细胞耗竭,并显著提高脓毒症小鼠的存活率。本文将PD-1/PD-L1通路诱导晚期脓毒症免疫抑制机制的研究进展综述如下。
1 PD-1/PD-L1通路结构及其功能
PD-1(CD279)是于1992年在小鼠中首次发现的一种由228个氨基酸组成的I型跨膜糖蛋白,分子量为50~55 k Da,其由胞外免疫球蛋白可变型(V型)胞外区、跨膜区和执行胞内信号转导的胞浆尾部组成,后来被确认为CD28家族成员。其有2个识别的配体,一是PD-L1,又称为B7-H1或CD274;二是程序性死亡配体-2(PD-L2),也称为B7-DC,CD273[6]。PD-1在活化的T细胞、自然杀伤细胞和B细胞上表达,而PD-L1广泛表达于造血细胞和非造血细胞[7]。PD-1的下游信号事件包括基于细胞内免疫受体酪氨酸转换基序(ITSM)和基于免疫受体酪氨酸的抑制基序(ITIM),它们招募酪氨酸蛋白磷酸酶SHP1和(或)SHP2,并由此发挥其抑制功能[8]。生理状态下,机体可以通过PD-1/PD-L1途径防止过度免疫细胞活动导致的组织破坏和自身免疫;PD-L1在静息淋巴细胞、抗原提呈细胞(APC)的低水平表达,有助于保持促炎反应中免疫动态平衡和T细胞激活的高阈值,防止自身免疫的发生[9-11]。而在脓毒症初期高炎症反应下,机体通过PD-1/PD-L1对免疫反应的这种过度负性调控,导致晚期脓毒症免疫抑制的发生[12]。
2 PD-1/PD-L1通路与晚期脓毒症的免疫抑制
2.1 PD-1/PD-L1通路与T淋巴细胞功能障碍与凋亡
PD-1/PD-L1通路对T细胞功能调控主要通过以下途径。一方面,在T细胞受体(TCR)介导的T细胞活化过程中,PD-1与其配体结合后可阻断T细胞的增殖、细胞因子的产生和细胞溶解功能,并损害T细胞的存活[13]。PD-1激活后,将在胞浆中募集SHP-2去磷酸化TCR相关的ZAP70因子等,它们直接影响下游信号传导,降低细胞生存基因Bcl-x L和白细胞介素-2(IL-2)的表达,IL-2的减少可直接影响CD8+T细胞和CD4+T细胞的功能[14]。另一方面,T淋巴细胞的激活需要快速的能量及大量代谢中间产物的供应,为了适应细胞的代谢需求供能方式将从有氧糖代谢转为无氧糖酵解,这一过程称为代谢重编程。磷酸磷脂酰激酶-3/蛋白激酶B(PI3K/AKT)通路是其重要的信号通路,有研究[6,15-16]证实,T细胞表面PD-1被激活后,其胞内募集的募集SHP-2、SHP-1可阻断T细胞TCR和CD28的共刺激信号,对PI3K的激活,阻断下游AKT、雷帕霉素靶蛋白(m TOR)信号传导,导致细胞内葡萄糖转运体1(Glut1)的表达降低,细胞代谢重编程过程受阻,T细胞活化障碍,见图1。另外,PD-1募集的SHP2可以使酪蛋白激酶2(CK-2)去磷酸化诱导PTEN的激活,PTEN是PI3K/AKT通路的负性调控分子,它可以减少胞内PI3K的数量,从而抑制T细胞的增殖和活化信号的传递[17]。
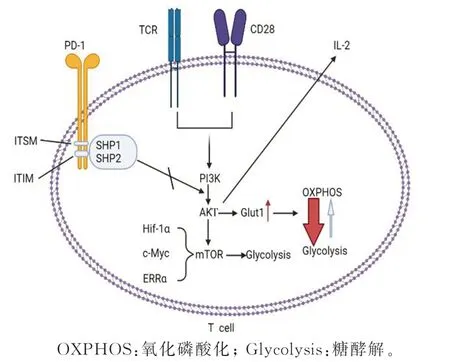
图1 PD-1/PD-L1与T细胞糖代谢信号通路
2.2 PD-1/PD-L1通路与调节性T细胞
调节性T细胞(Treg)是CD4+T细胞的一种谱系特异性亚型。生理情况下,PD-1/PD-L1通路和Treg是终止免疫反应的关键,PD-1途径诱导的Tregs细胞有助于保持T细胞激活的高阈值,两者任何一方的缺失都可能导致耐受性的崩溃和自身免疫的发展[7,18]。在存在转化生长因子-β的炎症部位,PD-1/PD-L1通路可促进Treg的分化成熟,负性调控免疫反应[7]。在脓毒症期间Tregs表面PD-1呈现高表达同时细胞占比增高[19]。PI3K/AKT通路下游的m TOR,是Treg分化的重要信号分子,在m TOR受到抑制后CD4+T细胞的激活不能分化为辅助性T细胞1型(Th1)、Th2和Th17亚群,转而分化为Tregs细胞[20]。Treg则可通过以下途径参与免疫调控:一方面Tregs细胞限制性转录因子叉头盒蛋白-3(forkhead box protein 3,fox P3)负向调节IL-2转录,上调IL-2R表达,使外源性IL-2成为Treg生存所必需;Treg表面高表达CD25(IL-2Rα)将竞争性争夺外源性IL-2,诱导效应T细胞的凋亡[19]。另一方面,Tregs可以利用其表达的颗粒酶A和穿孔素,杀伤靶细胞来介导效应T细胞或自然杀伤细胞的细胞溶解,来发挥其免疫抑制功能[21]。
2.3 PD-1/PD-L1途径与髓原性抑制细胞
髓源性抑制细胞(MDSCs)是一组异质性的未成熟髓样细胞(IMCs),主要群体可分为粒细胞(PMN-MDSC)和单核细胞(M-MDSC)两大类,有研究[22-23]证实,它们可通过不同的机制抑制免疫反应,脓毒症患者的MDSCs显著增加。RUAN等[24]发现,MDSCs及其亚群在小鼠盲肠穿刺结扎术后第1天减少,但在脓毒症进展期间持续增加,相较于MMDSC,PMN-MDSC所占比例更高,且在早期骨髓来源的PMN-MDSC中的PD-L1mRA水平也有升高;同时将高表达PD-1的PMN-MDSC与健康小鼠的脾细胞进行体外共培养,证实PMN-MDSC对T细胞的增殖具有较强的抑制作用。脓毒症时PMN-MDSC作为主要亚群可能在早期就通过PD-1/PD-L1通路抑制淋巴细胞增殖,而参与脓毒症免疫抑制,MDSCs的抑制活性可能由一氧化氮、S100A8和S100A9等蛋白介导[25]。
2.4 PD-1/PD-L1途径与树突状细胞
树突状细胞(DC)是一种特殊细胞是专职提呈抗原给T淋巴细胞帮助其活化,是T细胞免疫反应的主要激活因素,也可调节控制T细胞免疫耐受和免疫激活之间的平衡[26]。PD-L1与DC上表达的PD-1结合,导致DC凋亡增加、数量减少和成熟紊乱,减弱了T细胞的免疫活性[27]。LIU等[28]研究证实,脓毒症小鼠DC细胞表面PD-1表达上调伴随组织相容性复合基因Ⅱ(MHC-Ⅱ)分子的减少,细胞活性减弱;将多器官功能障碍综合征(MODS)期小鼠DC细胞与正常小鼠脾脏T细胞体外共培养发现,正常脾T细胞增殖受到较强抑制,IL-2的分泌明显减少;而在上述共培养系统中加入抗PD-L1抗体后上述情况得到改善。酪氨酸激酶-3配体(FLt3L)作为造血祖细胞发育和扩增髓系和淋巴系所必需的细胞因子,可以减少感染引起的脾脏CD4+和CD8+T细胞的减少,下调脾脏树突状细胞PD-1的表达水平,提高烧伤创面脓毒症小鼠的存活率[29]。由此可知,PD-1/PD-L1通路在脓毒症免疫抑制中的影响是多层次的。
2.5 PD-1/PD-L1通路与单核细胞
有研究团队[30]选取脓毒症和非脓毒症患者,检测他们外周血CD4+T细胞、CD8+T细胞和单核细胞上PD-1和PD-L1的表达,认为单核细胞PD-L1表达随病情加重而逐渐升高,回归变量分析也显示单核细胞PD-L1表达是患者28 d病死率的独立预测因子。XIA等[31]研究发现,脓毒症患者单核细胞吞噬功能失活、促炎细胞因子释放减少,分泌功能减弱;在体外用抗PD-L1抗体阻断PD-1/PD-L1通路后,单核细胞功能得到明显改善,如关键细胞因子干扰素-γ和IL-2的表达得到一定程度恢复。综上可以推测,脓毒症时PD-1单核细胞表达升高可能与单核细胞功能障碍存在密切的关系,是晚期脓毒症患者抵抗力低下的又一原因。
3 脓毒症联合性治疗靶点
PD-1/PD-L1、LAG3、TIM-3等免疫负性调控分子是脓毒症联合性治疗靶点。WANG等[32]研究发现,淋巴细胞激活基因3(LAG3)的激活可以抵抗肿瘤中抗PD-1/B7治疗的效果。其他研究[33-35]证实,LAG3和PD-1的双重封闭比单独封闭能产生更强大的抗肿瘤或抗病毒作用。有团队[36]发现,脓毒症患者LAG3和PD-1共表达的T细胞比例越高,则住院时间越长,病死率越高。另有研究[31]证实,脓毒症时T淋巴细胞和单核细胞中T细胞TIM-3和PD-1的表达升高;阻断TIM-3和PD-1有助于淋巴细胞和单核细胞恢复功能。以上研究表明,晚期脓毒症的免疫抑制是一个多因素参与、复杂的病理生理过程,PD-1/PD-L1通路及其他负性免疫调控因子在晚期脓毒症患者的免疫抑制中存在协同作用。
4 结语与展望
PD-1/PD-L1通路在晚期脓毒症患者的免疫抑制中起着关键作用。患者免疫力低下,机会致病菌的感染风险增加是晚期脓毒症患者死亡的重要原因。晚期脓毒症免疫抑制是多细胞、多种群、多层次参与的复杂病理生理过程。抗PD-1生物抗体在体内和体外实验中取得一定成效,证实PD-1/PD-L1通路在晚期脓毒症免疫抑制中的重要作用,也提示其作为治疗靶标的可行性。随着对PD-1/PD-L1信号通路及其他负性免疫调控分子研究的不断深入,晚期脓毒症免疫抑制病理生理过程也将逐渐被阐明,这给脓毒症的治疗带来更加可行有效的方案。
