肺腺癌预后相关坏死性凋亡基因标志物的构建及验证
2022-11-08欧阳锦余石群曾凡凡高丽云黄邵鑫
罗 亭,欧阳锦,余石群,曾凡凡,高丽云,黄邵鑫,汪 鑫
(1.南昌大学公共卫生学院,江西省预防医学重点实验室,南昌 330006;2.九江学院基础医学院精准预防医学实验室,江西 九江 332000)
肺癌严重危害人们的健康和生命。2020年肺癌的发病率和病死率分别位居全球癌谱第二和第一位,且患者的5年生存率只有10%~20%[1]。2022年我国约有87万肺癌新发病例和近77万因肺癌死亡病例,而且肺癌在癌症负担中的比例最高[2]。根据病理类型,肺癌主要可以分为2大类:小细胞肺癌与非小细胞肺癌(NSCLC)。临床上约85%的肺癌患者属于NSCLC,而肺腺癌(LUAD)是NSCLC中最常见的组织学亚型[3]。尽管目前针对LUAD的综合治疗方法如化疗、放疗和分子靶向治疗已经被开发出来,但患者的总生存率仍然很低,复发率很高[4]。因此,寻找有效的LUAD预后标志物在其防治中具有重要意义。
许多肿瘤对细胞凋亡逐渐产生抗性,因此诱导凋亡以外的其他细胞死亡成为一种新的癌症治疗策略[5]。坏死性凋亡是一种新型的细胞程序性死亡,其中坏死性刺激所形成的坏死体在启动坏死性凋亡过程中发挥关键作用,而受体互作蛋白(RIP)1和RIP3是坏死体的核心组成部分;在坏死体中,RIP3可引起混合谱系激酶样结构域(MLKL)发生磷酸化,导致MLKL寡聚并转运到质膜上,而在质膜上的MLKL可形成可渗透的离子通道,引起细胞变化,从而破坏质膜的完整性[6]。坏死性凋亡是一种高度炎症性的细胞死亡形式,在癌症的发生、发展和转移中具有非常复杂的作用[7]。近期有研究[8]发现,坏死性凋亡相关基因(NRGs)的表达水平可作为预测肺鳞状细胞癌患者生存的重要指标。而坏死性凋亡基因是否可预测LUAD患者的预后,目前尚未见相关报道。本研究旨在通过公共数据库数据筛选和构建肺腺癌预后相关的坏死性凋亡基因标志物并对其进行验证,为LUAD预后标志物库的建立提供依据。
1 资料与方法
1.1 资料来源
在KEGG通路数据库(https://www.kegg.jp/kegg/pathway.html)中以关键词“necroptosis”进行检索筛选NRGs,共筛选出159个NRGs。通过UCSC xena网 站(https://xenabrowser.net/datapages)下载TCGA数据库中LUAD样本(LUAD组)和正常样本(正常组)中NRGs的RNA测序数据和对应患者的临床数据,其中LUAD组487例,正常组58例。从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中筛选出1个LUAD数据集(GSE31210),其中LUAD组226例、正常组20例。以TCGA-LUAD数据集作为训练队列,建立NRGs的LUAD预后标志物,另以GSE31210数据集作为验证队列,检验预后标志物的预测能力。
1.2 研究方法
1.2.1 差异表达NRGs的筛选与功能富集分析
采用R语言中的“DESeq2”和“limma”R包分别对TCGA-LUAD数据集和GSE31210数据集中NRGs进行差异分析,按照|log2FC|>1和调整后P<0.05的标准从中筛选出差异表达的坏死性凋亡相关基因(DENRGs)。使用“cluster Profiler”R包对DENRGs进行GO、KEGG与GSEA功能富集分析。
1.2.2 与LUAD预后相关的NRGs的构建
在训练队列中,以OS为临床终点,采用“survival”R包对DENRGs进行单因素Cox回归分析,确定与LUAD预后相关的DENRGs;使用“glmnet”R包,采用Lasso Cox回归筛选关键DENRGs;结合关键DENRGs的表达水平及其相应Lasso Cox回归系数,采用公式计算每个LUAD患者的风险评分并构建预后标志物。风险评分=基因1表达水平×基因1系数+基因2表达水平×基因2系数2+……+基因n表达水平×基因n系数。以风险评分的中位数作为分界点,将其分为低风险组和高风险组,使用“survival”R包对2组进行Kaplan-Meier生存分析以评估2组在OS上是否存在差异。log-rank统计方法检验其显著性,“survminer”R包用于可视化。采用“timeROC”R包对预后标志物进行时间依赖受试者工作特征分析(timeROC),并使用“ggplot2”R包绘制ROC曲线。分析不同风险评分与患者的生存时间、生存状态及预后标志物基因表达变化的关系,并绘制风险曲线三图(曲线图、生存状态图和热图)。同理,在验证队列中采用相同的基因和公式计算LUAD患者风险评分,并对其进行生存分析和timeROC分析,从外部验证该预后标志物预测的准确性。
1.2.3 独立预后分析和临床预测列线图的构建
采用“survival”R包对预后标志物和其他传统临床特征进行单因素和多因素Cox回归分析,以评估预后标志物是否可以独立预测LUAD患者的OS,“forestplot”R包用于结果的可视化。同时采用“survival ROC”R包对预后标志物和各项临床特征做timeROC分析并进行可视化。结合生存时间、生存状态、临床因素和预后标志物的数据,使用“rms”R包建立列线图预测LUAD患者1、3、5年的生存率。通过一致性指数(C-index)和校准曲线评价该列线图对LUAD患者预后的预测准确性。
1.2.4 统计学方法
使用R(http://www.R-project.org)软件进行数据处理和分析。所有统计检验均为双侧。以P<0.05为差异有统计学意义。
2 结果
2.1 差异表达的NRGs
差异表达分析显示,LUAD组和正常组间有26个DENRGs表达存在差异,其中13个基因(PARP1、TRAF5、PGAM5、PLA2G4A、TRAF2、JAK3、CHAMP4C、CAMK2B、ZBP1、RNF103-CHMP3、PLA2G4D、IFNG、IFNB1)表达上调和13个基因(PLA2G4F、IL33、TLR4、CYBB、TNFAIP3、CAMK2A、PYGM、MAPK10、IL1B、ALOX15、IL1A、IFNA21、IFNA5)表达下调。基因差异表达的火山图见图1A。箱线图揭示了这些DENRGs在LUAD与正常组间的具体表达情况。见图1B。

图1 NRGs的差异表达分析
2.2 DENRGs的功能富集和通路分析
对26个DENRGs的GO功能注释结果显示:在生物过程中主要富集的条目包括“细胞因子介导的信号通路”、“白细胞增殖”和“适应性免疫反应的调节”;在细胞成分中主要富集于“细胞质膜的胞质侧”;在分子功能方面,主要富集于“细胞因子受体结合”等条目。见图2A。KEGG分析结果发现,26个DENRGs参与的代谢通路主要有坏死性凋亡、结核病、核苷酸寡聚结构域样受体信号通路以及脂质和动脉粥样硬化。见图2B。
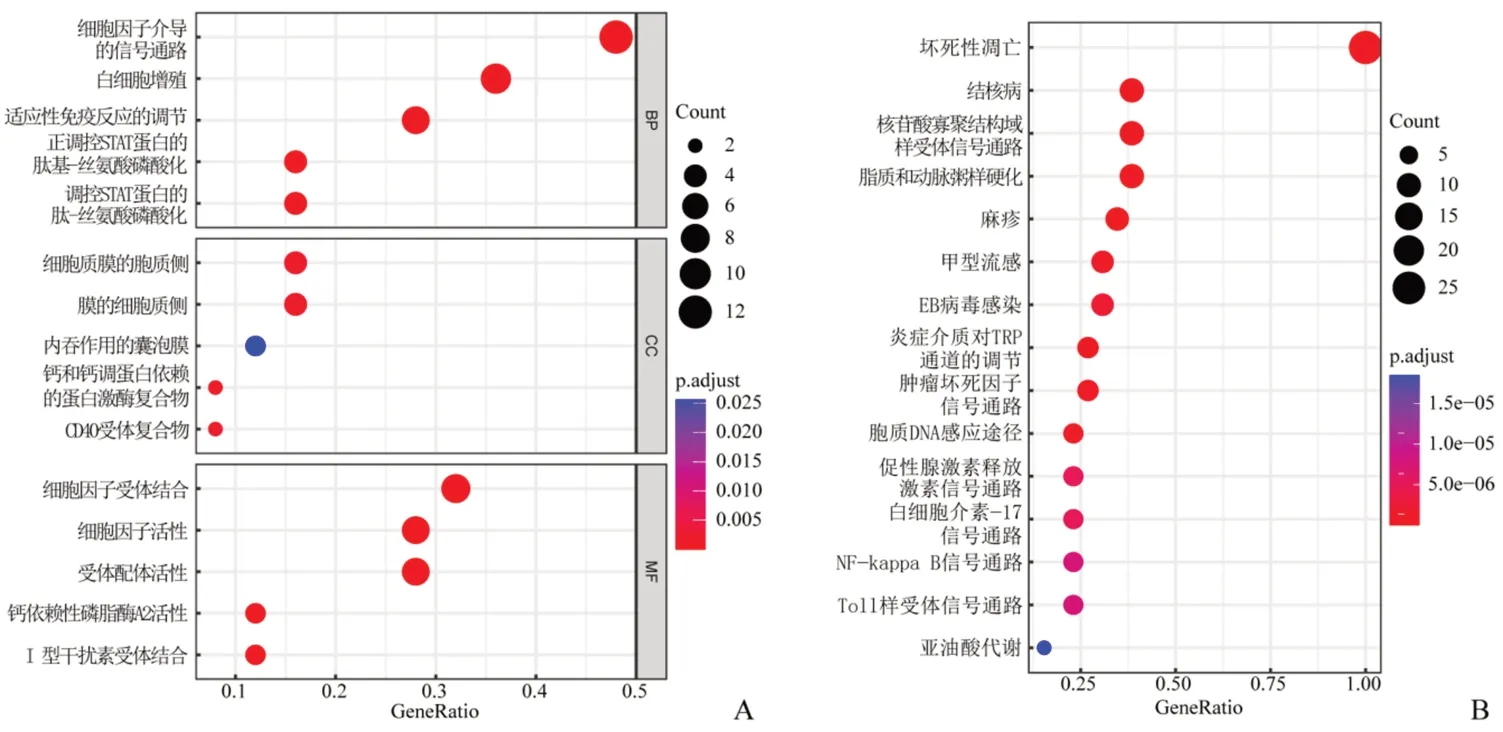
图2 DENRGs的功能富集与通路分析
2.3 NRGs相关LUAD预后标志物的构建与验证
对DENRGs进行单因素Cox回归分析筛选出6个与LUAD预后相关的基因(均P<0.05)。见图3A。Lasso Cox回归分析显示6个基因均与LUAD预后显著相关,可直接用于构建预后标志物。见图3B—C。风险评分显示,高风险组(风险评分>-0.581 3)243例、低风险组(风险评分≤-0.581 3)244例。Kaplan-Meier生存分析显示,高风险组和低风险组中位生存时间分别为3.2年和4.7年,其差异有统计学意义(log-rankP<0.001)。见图3D。timeROC分析结果显示:该预后标志物对LUAD患者1年、3年、5年生存率的AUC值分别为0.672、0.631和0.624。见图3E。随着风险评分的升高,LUAD患者的生存时间逐渐减少,PLA2G4F、IL33、TLR4和ALOX15基因的表达量呈下降趋势,而RNF103.CHMP3和IL1A基因的表达量呈上升趋势。见图3F。

图3 NRGs相关LUAD预后标志物的构建与验证
2.4 预后标志物是LUAD患者中的独立预后因子
单因素Cox回归分析的结果发现:预后标志物、肿瘤分期、T、N、M分期均与LUAD患者的OS相关。见图4A。多因素Cox分析,只有预后标志物与LUAD患者OS显著相关(HR:2.30,95%CI:1.30~4.00,P<0.01)。见图4B。timeROC分析显示:预后标志物的AUC值(0.689)虽较低于肿瘤分期(0.712),但高于年龄(0.465)、性别(0.551)、肿瘤T(0.647)、N(0.666)、M(0.505)分期。见图4C。
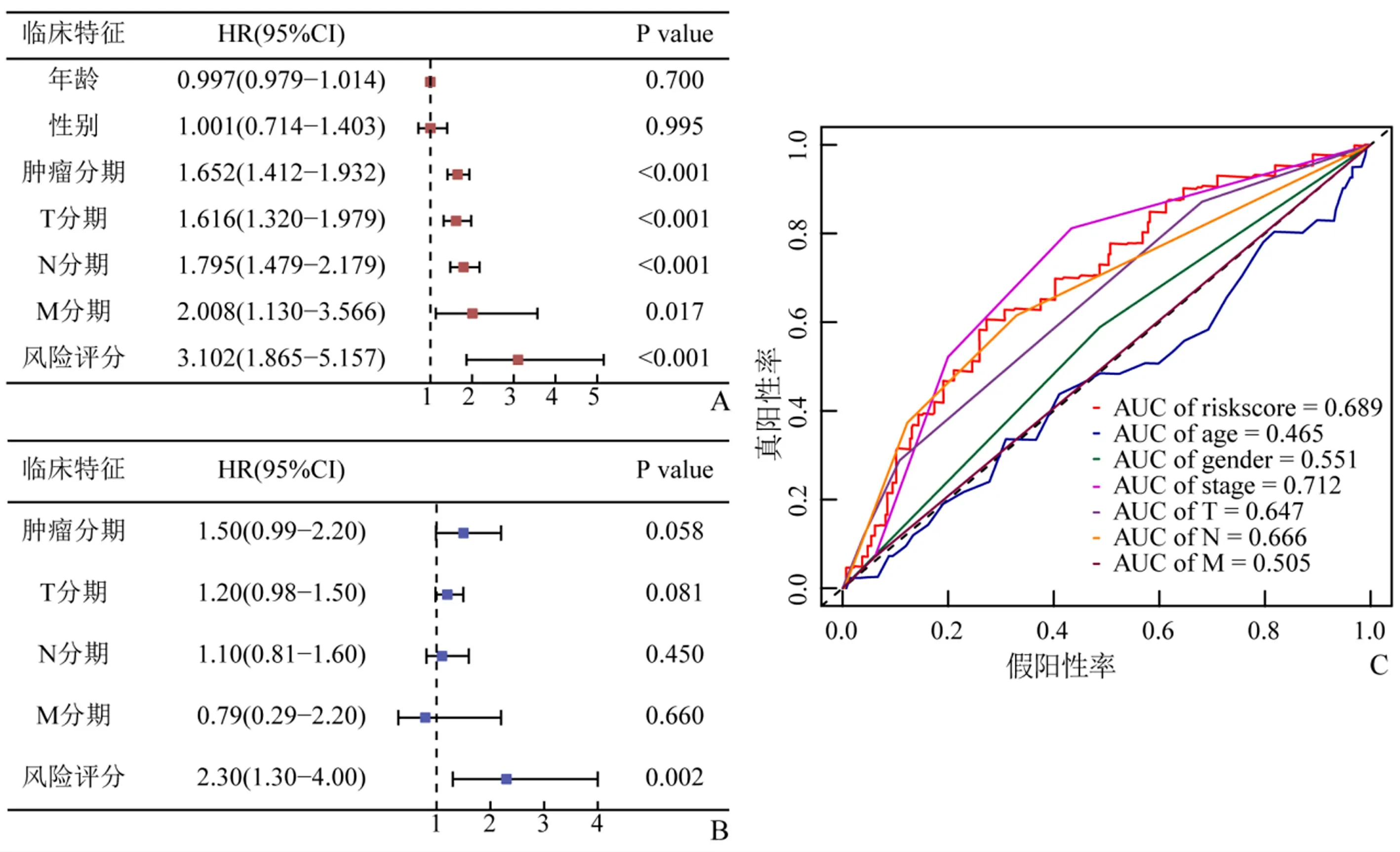
图4 预后标志物的独立预测分析

图3(续)
2.5 预测LUAD患者生存率的临床列线图
结合风险评分、肿瘤分期、T分期和N分期构建了一个临床预测列线图。见图5A。对于1例特定LUAD患者,可根据该患者的这4个特征值分别向上画1条垂直线,即可得到其对应的分数。最后将所有的分数相加得到总分,并以总分为基础向下画1条垂直线,即可得到该患者对应的未来1年、3年和5年的生存率。C-index分析显示该列线图总体的Cindex为:0.71(95%CI:0.68~0.75,P<0.000 1),其1年、3年和5年校准曲线显示该列线图所估计的病死率与实际病死率接近。见图5B—D。

图5 预测LUAD患者生存率的临床列线图
2.6 GEO数据集中预后标志物的外部验证
对GSE31210数据集中DENRGs的GSEA分析结果显示:显著富集的坏死性凋亡相关通路主要包括P53信号通路、通过NF-KB传递TNFA信号通路、凋亡通路、同种异体移植排斥和炎症应答。见图6A。风险评分显示,高风险组(风险评分>-0.458 1)113例、低风险组(风险评分≤-0.458 1)113例。Kaplan-Meier生存分析显示高风险组的OS短于低风险组(log-rankP<0.001),如图6B所示。同时,ROC分析结果中其AUC值为0.750。见图6C。
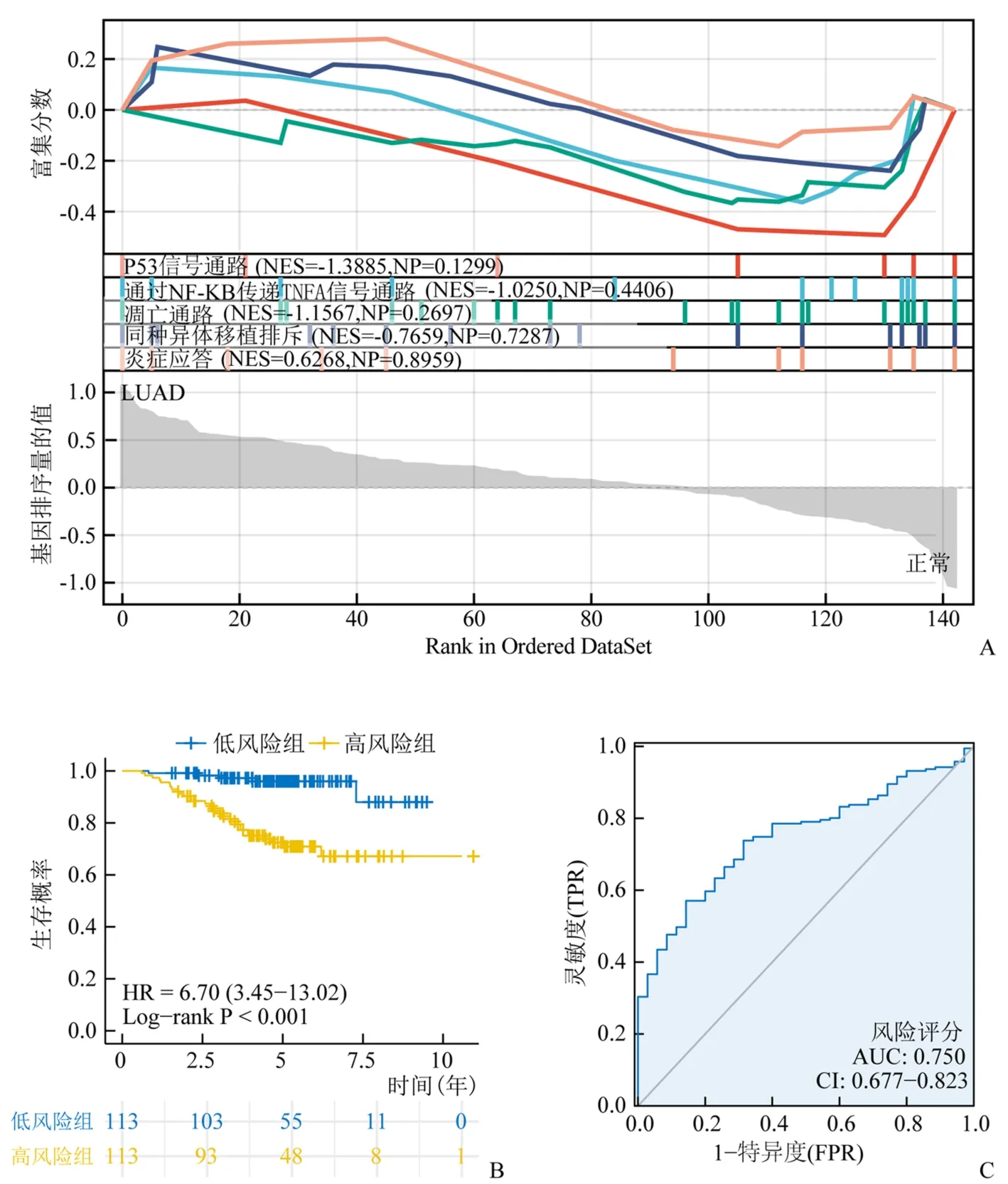
图6 预后标志物的验证
3 讨论
目前LUAD的发病机制尚不明确[9],且其预后的影响因素众多,故LUAD患者的预后不佳[10]。有研究[11]发现相比于单一的基因生物标志物,将多个生物标志物整合而成的综合标志物可以提高对肿瘤预后的预测准确性,并有助于制定个体化治疗计划来改善预后。
坏死性凋亡是一种新型的非半胱天冬酶的程序性细胞死亡[12],在各种疾病中发挥重要作用[13]。坏死性凋亡在肿瘤中是一把“双刃剑”[12]:一方面,坏死引起的炎症环境会促进肿瘤的发展和转移[14];另一方面,坏死可促进肿瘤微环境中树突状细胞的成熟和CD8+T细胞的交叉激活,从而抑制肿瘤的发展[15]。
坏死性凋亡在LUAD发生和发展过程中的作用目前研究不多。本研究基于公共数据库中LUAD患者测序数据,从159个NRGs中筛选出6个与LUAD预后密切相关的基因,并成功构建综合预后标志物。该预后标志物的AUC值均大于0.6,说明其不仅能够预测LUAD患者的生存率,而且预测性能较好。同时,风险热图显示PLA2G4F、IL33、TLR4和ALOX15对于LUAD可能是保护基因,而RNF103.CHMP3和IL1A基因则与LUAD预后不良相关。先前研究[16-20]也提示该预后标志物中的6个基因均与肿瘤相关。其中,IL1A、IL33和TLR4与NSCLC的发生发展密切相关;PLA2G4F在口腔癌的花生四烯酸代谢通路中发生了突变[16];RNF103.CHMP3基因在三阴性乳腺癌细胞中显著下调;ALOX15的表达在结直肠癌中出现明显下调[18];IL1A是NSCLC的诊断性生物标志物[19];IL-33可通过调控miR-128-3p/CDIP1信号通路从而促进NSCLC细胞的生长[20];TNF家族中的死亡受体TLR4与干扰素受体的结合可以触发坏死[12],提示TLR4的表达可能与LUAD的预后不良相关。
本研究中单因素和多因素Cox回归分析结果显示该预后标志物的HR值均大于1,说明该预后标志物是影响LUAD患者OS的危险因素,在临床实践中可作为LUAD患者的重要独立预测因子。此外,本研究基于该预后标志物结合临床特征建立了预测列线图,且该预测列线图的校准曲线与标准曲线接近,说明该列线图在预测LUAD患者的生存风险方面具有较高的准确度。而且GSE31210数据从外部验证该预后标志物预测LUAD患者的预后具有较高的准确性。但是,后期研究应在临床LUAD患者中进一步验证该预后标志物的预测价值及稳定性。
综上所述,本研究成功构建NRGs相关的综合预后标志物库,可用于预测LUAD患者的预后,并通过GEO数据库对该标志物库加以验证,结果表明其在预测LUAD患者预后方面具有较好的能力。
