系统性炎症反应指数在胆囊癌预后预测中的作用及模型建立
2022-11-08郑林林邱模竞章小明潘希望郑张耀李太原胡家平
郑林林,邱模竞,章小明,潘希望,郑张耀,李太原,胡家平
(南昌大学a.第一附属医院普通外科;b.第二附属医院泌尿外科,南昌 330006)
胆囊癌(GBC)是最常见的胆道恶性肿瘤之一,发病率较高且预后极差[1-2]。在中国,胆囊癌的发病率位居消化道肿瘤的第6位,5年总体生存率仅为5%[3]。多数患者在初次诊断时已属病程晚期,易发生肝脏及淋巴转移[4-5]。目前,外科手术干预仍是改善胆囊癌患者长期生存的主要手段[6-7]。
临床上多依据组织病理学分类和临床病理参数预测患者的预后,包括肿瘤分期、肿瘤分化程度、淋巴结状况、组织学类型、糖类抗原-19-9(CA19-9)和癌胚抗原(CEA)等[8],但预测的准确性差强人意[9-10]。TNM分期相同的GBC患者接受相似的治疗方案,其临床转归差异依然较大,预后评估的价值有限。
现有研究[11-12]表明,局部和全身炎症反应在多种癌症的发生发展和侵袭转移过程中都发挥着巨大的作用。血常规和血液生化指标中的白细胞、中性粒细胞、淋巴细胞、血小板和急性时相蛋白(包括C反应蛋白和不规则白蛋白)指数通常可反映全身炎症反应水平[13]。循环炎症标志物如单核细胞/淋巴细胞比率(MLR)、中性粒细胞/淋巴细胞比率(NLR)和血小板/淋巴细胞比率(PLR)常被用来预测多种恶性肿瘤的临床预后。QI等[14]定义了一项新的炎症标志物即全身性炎症反应指数(SIRI),在胰腺癌、胃癌、鼻咽癌和GBC等多种肿瘤的预后预测中发挥了积极作用。SUN等[15]报道了SIRI在GBC中的预后预测价值,但该研究纳入的120例患者中只有56.5%接受了根治性手术,R0切除率仅为65.3%。目前尚不清楚SIRI对接受根治性手术的GBC患者的预后预测是否有确切价值。本研究通过分析胆囊癌患者的临床病理资料和预后情况,探讨术前SIRI参数与接受根治性切除术的GBC患者预后结局的相关性,并比较SIRI与NLR、PLR、MLR的预后预测能力。
1 对象和方法
1.1 研究对象
本研究为回顾性队列研究,选取2010年5月至2019年9月期间于南昌大学第一附属医院普通外科接受根治性手术的169例GBC患者作为研究对象。根据术前血液生化检查结果将入选患者分为高SIRI组(>1.19)和低SIRI组(≤1.19),SIRI计算方法和分组依据见1.3和2.1。
纳入标准:1)接受GBC根治性切除术;2)GBC组织病理学诊断明确;3)术前实验室检查结果完整;4)临床病理资料和术后随访资料完整。排除标准:1)术前7 d内有感染性疾病史者;2)资料不完整者;3)术前有免疫或血液病史者;4)因围手术期相关并发症死亡的患者;5)手术后1个月内死亡者。本研究经南昌大学第一附属医院伦理委员会批准,纳入患者或其家属均签署知情同意书。
1.2 手术方法
所有入组患者均行根治性切除术,Tis和T1a期患者行腹腔镜或开腹胆囊切除术,T1b~T3期患者需根据具体情况行胆囊切除术+常规或扩大淋巴结清扫+肝切除术(楔形或IVb+V段,甚至半肝及以上);T4期患者常需在胆囊癌根治术的基础上联合周围脏器切除(包括右半结肠切除、胃大部切除术等)。常规淋巴结清扫范围:胆囊颈部、胆总管、门静脉及肝固有动脉处淋巴结。扩大淋巴结清扫范围:常规淋巴结清扫范围+肝总动脉、胰头后上区域等更远处淋巴结。
1.3 资料收集及随访
收集的临床资料包括:性别及年龄;肿瘤TNM分期、组织学类型及分化程度;胆结石情况;辅助化疗记录;病理组织学报告;术前血液生化检查结果。其中,TNM分期采用AJCC第8版GBC分期标准[16];外周血生化检查于术前7 d内进行,检测项目包括CA19-9、CEA、中性粒细胞(N)、血小板(P)、淋巴细胞(L)和单核细胞(M)计数。根据术前血液生化检查结果计算:NLR=N/L;PLR=P/L;MLR=M/L;SIRI=N×M/L。
随访方案:进行门诊随访和电话随访,手术后第1年和第2年每3个月随访1次,第2年以后每6个月随访1次。门诊随访的检查项目包括体格检查、实验室检查及上腹部CT。随访截止日期为2021年4月1日。总体生存时间(OS)为术后第1天至死亡或随访截止时间。
1.4 统计学方法
使用SPSS24.0软件和R4.0.1软件进行统计分析。计数资料以百分率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间生存状况比较采用Log-rank检验。采用ROC曲线分析确定SIRI最佳分界值。采用单因素和多因素Cox比例风险回归模型分析各临床特征对OS的影响。利用R4.0.1软件生成预测OS的列线图,并用Harrell’s一致性指数(C-index)及校正曲线评价其预测能力。用Logistic回归分析计算其倾向性的评分值,最后根据倾向性评分值采用最小毗邻法对两组个体相近的进行1∶1匹配,卡钳值设置为0.3。以P<0.05为差异有统计学意义。
2 结果
2.1 术前SIRI的计算及最佳分界值
根据术前外周血中性粒细胞、单核细胞及淋巴细胞计数计算SIRI,进行ROC曲线分析。结果显示:曲线下面积为0.69,通过Youden指数计算得SIRI判断术后生存状态的最佳分界值为1.19,其对应的灵敏度为0.64,特异度为0.80。NLR、PLR和MLR的最佳分界值分别为1.99、130.69和0.25。见图1。
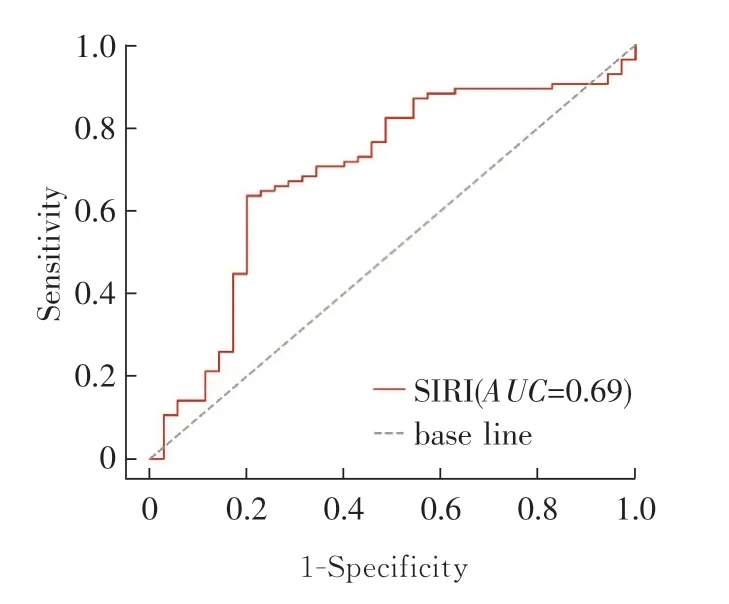
图1 术前SIRI判断结直肠癌患者术后生存状态的ROC曲线
2.2 2组基线临床病理资料比较
分析比较高SIRI组(>1.19)和低SIRI组(≤1.19)倾向性评分前后的基线临床病理资料,其中男性61例(36.1%),TNM分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期患者分别为27、27、89、26例,总体中位OS为32.0个月,中位随访期为56个月(1~100个月)。2组患者性别、年龄、胆囊结石、辅助化疗、分化程度、组织学类型、分化程度等一般资料比较差异无统计学意义(P>0.05);而CEA、CA199、TNM分 期、PLR、NLR、MLR在不同SIRI组间有显著差异(P<0.05)。见表1。

表1 2组基线临床病理资料比较(倾向性评分前后)
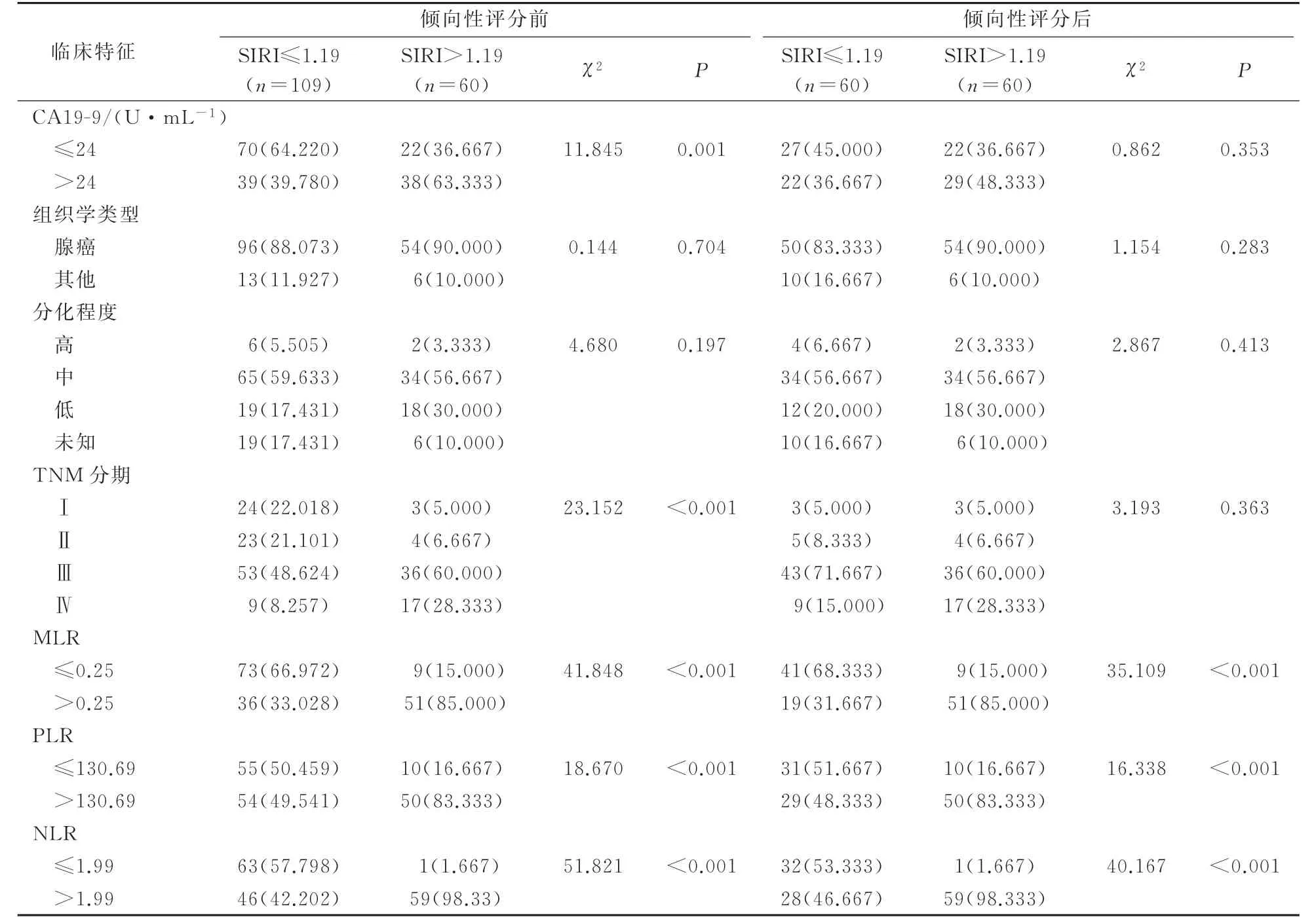
表1(续)
2.3 SIRI、NLR、MLR、PLR与OS的关系
Kaplan-Meier生存分析显示,SIRI值、NLR值、PLR值及MLR值均能较好地预测患者预后OS,且SIRI的预后预测价值较NLR,PLR,MLR更强(图2)。低SIRI组的OS明显好于高SIRI组(P<0.001),NLR值、PLR值、MLR值与OS的关系如图2B—D所示,分别P<0.000 1、P=0.001 8和P<0.000 1。Cox多因素分析显示,SIRI、NLR、TNM分期、CEA、CA19-9是独立的预后因素(均P<0.05),见表2。随访1、3、5年的ROC曲线显示,SIRI的预测能力优于NLR、MLR和PLR,见图3。
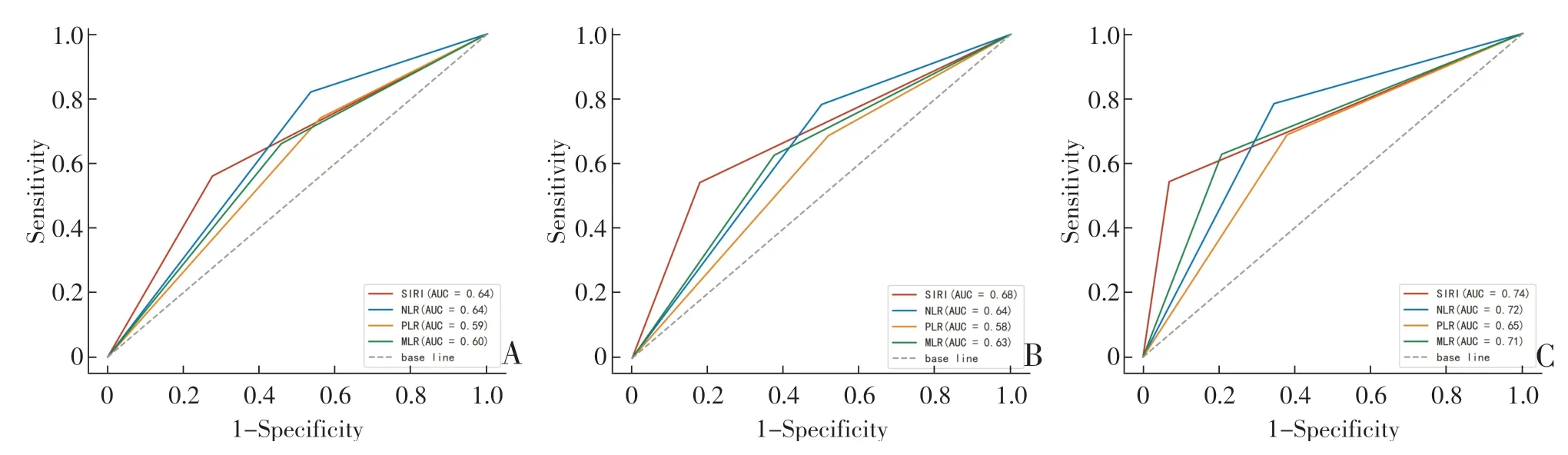
图3 SIRI、NLR、PLR、MLR预测预后的ROC曲线
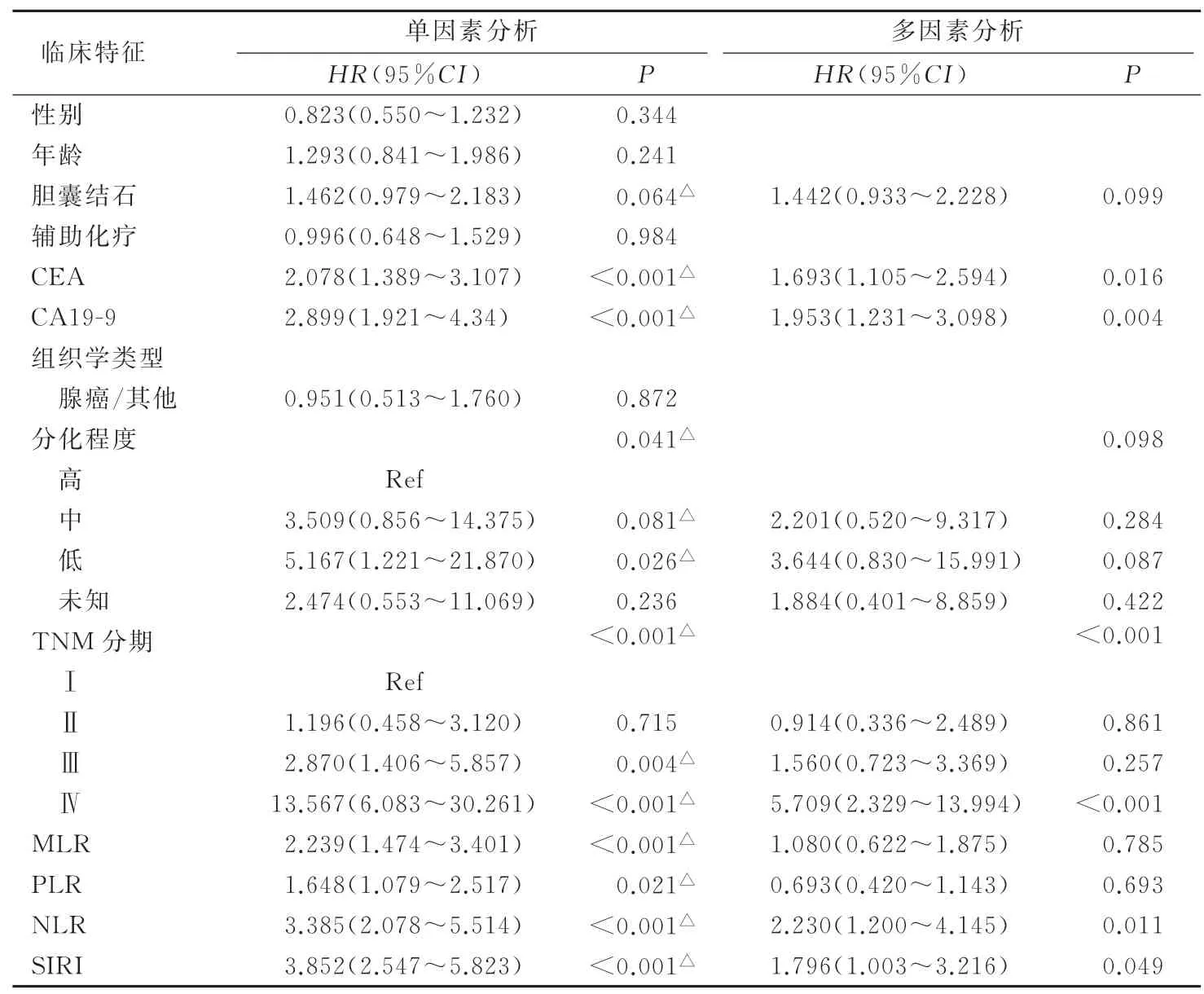
表2 GBC患者OS的Cox单因素及多因素回归分析(倾向评分前)
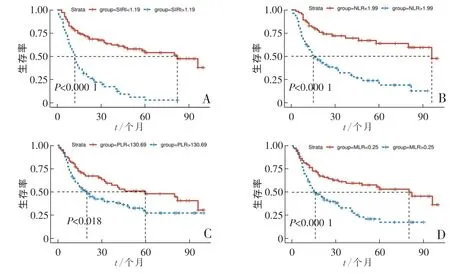
图2 基于SIRI、NLR、MLR、PLR分层的生存曲线分析
2.4 预测GBC患者OS的列线图
在最终模型中纳入SIRI、NLR、TNM分期、CEA、CA199等基线变量,并通过R软件形成列线图,见图4。在内部验证中,列线图的校准曲线在预测1、3和5年的OS方面表现较好,表明模型预测OS的准确性较好,见图5。列线图的C-index为0.781。

图4 预测GBC患者OS的列线图

图5 预测总生存概率的模型校准图
2.5 倾向性评分匹配分析
2组基线临床病理特征的不平衡可能会影响结果的可靠性。通过PSM分析,选取了低SIRI组和高SIRI组患者各60例,匹配后2组之间的差异达到了较好的平衡,见表3。PSM分析后,Kaplan-Meier生存曲线显示2组之间仍有显著差异(P<0.05,图6),Cox多因素分析表明SIRI仍是OS的独立预测因子,见表3。

表3 GBC患者OS的Cox单因素及多因素回归分析(1∶1倾向评分后)

图6 PMS后基于SIRI分层的生存曲线分析
2.6 SIRI对不同TNM分期GBC患者生存的影响
不同SIRI组在TNM分期(Ⅰ+Ⅱ)和TNM分期(Ⅲ)差异具有统计学意义(分别P=0.003 7和P=0.027,图7)。
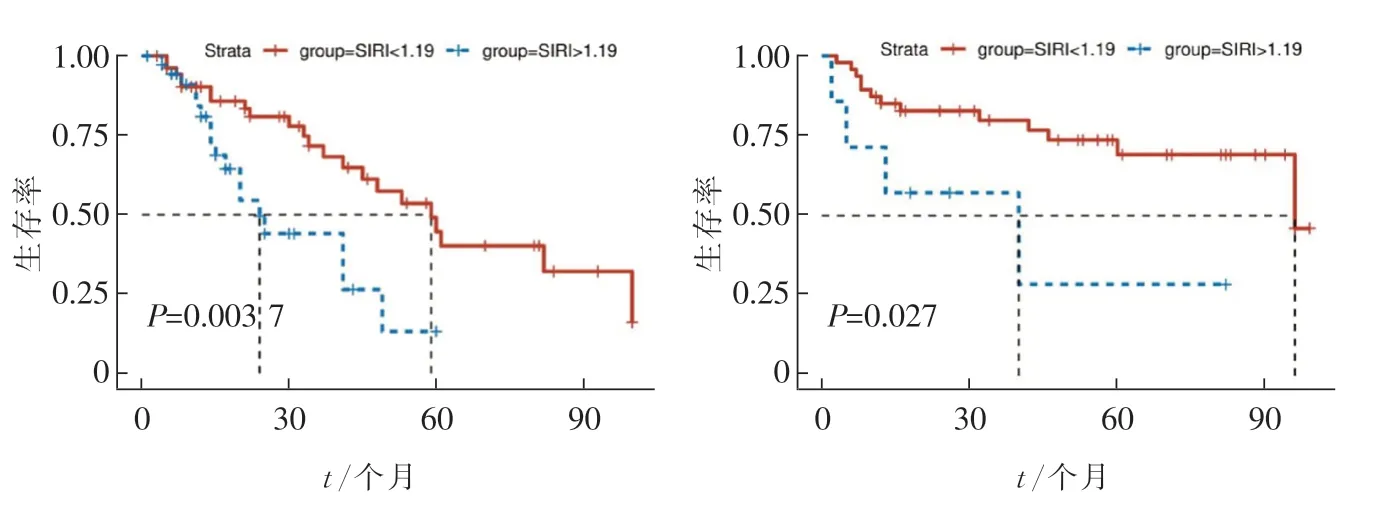
图7 SIRI对早期(TNMⅠ+Ⅱ期)(a)、中期(TNMⅢ期)(b)GBC患者生存的影响
3 讨论
在19世纪,BALKWILL等[17]首次发现了炎症与癌症之间的重要联系。如今,MLR、PLR、NLR等炎症指标广泛用于预测包括GBC在内的多种恶性肿瘤的临床转归[18-20]。SIRI作为一种新型、有效的系统性炎症指标被用于独立预测多种肿瘤患者的生存[15,21-22]。针对胰腺癌和肾透明细胞癌的研究表明,SIRI的预测准确性优于NLR和MLR[14,23]。有研究[13]报道,SIRI与血清炎性细胞因子/趋化因子水平的升高及OS的缩短有关。
本研究使用Cox比例风险模型证实了SIRI和NLR对接受根治性切除术的GBC患者OS具有的独立预测价值,这与此前的研究结果[15]相似。且在PSM分析后,SIRI和NLR仍是独立的预后因素。随访1、3和5年的ROC曲线证明SIRI的预后预测效果优于其他全身炎症指标。尽管AJCC TNM分期系统被认为是预后金标准,但同一TNM分期的患者在预后结果上也会有较大的差异。本研究数据表明MLR不是一个独立的预测因子,分界值也不同于以往的报道。此外,如使用SUN等[15]报道的SIRI分界值(SIRI分界值=0.89),后者不再是一个独立的预后因素(P=0.052)。产生这一结果的原因可能是样本量不足,不同的纳入排除标准和不同的样本人群分布,更准确的分界值还需大样本的多中心研究数据进行验证。
有研究[24]表明,由全身炎症指标组成的列线图比传统的分期系统具有更强的预后预测能力。DENG等[8]根据GBC患者的全身炎症指标(包括NLR、MLR)和临床病理参数绘制了列线图。本研究建立的模型将SIRI与其他重要的临床参数(包括NLR、CEA、CA19-9和TNM分期)相结合绘制线列图,在内部验证中,列线图的校准曲线表明其在对随访1、3和5年OS的预测中表现较好,列线图在OS预测方面有很好的准确性。TNM分期和列线图预测GBC患者OS的C-index分别为0.68及0.78。
尽管越来越多的研究表明全身炎性生物指标对癌症患者预后预测来说是有价值的参数,但其背后机制仍不明确,目前流行的理论主要有3种。第一,淋巴细胞可以通过分泌干扰素-γ和肿瘤坏死因子-α等细胞因子诱导凋亡和介导细胞毒作用,抑制肿瘤生长,淋巴细胞数量的减少会削弱机体对肿瘤的免疫监视和防御能力[22,25]。第二,中性粒细胞可通过释放血管生成因子促进肿瘤血管生成,并与T细胞相互作用,在各个阶段促进肿瘤进展[23,26]。第三,从单核细胞分化而来的肿瘤相关巨噬细胞可通过分泌生长因子和血管生成因子加速肿瘤进展和侵袭,并限制活化的CD8+T细胞浸润到肿瘤微环境中来促进癌细胞免疫逃逸[27-28]。
本研究数据表明SIRI是胆囊根治术后GBC患者OS的独立预测因子,其预测效果优于PLR、NLR和MLR,基于NLR、SIRI和常规临床病理指标的列线图在预测患者OS方面表现良好。本文存在的不足之处:1)本研究是基于单中心的回顾性研究,样本相对较少,在数据收集上可能存在选择偏倚;2)C反应蛋白因缺乏常规术前检测而未列为临床指标;3)缺乏可供进一步验证的外部数据。
