禽呼肠孤病毒检测方法研究进展
2022-11-08钱金涵朱亭帆金文杰
钱金涵,朱亭帆,金文杰,3*
(1.扬州大学教育部禽类预防医学重点实验室,江苏扬州 225009;2.扬州大学江苏省动物预防医学重点实验室,江苏扬州 225009;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
禽呼肠孤病毒(Avian reovirus,ARV)是一种分节段的双股RNA病毒,属于呼肠孤病毒科(Reoviridae)正呼肠孤病毒属(Orthoreovirus)[1]。它最初因为双链核酸结构被误认为痘病毒,后来通过电子显微镜鉴定该病毒为呼肠孤病毒。该病毒在1954年由Fahey和Crawley首次从患有慢性呼吸道疾病的鸡身上分离出来。随后,多个国家报告从患有关节炎或者腱鞘炎以及肠道病变的鸡中分离出呼肠孤病毒。经试验感染鸡后,该呼肠孤病毒可引起关节炎和腱鞘炎。除此之外,Olson还描述了另一种发生在关节的滑膜、导致形成血管翳的病变,非常类似于人类风湿性关节炎的病变。此后还有研究人员发现呼肠孤病毒在试验感染鸡时也会引起心肌炎和肝炎。1985年,王锡堃等发现了我国第1例鸡病毒性关节炎病例;2001年,吴宝成等从患病番鸭中分离出7个呼肠孤病毒株,是我国首次分离出的DRV毒株;2002年,王光锋等首次从表现为出血性坏死的病鹅肝脏中分离得到GRV毒株。由上述报道可见,该病毒引起的疾病发病率不断上升且出现了多样化的临床疾病形式,表明ARV的影响越来越大,给养禽业造成了严重的损失。因此,对ARV快速有效的检测就显得尤为重要,本文就目前国内外禽类呼肠孤病毒检测方法做一综述,为该病毒的进一步深入研究和疾病的有效防控提供参考。
1 ARV的分离与鉴定
从病料中进行病毒的分离培养和鉴定是诊断病毒感染的一般方法,该病毒分离的最好方法是将病料接种到可孵育的鸡胚或细胞培养物中。鸡胚孵化6 d后,通过卵黄囊接种鸡胚(最好来自SPF鸡群),呼肠孤病毒通常在接种后5 d或6 d内会使得胚胎致死,胚胎出现出血性肝脏坏死病变。随后用呼肠孤病毒接种鸡胚原代肝细胞可在细胞薄片上形成合胞体,感染细胞在几天后脱落到培养基中。如果细胞被苏木精和伊红染色,可见嗜酸性核内包涵体。若病毒在组织中滴度比较低,则可能需要传代2到3次才能看到效果。呼肠孤病毒经负染色或免疫荧光(IF)染色后电镜均可识别。
但是从组织中分离和鉴定呼肠孤病毒是耗时的,所以需要其他更快速的方法。例如,肌腱冷冻切片直接IF染色被用来检测感染后的病毒。Liu H J等[2]使用单克隆抗体免疫过氧化物酶染色法检测石蜡包埋组织中的呼肠孤病毒。然而,这些方法可能只在感染的早期阶段效果突出。
2 分子生物学检测方法
目前有很多文献报道了在感染组织中检测鉴定ARV的方法,这些方法相对快速和敏感,然后以此为基础再进行有针对性的病毒分离。
2.1 斑点杂交
斑点杂交(Dot-blot hybridisation)是指将待测的DNA变性后点加在硝酸纤维素膜(或尼龙膜、NC膜)上,用已标记的探针进行杂交,洗膜(除去未结合的探针),放射自显影判断是否有杂交及其杂交强度。Yin H S等[3]利用对应于ARV的S4基因组片段放射性探针斑点杂交检测ARV,对于经过纯化的病毒RNA最低检测量可达0.2 ng,可以作为检测ARV感染的有力诊断工具。但是,使用和检测放射性标记的探针对于大多数诊断试验室可能并不现实。Liu H J等[4]使用非放射性探针,用标有地高辛的探针进行检测的方法已经消除了这一缺陷,并且最低检测量可达0.78 ng。刘赫[5]建立的地高辛标记的ARV核酸探针检测方法只与ARV杂交结果为阳性,最低可检出50 pg/μL的核酸,并且将探针长期保存在-20℃的冰箱中仍能检测出阳性核酸样品,表明该方法具有较好的特异性、敏感性和稳定性,操作简便,可大批量检测病料样本,适合进行ARV的临床诊断和流行病学调查。因此,利用非放射性探针是一种可靠和快速的ARV感染诊断方法。
2.2 PCR
聚合酶链式反应(PCR)是一种用于放大扩增特定的DNA片段的分子生物学技术,因其特异性强、灵敏度高、简便快速、样本纯度要求低等特点,被广泛应用于ARV的检测。Xie Z等[6]根据ARV基因组S1基因序列,设计一对特异性引物可扩增出片段长度为532 bp的产物,最低检测浓度可达1 pg。廖敏等[7]根据已发表的ARV S1133株S1基因序列,设计合成了一对可将反转录和PCR反应在一个PCR反应管中一次性完成的引物,该方法最低可检测到0.16 ng的ARV RNA,此方法更加方便简洁,省去了繁琐的步骤。Lee L H等[8]将PCR与限制性片段长度多态性(RFLP)技术结合,为ARV分离株的鉴定提供一种简便、快速的方法。
2.3 实时荧光定量PCR
实时荧光定量PCR方法具有较高的敏感性和特异性,且操作相对快速和简单,因此成为了临床诊断ARV感染的一种常规方法。Ke G M等[9]根据ARV S1133株的σA基因序列设计了1对引物,可扩增长度为241 bp的片段,采用Ligut Cycler SYBR Green-based real-time reverse transcription-PCR(real-time LC RT-PCR)技术,建立了实时荧光定量PCR检测方法,该方法比常规RT-PCR灵敏度高1000倍。Mor S K等[10]建立了一种基于Taqman的实时荧光定量PCR (RT-qPCR)方法用于早期检测火鸡呼肠孤病毒。从火鸡呼肠孤病毒基因组S4段的保守区设计引物探针,该检测方法具有特异性。该方法的检测范围为108~101copies /reaction,灵敏度高。批内、批间变异系数最高分别为0.08和0.06,具有良好重复性。这种新方法对检测火鸡肠道和关节炎呼肠孤病毒有一定的应用价值。Zhang S等[11]建立了基于Taqman的实时荧光定量PCR检测NDRV感染的方法,利用NDRV基因组内的保守区域,设计了特异性引物和探针,该方法的检测下限为10 copies/μL。通过与其他鸭病毒性病原体的交叉检验,未观察到交叉反应,证实该检测方法对NDRV具有高度特异性。批内、批间变异系数均小于2.91%,具有良好重复性。RT-qPCR和常规PCR检测了120份来自不同地区的NDRV感染样本,结果显示阳性检出率分别为94.17%和84.17%,实时荧光定量PCR检测方法的检出率比常规PCR法高10%。云涛等[12]根据NDRV S3基因保守序列设计1对特异性引物和1条MGB荧光探针,建立了一种检测NDRV的一步法MGB荧光定量RT-PCR方法,最小检出量为10 copies/μL,组内和组间变异系数均小于2%。但是RT-qPCR需要特殊的设备、昂贵的用品和熟练的工作人员,因此这种技术目前还不能被广泛应用。
2.4 套式PCR
套式PCR(nested-PCR)使用2对PCR引物扩增完整的片段,第1对PCR引物扩增片段和普通PCR相似,第2对引物称为套式引物结合在第1次PCR产物内部,使得第2次PCR扩增片段短于第1次扩增。套式PCR检测ARV的应用在灵敏度和特异性方面都比现有的免疫学技术有很大的改进。此外,套式PCR减少或消除了不需要的产物,同时提高了敏感性。Liu H等[13]根据ARV S1133株S1基因序列,设计了2套引物分别扩增长度为738 bp和342 bp建立了一套nested-PCR方法,为ARV的检测提供了一种灵敏、准确的检测和鉴别方法。
2.5 纳米PCR
纳米PCR技术是一种新型的PCR技术,其原理是把固相纳米金属颗粒悬浮在液体中形成纳米流体。由于纳米流体相对于普通流体具有更强的热导性,所以会更快地到达目标温度,减少在非目标温度的停留时间,缩短整个体系达到温度平衡所用的时间,从而减少非特异性扩增、提高特异性扩增产量[14-15]。郑丽等[16]针对ARV S3基因的保守区域设计1对特异性引物,建立了ARV纳米PCR检测方法,从ARV核酸样品可检测到约332 bp的特异性目的条带。该纳米PCR方法能检测到的最低核酸质量浓度为56 pg/μL,其灵敏度是普通PCR的10倍。
2.6 重组酶聚合酶扩增技术
重组酶聚合酶扩增(RPA)技术是一种发展迅速的核酸扩增方法,被称为是可以替代PCR的核酸检测技术。常规PCR必须经过变性、退火、延伸三个步骤,而RPA反应的最适温度在37℃~42℃之间,无需变性,不需要温控设备,在常温下即可进行,可以真正实现便携式的快速核酸检测,一般可在10 min之内获得扩增产物。Ma L等[17]根据S1基因设计了一套特定引物来扩增S1基因的保守核苷酸序列,建立了RT-RPA检测ARV的方法。通过对86例临床样本的检测,验证了RT-RPA法的可行性。临床标本采用RT-qPCR检测进行比较,RT-RPA检测结果与RT-qPCR的符合率为96.5%。基于探针的RT-RPA检测方法简单、方便、灵敏度高、特异性好,在资源有限的情况下将成为检测ARV的另一种诊断方法。Wang W等[18]根据S3基因设计了特异性引物,建立了RT-PRA检测方法,该方法具有良好的重复性,最低能够检测出3.48×10-6ng/μL的标准质粒,该方法比常规RT-PCR方法检测灵敏度高10倍左右。此外,扩增产物无需凝胶电泳,通过添加SYBR GreenⅠ即可在紫外灯下观察,方便便捷。
2.7 环介导等温扩增技术
环介导等温扩增(LAMP)技术是一种新型的核酸扩增方法,它在等温条件下以高特异性、高效率和快速扩增DNA,其特点是针对靶基因的6个区域设计4种特异引物,在链置换DNA聚合酶(BstDNA polymerase)的作用下,60℃~65℃恒温扩增,15 min~60 min左右即可实现109倍~1010倍的核酸扩增,具有操作简单、灵敏度高、特异性强、反应时间短、不需要特殊的仪器、产物易检测等特点[19]。Li Z等[20]根据ARV主要外壳蛋白基因σB基因建立了一种RT-LAMP检测方法,检测灵敏度较高,最低检测限度可达200 fg,该方法对自然感染和试验感染的检测均比常规RT-PCR灵敏。于可响等[21]根据ARV S3基因的6个保守区域设计了4条LAMP引物,建立了RT-LAMP检测方法,该方法对病毒RNA的最低检出量为0.1 pg,是常规RT-PCR方法的100倍,且该方法具有良好的特异性。临床应用结果表明,该方法与病毒分离鉴定方法的符合率为98%,而且对仪器的要求低,适于基层实验室和现场检测。蔡跃佳等[22]将RT-LAMP技术与荧光染料钙黄绿素结合,建立钙黄绿素可视化RT-LAMP快速检测方法,能通过颜色变化观察反应结果。但是LAMP技术容易由于气溶胶而会出现假阳性问题,需要在操作时格外注意。为了解决污染问题,李璐瑶[23]根据ARV M1基因设计了一套特异性LAMP扩增引物,建立了ARV检测的UDG-LAMP体系。该方法特异性好,仅能对ARV进行扩增;灵敏度高,最低检测限为3×102copies/μL,是PCR方法的100倍;防携带污染作用明显。在临床样品检测中,该方法的阳性检出量比RT-PCR方法高16.7%。
2.8 交叉引物恒温扩增技术
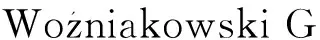
2.9 生物活性扩增探针法
生物活性扩增探针法(BAP)这项新技术结合了巢式PCR和磁珠为基础的DNA探针系统,大大提高了灵敏度和特异性。Li S K等[25]对不同ARV基因型和血清型的ARV S2基因进行对比,通过对2对RT-PCR引物、6对套式PCR引物和1对磁性探针进行检测,寻找最特异的引物用于ARV检测,建立了RT-PCR、套式PCR和磁探针杂交的最佳条件。建立的BAP检测法最低检测灵敏度为5 copies/μL,批内、批间变异系数分别为1.3%和1.7%,具有良好的稳定性。由于该方法劳动强度小、特异性高、灵敏度高,可能是ARV检测乃至大规模筛查的最佳选择。
3 免疫学检测方法
3.1 琼脂凝胶免疫扩散试验
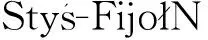
3.2 间接免疫荧光检测
间接免疫荧光试验(IFA)是用特异性抗体与标本中相应抗原反应后,再用荧光素标记的二抗与抗原-抗体复合物中第一抗体结合,洗涤后在荧光显微镜下观察特异性荧光,以检测未知抗原或抗体。Adair B等[26]在AGID试验与IFA试验对抗血清稀释度的比较中发现IFA试验具有更高的敏感性。虽然IFA检测可能比AGID更敏感,但易产生非特异性荧光,出现假阳性问题。
3.3 血清中和试验
血清中和(SN)试验是经典的血清学检测方法。Kawamura H等[29]通过SN试验将77个ARV分离株分为5个血清型。而Wood G等[27]认为ARV至少有11种血清型。SN试验比AGID和IFA试验更具有特异性和敏感性,但也有成本昂贵和速度缓慢的缺点[26]。
3.4 蛋白质印迹法
蛋白质印迹法(Western blot)是将电泳分离后的细胞或组织中蛋白质从凝胶转移到固相支持物NC膜或PVDF膜上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术,现已广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。Endo-Munoz L B[30]将含有2种ARV(RAM-1和74/2)混合物的抗原进行Western blot,其中16种不同的ARV的抗血清均有阳性反应。阳性反应表现为硝基纤维素膜上出现了以下一种或多种多肽的条带,145 ku和132 ku多肽,79 ku和73 ku多肽,42 ku多肽。同时145 ku和132 ku大小处的多肽在不同毒株检测过程中都能观察到。因此,在145 ku和132 ku处是否有条带被作为判断抗血清中是否含有ARV抗体的标准。此外,Western blot在7种接触性抗血清中检测到6种抗体,而免疫荧光只能检测到3种,结果证实了Western blot比免疫荧光更敏感。Western blot检测结果重复性好,是一种可靠、特异、灵敏的检测ARV抗体的方法。Western blot可作为验证试验,筛选出免疫荧光未明确阳性或阴性的SPF血清。而且接触性抗血清的检测结果表明,为保证自然感染ARV的鸡抗血清中低水平抗体的检测,应将Western blot作为常规检测手段。
3.5 酶联免疫吸附试验
酶联免疫吸附试验(ELISA)指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体特异性结合进行免疫反应的定性和定量检测方法。Liu H等[31]建立了一种以诱导中和抗体的σC、σB蛋白为包被抗原的ELISA检测方法,并与血清中和试验和常规ELISA试验进行了比较。结果表明,σC-σB-ELISA与血清中和试验结果的符合程度远高于常规ELISA。Yun T等[32]通过在大肠杆菌中克隆并表达了NDRV的外衣壳(σC),建立了检测方法。通过与其他鸭病毒病原体的交叉检验,证实了σC-ELISA方法的特异性。与Western blot做比较,σC-ELISA的敏感性和特异性分别为92.6%和88.9%,两种检测方法与Western blot的一致性较好。该方法是一种特异性强、灵敏度高的检测方法,可用于NDRV感染的血清学调查和NDRV抗体滴度监测。
疫苗免疫与病毒感染的区别也是重要的。Xie Z等[33]将ARV的σNS和P17两个非结构基因克隆到载体PGEX4T-1中表达蛋白质并进行纯化作为抗原。采用σNS-ELISA、P17-ELISA和σNS-P17-ELISA 3种ELISA方法和AGID方法对感染ARV的SPF雏鸡血清进行检测。感染ARV的阳性血清中σNS、P17和σNS-P17 3种检测方法阳性率分别为88.9%、61.1%和88.9%,而AGID检测阳性率为55.6%。免疫疫苗鸡血清中σNS、P17和σNS-P17的3种方法阳性检出率分别为6.7%、0%和6.7%,然而AGID方法检测出率为60.6%。结果表明,利用非结构蛋白特异性ELISA技术可以区分ARV疫苗免疫和ARV感染。
4 展望
近年来,ARV引起的疾病发病率不断上升且出现了不断多样化的临床疾病形式,表明ARV的影响越来越大,给养禽业造成了严重的损失。由于ARV的严重危害,众多研究人员已经开发出多种ARV实验室诊断方法,以便在现场条件下进行早期诊断。对于病原检测,ARV病原的分离与鉴定、分子生物学检测方法在诊断中发挥重要作用,尤其是PCR、qPCR、LAMP等分子生物学技术更在禽感染ARV的早期即可检测到病毒核酸,在ARV的早期检测中具有重要作用;免疫学方面,用免疫学方法检测抗体可以了解ARV感染、发生、发展的进程,即有AGID、IFA、SN、Western blot、ELISA的方法用于ARV检测,利用非结构蛋白特异性ELISA技术还可以区分ARV疫苗免疫和ARV感染。总之,ARV的实验室检测方法多种多样,各有优缺点。ARV在家禽中引起的相关疾病的判定仍然存在诸多问题。虽然呼肠孤病毒普遍存在,但疾病相对较少发生,因此在组织中简单检测到病毒或血清抗体,可能不能认定呼肠孤病毒是疾病的原因。因此,需要进行更多的研究来了解呼肠孤病毒不同毒株致病性的基础以及可能导致呼肠孤病毒致病的诱因。但是,随着免疫学与分子生物学技术的不断发展,更多简单快速的技术将被开发出并应用于ARV的防控。