ISRIB对高原低氧暴露下神经元树突棘形态的保护作用
2022-11-08孙亚菲翟茂登谭志策张昊炜张文斌张建彬邹远康
孙亚菲,翟茂登,谭志策,张昊炜,张文斌,张建彬,邹远康
(空军军医大学:1军事预防医学系军队劳动与环境卫生学教研室,特殊作业环境危害评估与防治教育部重点实验室, 2基础医学院学员队,陕西 西安 710032; 3中国医科大学公共卫生学院,辽宁 沈阳 110122)
随着西部大开发战略的深度实施,西藏移居人群逐步增加,高原低氧暴露人口越来越多。高原地区空气稀薄、氧分压较低。高原低氧暴露对呼吸[1]、循环[2]、中枢神经等多系统产生影响,其中中枢神经系统对氧分压变化尤其敏感[3]。研究表明,慢性低氧暴露可引起学习记忆能力减退,严重者可导致认知功能障碍。海马作为大脑最敏感、最具功能可塑性的学习记忆中枢,最易受到高原低氧暴露影响[4],其中CA1区作为学习记忆的核心中枢,其神经元突触可塑性的损伤是学习记忆能力降低的主要原因[5]。高原低氧暴露可使海马组织神经元兴奋性降低、神经元突触相关蛋白分子的表达下降。树突棘作为神经元树突上的突起结构,通过数目和形态可塑性参与调控学习记忆过程[6]。整合应激反应(integrated stress response,ISR)是真核细胞对各种应激刺激的反应[7]。研究表明整合应激反应抑制剂(integrated stress response inhibitor,ISRIB)通过抑制ISR调控下游多种分子[8]抑制阿尔兹海默病(Alzheimer’s disease,AD)[9]、MEHMO综合征[10]以及脑白质消融病(vanishing white matter disease,VWMD)[11]等疾病发生、进展过程,但具体的机制尚未完全阐明。本研究通过高原低氧暴露后应用ISRIB进行干预,为进一步深入了解ISRIB对高原低氧暴露下神经元树突棘形态的保护作用进行了探索。
1 材料与方法
1.1 材料
36只雄性C57BL/6小鼠购自空军军医大学实验动物中心,6~8周龄,体质量(20±2)g。小鼠在本实验室动物房适应性饲养7 d后随机分为常氧组、常氧DMSO组、常氧ISRIB组、高原低氧组、高原低氧DMSO组、高原低氧ISRIB组,每组6只。正常饲养,饲养温度(25±1.5)℃,湿度(50±10)%,昼夜节律12 h/12 h。实验通过空军军医大学实验动物中心伦理审查[许可证号:SCXK(陕)204-002]。
1.2 方法
1.2.1 高原低氧暴露模型的建立 本次实验利用低压低氧模拟实验舱对高原低氧组、高原低氧DMSO组和高原低氧ISRIB组小鼠施加低氧暴露。将3组小鼠置于舱内,设定高度为6 000 m[12],上升速度为5 m/s,总暴露时间为14 d。舱内环境条件与常氧组环境条件相同。
1.2.2 药物干预 高原低氧DMSO组及高原低氧ISRIB组在低氧暴露过程中,于每日16时下降舱压高度至300 m,下降速度为5 m/s,常氧ISRIB组及高原低氧ISRIB组每日腹腔注射ISRIB 0.25 mg/kg,常氧DMSO组及高原低氧DMSO组给予等体积DMSO腹腔注射。给药完成后,于17时升舱,设定高度为6 000 m,上升速度为5 m/s。
1.2.3 高尔基染色 高原低氧暴露结束后,从各组小鼠中各取3只,腹腔注射10 g/L戊巴比妥钠麻醉,从颅骨中取出完整大脑,将其浸泡在5 mL高尔基液(A∶B=1∶1)中,室温避光保存2周。保存结束后,将大脑小心取出,放在滤纸上吸走多余液体后黏附在槽内。利用振动切片机,调整振幅为5档,速度为5档,将大脑冠状切成100 μm切片,切下的脑片用毛笔刷小心放入盛有蒸馏水的玻璃染色缸内。双蒸水冲洗切片2次,每次4 min。清洗完毕后将脑片置于高尔基液(D∶E∶ddH2O=1∶1∶2)中,染色10 min。染色结束后用双蒸水冲洗切片2次,每次4 min。再依次用500、750、950 mL/L的乙醇对切片进行脱水。之后在无水乙醇中脱水4次,每次4 min。脱水完毕后在二甲苯中透化3次,每次4 min。将透化完毕的脑片置于干净的黏附载玻片上用树脂封片剂封片,避光晾干后显微镜下观察树突棘数量和形态。
1.2.4 水迷宫方法测定 高原低氧暴露结束后,正式实验前1 d,不放置平台,让小鼠分别游泳60 s,进行适应性训练。适应性训练结束后,随机设置可视化平台,在距离平台最远处放入小鼠,检验小鼠有无视力障碍并且是否具有游上平台的能力。之后取出小鼠擦干避免应激。定位航行实验历时5 d,每日重复1次。实验前将不同标记物贴在4个象限,隐藏平台在水下1 cm处,水温控制在25 ℃,用牛奶将水染成乳白色。实验时将小鼠从除目标象限(平台位置)外的3个象限放入水中,放入时小鼠面朝池壁。记录潜伏期,并在平台上停留20 s,如果小鼠在90 s内未找到平台,则引导其在平台上停留20 s并记录潜伏期为90 s。最后一次定位航行实验结束后的第2日进行空间探索实验。撤去平台,在第一象限同一入水点将小鼠面向池壁放入水中,小鼠在水池中游泳,记录90 s内小鼠在目标象限花费的时间和进入该象限的次数。
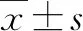
2 结果
2.1 高原低氧暴露损伤小鼠学习记忆能力
在6 000 m海拔高度低氧暴露14 d后,进行水迷宫实验检测小鼠的学习记忆能力变化。首先,称量各组小鼠体质量,结果发现与常氧组相比,高原低氧组小鼠体质量并无明显差异(P>0.05,图1A)。在进一步实验中,对小鼠进行可视平台实验与空间探索实验评估小鼠学习记忆功能改变,结果发现在可视平台实验中,与常氧组相比,高原低氧组小鼠游泳速度与逃避平台潜伏期并无明显差异(P>0.05,图1B~C),说明小鼠运动能力未受到低氧暴露影响。在空间探索实验中,与常氧组相比,高原低氧组小鼠穿越平台次数、目标象限停留路程百分比及目标象限停留时间百分比显著降低,差异具有统计学意义(P<0.05,图1D~F)。以上结果显示,高原低氧暴露可显著损伤小鼠学习记忆能力。
2.2 高原低氧暴露后小鼠海马CA1区神经元树突棘可塑性改变
为进一步评估高原低氧暴露对学习记忆的损伤作用,检测了各组小鼠海马CA1区神经元树突棘可塑性改变情况。结果发现,与常氧组相比,高原低氧组小鼠树突棘密度显著降低(P<0.05),树突棘长度显著缩短(P<0.05),蘑菇型和短状型树突棘密度显著降低(P<0.05,图2)。以上结果说明,高原低氧暴露后小鼠海马CA1区神经元树突棘可塑性发生明显改变。
2.3 ISRIB促进高原低氧暴露后小鼠学习记忆能力恢复
给予ISRIB治疗后,进行水迷宫实验检测小鼠的学习记忆能力变化。结果发现在可视平台实验中,与常氧DMSO组相比,高原低氧DMSO组小鼠游泳速度与逃避平台潜伏期并无明显差异(P>0.05);与高原低氧DMSO组相比,高原低氧ISRIB组小鼠游泳速度与逃避平台潜伏期无明显差异(P>0.05,图3A~B)。在空间探索实验中,与常氧DMSO组相比,高原低氧DMSO组小鼠穿越平台次数和目标象限停留时间百分比显著降低(P<0.05);与高原低氧DMSO组相比,高原低氧ISRIB组小鼠穿越平台次数和目标象限停留时间百分比显著升高(P<0.05,图3C~D)。以上结果说明,ISRIB促进高原低氧暴露后小鼠学习记忆能力恢复。
2.4 ISRIB保护高原低氧暴露后小鼠海马CA1区神经元树突棘可塑性改变
为进一步评估ISRIB对高原低氧暴露后小鼠海马CA1区神经元树突棘可塑性改变的保护作用,检测了各组小鼠海马CA1区神经元树突棘可塑性改变情况。结果发现,与常氧DMSO组相比,高原低氧DMSO组小鼠树突棘密度显著降低(P<0.05),树突棘长度显著缩短(P<0.05),蘑菇型和短状型树突棘密度显著降低(P<0.05);与高原低氧DMSO组相比,高原低氧ISRIB组小鼠树突棘密度显著升高(P<0.05),树突棘长度显著增加(P<0.05),蘑菇型和短状型树突棘密度显著升高(P<0.05,图4A~D)。以上结果说明,ISRIB对高原低氧暴露后小鼠海马CA1区神经元树突棘可塑性改变具有明显的保护作用。
3 讨论
高原低氧环境可对脑功能产生多方面损害,比如心理状况、反射活动、感知能力、注意力、记忆力、认知功能等[13]。研究表明,海马CA1区神经元、皮层神经元及脑干神经元等极易受到氧分压变化的影响。低氧暴露对学习记忆的慢性影响主要是由于低氧环境极易损伤海马CA1区椎体“缺氧易感”神经元[14]。近年来,有研究发现,慢性低氧暴露可通过影响海马CA1区椎体神经元突触可塑性进而损伤学习记忆过程[15]。树突棘可塑性作为神经元突触可塑性的重要内容受到研究人员的重点关注。树突棘形态和数目的改变对神经元信息传递和记忆形成具有重要意义。研究人员发现,低氧暴露可导致原代培养的神经元树突棘数目减少、未成熟无膨突伪足状树突棘数目增加[6]。以上结果提示,低氧暴露对神经元树突棘形态可塑性的影响可能是其导致学习记忆功能损伤的重要原因。虽然近年来对于高原低氧暴露导致学习记忆损伤的机制研究进步明显,但是临床上仍缺乏疗效较好的高原低氧暴露所致的高级脑功能损伤的防治药物。
ISRIB在AD、VWD、创伤性脑损伤、MEHMO综合征等神经系统疾病治疗中均有重要作用。ISRIB是新发现的一种特异性抑制ISR的小分子抑制剂。近期研究表明,ISRIB可以通过独特的药理特性,在不影响淀粉样蛋白β产生的情况下减轻淀粉样蛋白β诱导的神经元细胞死亡[9];ISRIB还可以在转录水平上调控VWMD小鼠mRNA标志物的表达,抑制脑白质病理变化,从而改善VWMD小鼠的运动能力[16];另外,ISRIB可显著减轻轻度创伤性脑损伤ISR的激活、改善小鼠神经元细胞的突触功能并且降低疾病风险[17]。ISRIB还可以抑制MEHMO综合征中eif2s3突变导致的细胞生长和神经元分化缺陷[10]。此外,ISRIB还可应用于肺纤维化[18]、胶质瘤[19]以及耳蜗突触病[20]等的治疗。但是,国内目前对于ISRIB及其在神经系统疾病治疗方面的研究有限。
本实验结果表明,高原低氧暴露后小鼠学习记忆能力显著降低,小鼠海马CA1区神经元树突棘数目显著减少,基树突棘与顶树突棘长度显著缩短,以上结果提示,高原低氧暴露可能通过影响海马CA1区神经元树突棘数目和形态变化参与学习记忆功能的损伤调控。而ISRIB给药治疗,可以显著改善高原低氧暴露后小鼠学习记忆能力降低、增加海马CA1区神经元树突棘数目并恢复基树突棘和顶树突棘的正常形态。以上结果提示高原低氧暴露诱导的ISR激活可能是导致小鼠海马CA1区神经元树突棘数目和形态改变的重要原因。但本实验仍具有不足之处:本实验结果显示,ISRIB能够增加低氧暴露下树突棘的数量,但神经元的功能变化并没有得到验证;同时,本实验单纯从形态与数量的角度评价树突棘的增减,缺乏分子表达方面的数据支撑。针对ISRIB对树突棘保护的分子机制本实验并未进行探究,这也将是本课题组下一阶段的研究方向。ISRIB已在抗炎[21]及肿瘤[19]治疗领域取得一定进展,其在中枢神经系统疾病治疗中的潜在作用正逐渐被探索。总之,该研究为高原低氧暴露诱导的高级脑功能损伤防护及药物治疗提供了新的思路,为降低高原低氧暴露对人类健康损害提供了新的研究方向。
