miR-21-5p改善阿霉素诱导的心脏毒性及其作用机制
2022-11-08安慧仙陈蕊蕊周海佳纪兆乐刘鹏云
赵 佩,安慧仙,陈蕊蕊,周海佳,纪兆乐,刘鹏云*
(1空军军医大学第二附属医院心血管内科,西安 710038;2西安国际医学中心医院心脏内科;*通讯作者,E-mail:pengyltdyy@126.com)
阿霉素(doxorubicin,DOX)是一种蒽环类高效化疗药物,广泛应用于癌症的临床治疗。但其长期使用所导致的急慢性心脏毒性反应也引起了越来越多的关注,包括心动过速、心律失常、低血压、左室功能低下,甚至难治性迟发性心肌病[1,2]。同样,在小鼠模型中累积剂量的DOX也可诱导出心脏毒性,心脏症状类似于扩张型心肌病,即心室扩张,心室射血分数和收缩功能明显降低。此外,DOX诱导的心脏毒性会随着DOX剂量的增加而加重[3]。近年来,大量研究表明DOX诱导的心肌损伤涉及氧化应激、脂质过氧化、DNA损伤、线粒体损伤、炎症、凋亡和自噬等多个生物学过程[4,5]。其中,氧化应激和炎症是DOX致心肌损伤的关键过程。因此,有必要找到有效的方法来预防DOX在癌症化疗中产生的心脏毒性。
微小RNAs(miRNAs)是一类长度约为20个核苷酸的非编码小RNA。它们通过靶向特定的mRNA序列,作为基因表达的负调控因子,导致mRNA降解和翻译抑制,并通过调节与细胞功能相关的各种蛋白质编码基因来调节复杂的病理生理过程[6,7]。近年来发现miR-21与心血管系统关系密切,参与了心脏发育和重构、心律失常、血管生成和血管病变等过程[8]。有研究证实,与表达miR-21-5p的BMSCs共培养可恢复缺血/再灌注损伤后H9C2细胞中miR-21-5p的表达,并进一步减少缺血/再灌注诱导的H9C2细胞凋亡[9]。此外史东东等[10]观察到miR-21-5p通过靶向下调TGF-β1的表达水平,促进大鼠H9C2心肌细胞增殖和抑制细胞凋亡。然而miR-21-5p对DOX引起的心脏毒性的影响及潜在的作用机制尚未见相关报道。为此,本研究采用小鼠阿霉素心肌损伤模型,从基因调控层面来探索miR-21-5p减轻DOX心脏毒性的作用机制。
1 材料和方法
1.1 实验动物和试剂
清洁级雄性C57BL/6小鼠,8周龄,购自空军军医大学实验动物中心。动物生产许可证号:SCXK(军)2007-007号。阿霉素(doxorubicin,DOX)购自美国Sigma-Aldrich公司。乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶同工酶(creatine kinase-MB,CK-MB),丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成生物工程研究所。超氧化物阴离子荧光探针(dihydroethidium, DHE)购自美国Invitrogen公司。TUNEL检测试剂盒购自瑞士Roche Biochemicals公司。miRNA agomir NC、miR-21-5p agomir、miRNA antagomir NC和miR-21-5p antagomir载体购自苏州Ribo-Bio公司。MicroRNAs定量PCR试剂盒购自上海生工生物科技有限公司。NF-κB p-p65、NF-κB p65抗体购自美国Abcam公司。miR-21-5p agomir序列为5′-UAGCUUAUCAGACUGAUGUUGA-3′;miRNA激动剂阴性对照(NC agomir)序列为:5′-UUCUCCGAACGUGUCACGUTT-3′。miR-21-5p antagomir序列为:5′-UCAACAUCAGUCUGAUAAGCUA-3′;miRNA拮抗剂阴性对照(NC antagomir)序列为:5′-CAGUACUUUUGUGUAGUACAA-3′。
1.2 动物模型的建立及分组
为探究心肌miR-21-5p改变对阿霉素诱导的心脏毒性的影响,腹腔注射DOX构建小鼠阿霉素心脏毒性模型[11]。将C57BL/6小鼠随机分为对照组(Con组)、阿霉素组(DOX组)、NC agomir处理组(DOX+ago NC组)、miR-21-5p agomir处理组(DOX+ago-miR-21-5p组)、NC antagomir处理组(DOX+anta NC组)和miR-21-5p antagomir处理组(DOX+anta-miR-21-5p组),每组8只。DOX组小鼠接受单剂量DOX(15 mg/kg,腹腔注射),对照组小鼠注射同等体积的生理盐水。DOX+ago NC组、DOX+ago-miR-21-5p组、DOX+anta NC组和DOX+anta-miR-21-5p组小鼠在注射DOX前3 d分别经尾静脉注射10 nmol/L的miRNA agomir NC、miR-21-5p agomir(一种特殊标记和化学修饰的双链miRs,可上调靶基因的生物学功能)、miRNA antagomir NC和miR-21-5p antagomir(一种特殊标记和化学修饰的双链miRs,可下调靶基因的生物学功能)载体。注射DOX后14 d,进行超声心动图测量,处死小鼠后取出心脏。分别检测各组小鼠心肌组织miR-21-5p的表达水平、心肌组织微观病理改变、心肌损伤标志物的表达及心脏功能。
为探究miR-21-5p改善阿霉素诱导的心脏毒性的作用机制,将C57BL/6小鼠随机分为Con组、DOX组、DOX+ago NC组和DOX+ago-miR-21-5p组,每组8只。各组小鼠处理同上。分别检测各组小鼠心肌细胞凋亡率和凋亡蛋白表达、心肌组织氧化应激及炎症反应水平。
1.2.1 超声心动图检测 经胸超声心动图采用M型标准二维超声心动图和15 MHz线性阵列换能器检查。用异氟醚轻度麻醉小鼠后,采用胸骨旁长轴位M型图像测量常规超声心动图参数,包括左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end systolic dimension,LVESD)。用左室线性测量值(LVEDD和LVESD)计算出左室射血分数(left ventricular ejection,LVEF)和左室短轴缩短率(left ventricular fractional shortening,LVFS),以评价左室心脏功能。
1.2.2 CK-MB、LDH、MDA、SOD、GSH和GSH-Px水平测定 注射DOX后14 d,处死小鼠,分离颈动脉并抽取约1 ml血液,静置后留取上层血清。按照说明书使用试剂盒检测血清中CK-MB和LDH水平。另外,将心脏组织置于冷盐水中(质量体积比为1 ∶10),然后用匀浆机匀浆。3 000 r/min离心取上清,检测心脏组织MDA、SOD、GSH和GSH-Px水平。
1.2.3 心肌组织HE染色 心脏组织在4%的多聚甲醛中固定、脱水、石蜡包埋后将石蜡块切片至5 μm。石蜡切片在100%二甲苯和二甲苯与酒精(1 ∶1)的混合溶液中浸泡15 min,脱蜡,分别在100%,95%和75%的酒精溶液中浸泡1 min,然后用生理盐水清洗。苏木素染色30 min,加入0.02%伊红,光镜下观察心肌组织病理变化。
1.2.4 心肌细胞凋亡检测 将1.2.3制备好的石蜡切片经脱蜡水合后,用蛋白酶K工作液打孔30 min。按照TUNEL试剂盒说明书配置TUNEL反应混合物。切片与提前预混的TUNEL反应混合物避光孵育1 h,PBS溶液洗涤后DAPI染液染色细胞核。切片在激光共聚焦显微镜下观察,凋亡细胞核显示绿色荧光。
1.2.5 心肌组织ROS生成检测 心肌组织经液氮速冻后迅速切成冰冻切片,按照DHE检测试剂盒说明书避光滴加DHE反应液,PBS溶液洗片后置于激光共聚焦显微镜下观察并采集图像,采用Image J软件对切片荧光强度进行分析。
1.2.6 心肌组织NF-κB免疫荧光染色 先用3% H2O2处理复水石蜡切片30 min,然后在室温下用Immuno-Block试剂孵育30 min。使用抗NF-κB抗体在4 ℃加水浴箱中过夜,然后与Alexa荧光素标记的二抗在37 ℃孵育1 h。最后切片用DAPI染色细胞核并在激光共聚焦显微镜下进行成像。
1.2.7 qRT-PCR测定miR-21-5p及相关分子mRNA表达水平 用RNA提取试剂盒提取总RNA,并使用高容量cDNA逆转录试剂盒对总RNA进行反转录。引物由上海生工生物科技有限公司合成(见表1)。qRT-PCR使用TaqMan miRNA检测试剂盒进行。反应条件为94 ℃、5 min后,94 ℃、10 s,60 ℃、20 s,72 ℃、30 s,40个循环。U6是miR-21-5p的内部参比,GAPDH作为其余分子的内部参照。数据采用2-ΔΔCt法计算。

表1 qRT-PCR分析引物序列
1.2.8 心肌组织蛋白表达测定 用含有蛋白酶和磷酸酶抑制剂的裂解缓冲液将心脏组织样品匀浆。使用BCA蛋白测定试剂盒测定样品的蛋白浓度。含量测定后,用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,然后转移到硝化纤维素膜(PVDF)上。在室温下用5%脱脂牛奶封闭1 h后,在4 ℃下用p-p65(1 ∶1 000)、p65(1 ∶1 000)一抗孵育过夜。在室温下加入二抗2 h后,分别使用增强化学发光系统和生物光谱凝胶成像系统检测膜上的蛋白条带。
1.3 统计学分析
2 结果
2.1 阿霉素诱导的心脏毒性小鼠心肌组织中miR-21-5p的表达变化
与Con组相比,DOX组小鼠心肌组织miR-21-5p的表达显著下降(P<0.05)。与DOX组相比,DOX+anta-miR-21-5p组小鼠心肌组织miR-21-5p的表达进一步减低(P<0.05);而与DOX组相比,DOX+ago-miR-21-5p组小鼠心肌组织miR-21-5p的表达显著提高(P<0.05)。与DOX组相比,DOX+ago NC和DOX+anta NC组小鼠心肌组织miR-21-5p的表达差异无统计学意义(P>0.05,见图1)。
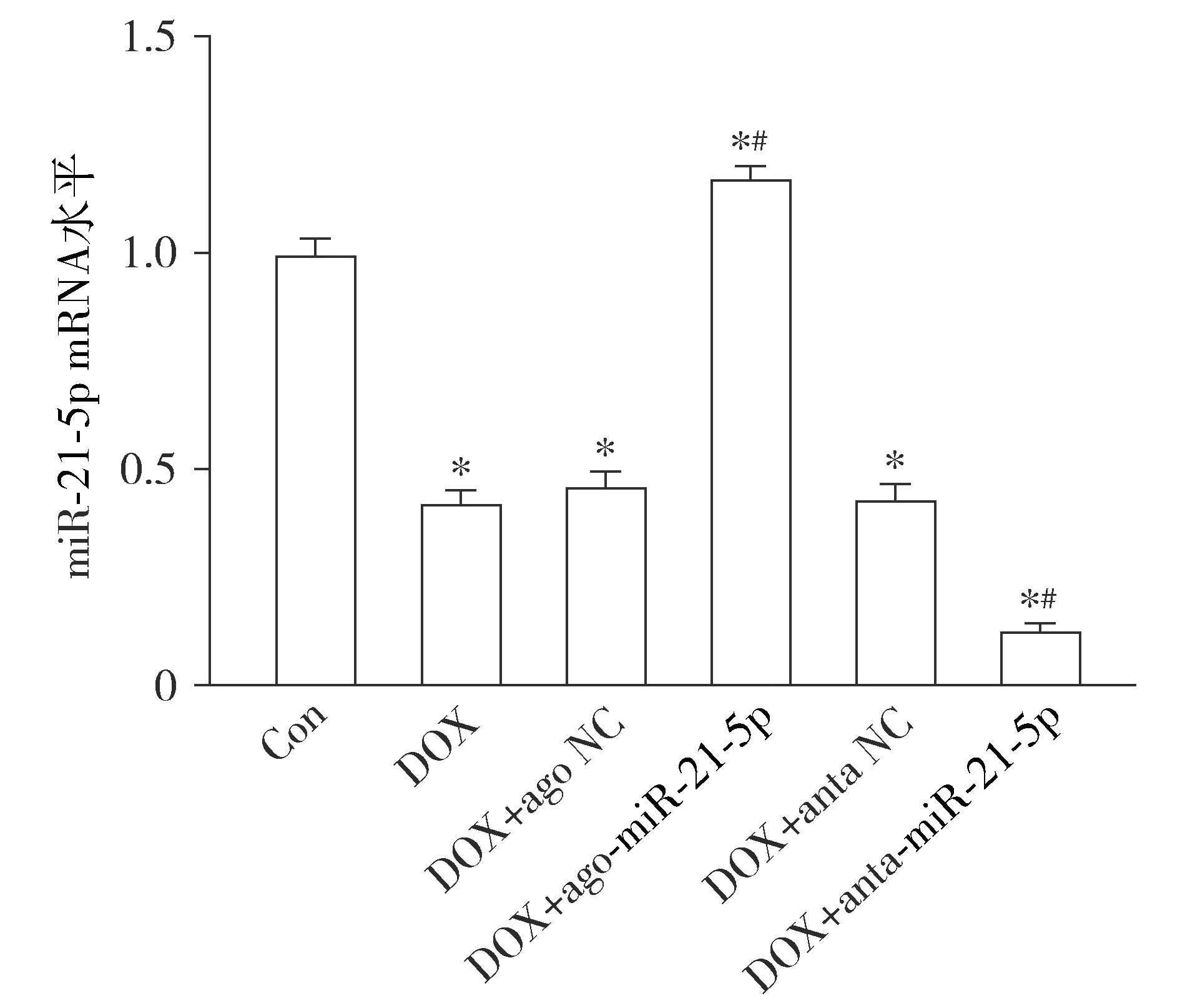
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图1 阿霉素诱导的心脏毒性小鼠心肌组织miR-21-5p的表达变化Figure 1 Expression of miR-21-5p in the myocardium of doxorubicin-induced cardiotoxicity mice
2.2 提高心肌miR-21-5p表达可显著改善阿霉素诱导的心肌损伤
心肌组织HE染色结果发现,与Con组相比,DOX组小鼠心肌组织发生显著的空泡化变性,且心肌纤维排列紊乱、断裂明显,表明心肌组织损伤显著。与DOX组相比,DOX+anta-miR-21-5p组小鼠心肌组织空泡化变性进一步加重,心肌损伤进一步加剧;而与DOX组相比,DOX+ago-miR-21-5p组小鼠心肌组织空泡化变性显著改善,心肌损伤明显减轻(见图2A)。
通过检测心肌损伤血清标志物LDH及CK-MB结果发现,与Con组相比,DOX组小鼠血清内LDH及CK-MB水平显著上升(P<0.05,见图2B)。与DOX组相比,DOX+anta-miR-21-5p组小鼠血清内LDH及CK-MB的水平进一步增加(P<0.05);而与DOX组相比,DOX+ago-miR-21-5p组小鼠血清内LDH及CK-MB的水平显著降低(P<0.05,见图2B)。与DOX组相比,DOX+ago NC和DOX+anta NC组小鼠上述心肌损伤指标的差异无统计学意义(P>0.05,见图2B)。
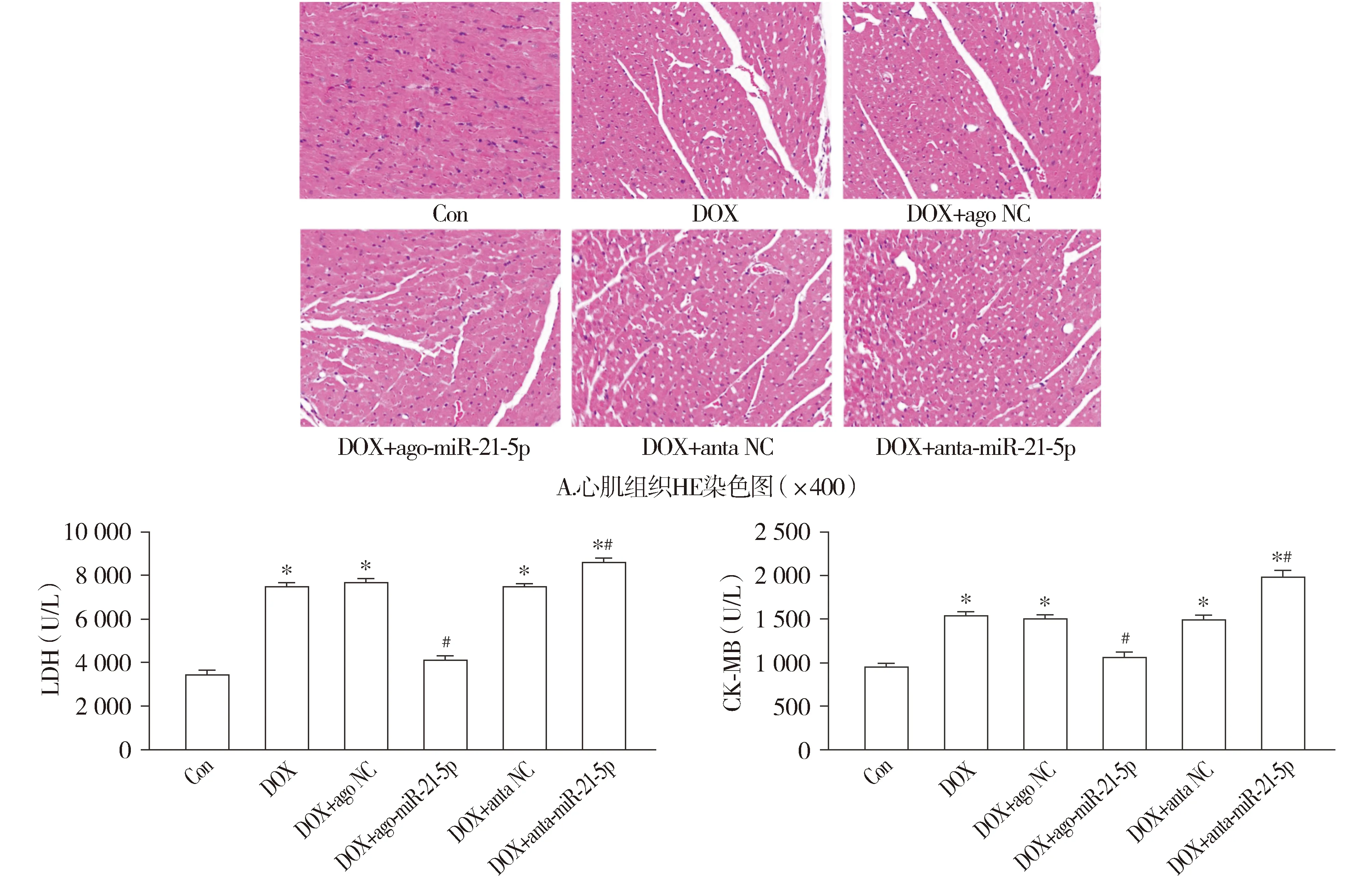
B.血清内LDH及CK-MB检测结果与Con组相比,*P<0.05;与DOX组相比,#P<0.05图2 miR-21-5p对阿霉素诱导的心肌损伤的影响Figure 2 Effect of miR-21-5p on doxorubicin-induced myocardial injury
2.3 提高心肌miR-21-5p表达可显著改善阿霉素诱导的心功能障碍
阿霉素诱导的心肌损伤最终会导致心脏功能的改变,心脏超声检测结果显示,与Con组相比,DOX组小鼠LVEDD和LVESD值明显增加(P<0.05);与DOX组相比,DOX+anta-miR-21-5p组小鼠LVEDD和LVESD值进一步增加(P<0.05);而与DOX组相比,DOX+ago-miR-21-5p组小鼠LVEDD和LVESD值显著降低(P<0.05);与DOX组相比,DOX+ago NC和DOX+anta NC组小鼠上述心肌超声检测指标的差异无统计学意义(P>0.05,见图3)。
计算得出的反映心脏收缩功能指标LVEF和LVFS结果显示,与Con组相比,DOX组小鼠LVEF和LVFS值显著下降(P<0.05);与DOX组相比,DOX+anta-miR-21-5p组小鼠LVEF和LVFS值进一步减低(P<0.05);而与DOX组相比,DOX+ago-miR-21-5p组小鼠LVEF和LVFS值明显提高(P<0.05);与DOX组相比,DOX+ago NC和DOX+anta NC组小鼠上述心肌收缩功能指标的差异无统计学意义(P>0.05,见图3)。
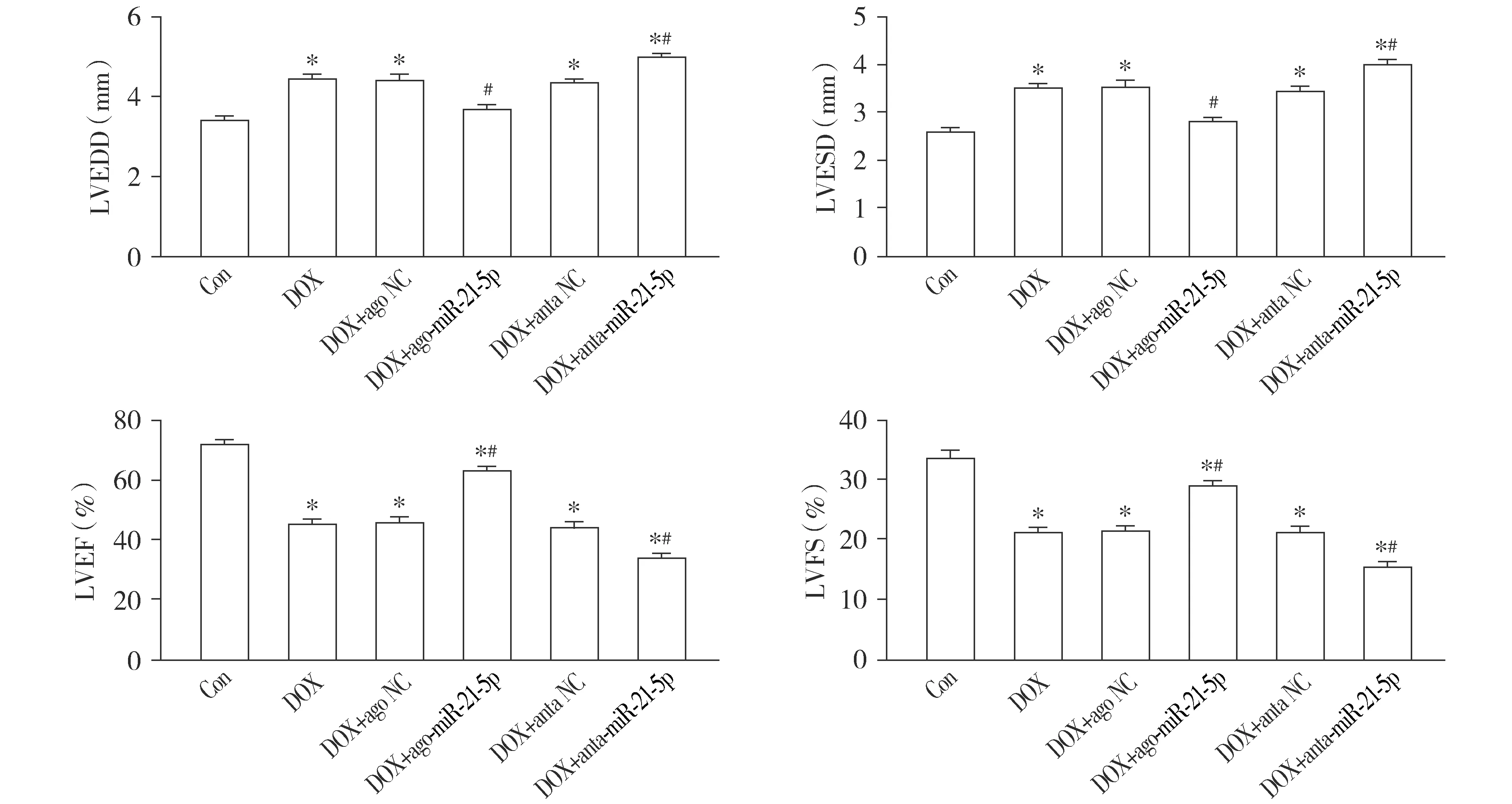
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图3 miR-21-5p对阿霉素诱导的心功能障碍的影响Figure 3 Effect of miR-21-5p on doxorubicin-induced cardiac dysfunction
2.4 提高心肌miR-21-5p表达可显著抑制阿霉素诱导的心肌细胞凋亡
通过TUNEL染色结果显示,与Con组相比,DOX组小鼠心肌细胞凋亡率明显增加,且促凋亡Bax mRNA和蛋白表达均显著上升,抗凋亡Bcl-2 mRNA和蛋白表达均显著下降(均P<0.05)。与DOX组相比,DOX+ago-miR-21-5p组小鼠心肌细胞凋亡明显减少,同时Bax mRNA和蛋白的表达显著下调,Bcl-2 mRNA和蛋白的表达显著上调(均P<0.05);与DOX组相比,DOX+ago NC组小鼠上述心肌细胞凋亡的差异无统计学意义(P>0.05,见图4,5)。
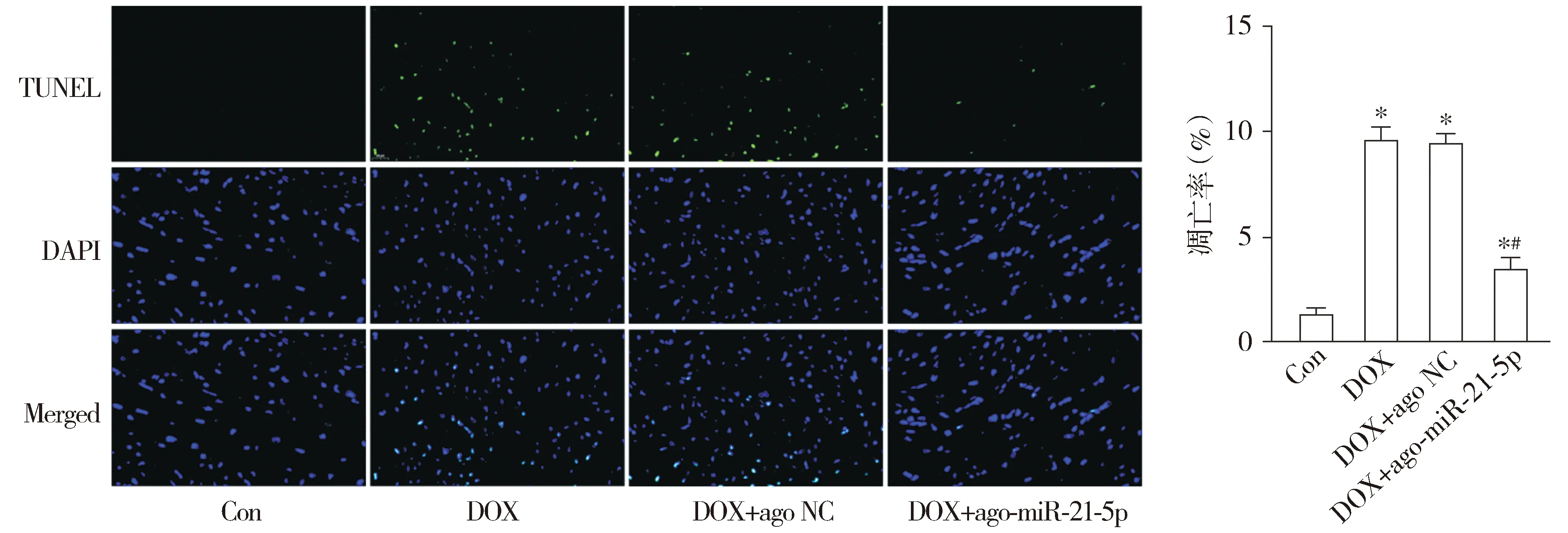
绿色荧光代表凋亡细胞核染色,蓝色荧光代表所有细胞核染色与Con组相比,*P<0.05;与DOX组相比,#P<0.05图4 miR-21-5p对阿霉素诱导的心肌细胞凋亡率的影响 (TUNEL,×400)Figure 4 Effect of miR-21-5p on apoptosis rate of cardiomyocytes induced by doxorubicin (TUNEL,×400)
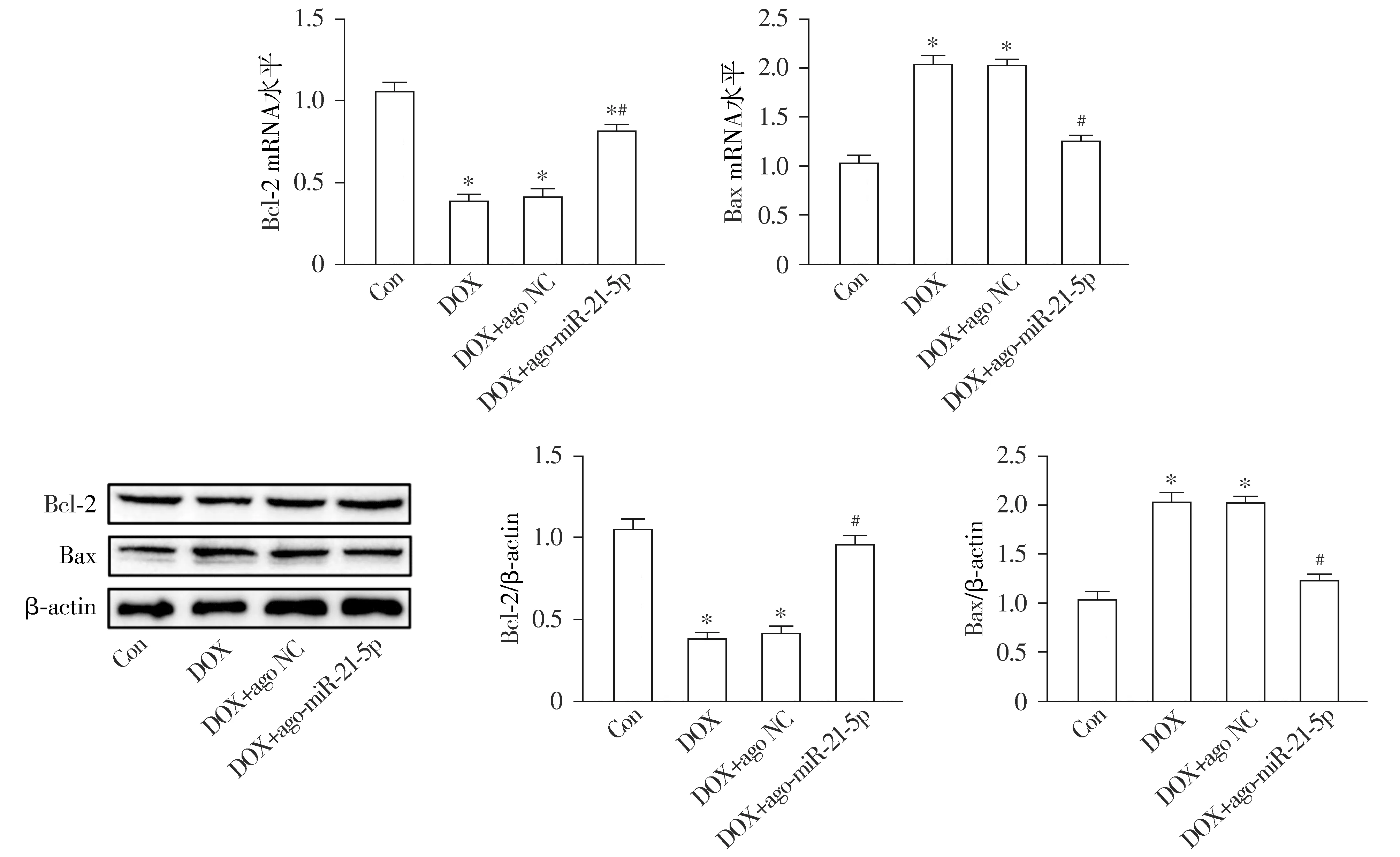
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图5 miR-21-5p对阿霉素诱导的心肌细胞凋亡相关蛋白表达的影响Figure 5 Effect of miR-21-5p on expression of apoptosis-related proteins induced by doxorubicin
2.5 提高心肌miR-21-5p表达可显著减轻阿霉素诱导的心肌组织氧化应激损伤
通过分析心肌组织切片二氢乙锭(DHE)红色荧光强度以表示ROS生成量,并通过检测试剂盒结果显示,与Con组相比,DOX组小鼠心肌组织MDA含量及ROS生成量显著增加,NOX2和NOX4 mRNA表达显著上升,而SOD、GSH和GSH-Px的含量则明显下降(均P<0.05,见图6,7)。与DOX组相比,DOX+ago-miR-21-5p组小鼠心肌组织MDA及ROS的生成显著降低,NOX2和NOX4 mRNA表达显著下调,同时SOD、GSH和GSH-Px的合成明显增加(均P<0.05)。与DOX组相比,DOX+ago NC组小鼠上述心肌组织氧化应激的差异无统计学意义(P>0.05,见图6,7)。
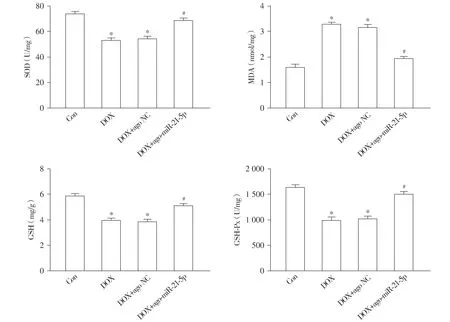
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图6 miR-21-5p对阿霉素诱导的心肌氧化应激血清学指标的影响Figure 6 Effect of miR-21-5p on serum indexes of myocardial oxidative stress induced by doxorubicin
2.6 提高心肌miR-21-5p表达可显著抑制阿霉素诱导的心肌组织炎症反应
通过检测心肌组织炎症反应结果显示,与Con相比,DOX组小鼠心肌组织IL-1β、IL-6、MCP-1及TNF-α mRNA表达显著上升,且心肌组织中NF-κB蛋白的荧光表达及其磷酸化程度明显增强(均P<0.05,见图8,9)。与DOX组相比,DOX+ago-miR-21-5p组小鼠心肌组织IL-1β、IL-6、MCP-1及TNF-α的mRNA的表达显著下调,同时心肌组织中NF-κB蛋白的荧光表达及其磷酸化程度明显被抑制(均P<0.05,见图8,9)。与DOX组相比,DOX+ago NC组小鼠上述心肌组织炎症的差异无统计学意义(P>0.05,见图8,9)。
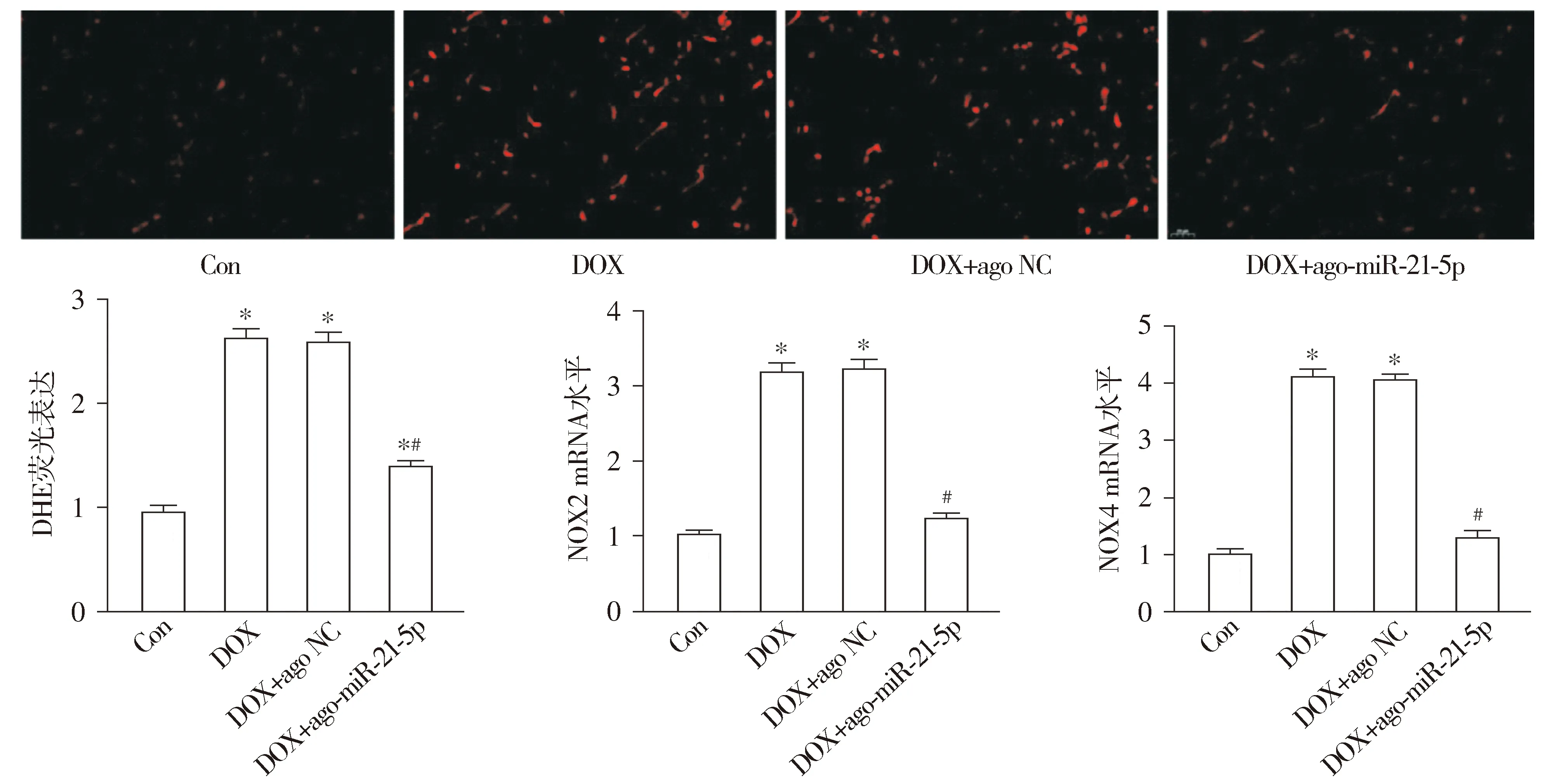
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图7 miR-21-5p对阿霉素诱导的心肌ROS及氧化应激相关分子表达的影响 (DHE染色,×400)Figure 7 Effect of miR-21-5p on the expression of ROS and oxidative stress-related molecules in myocardium of mice induced by doxorubicin (DHE,×400)
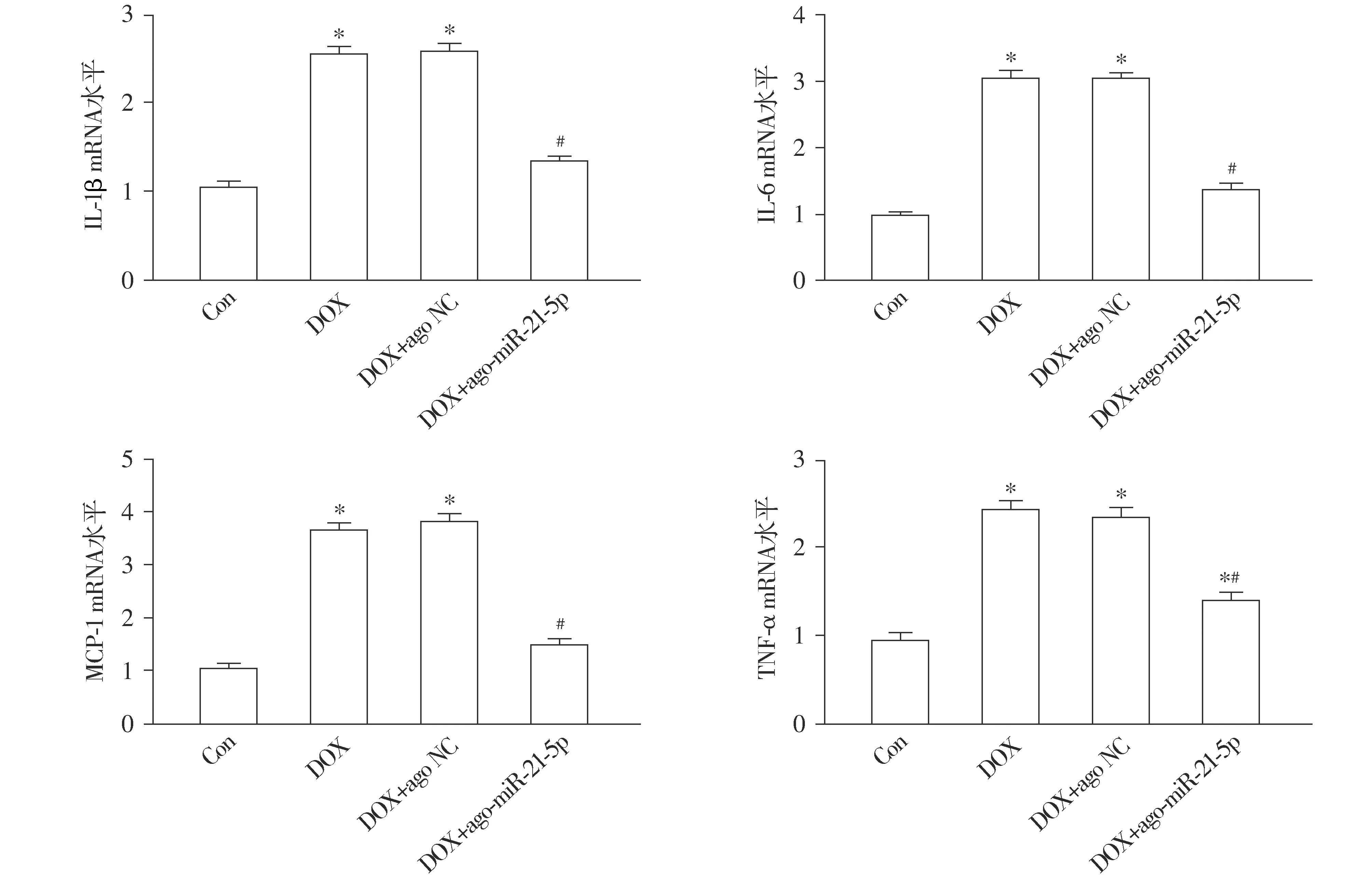
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图8 miR-21-5p对阿霉素诱导的心肌炎症相关分子表达的影响Figure 8 Effect of miR-21-5p on the expression of molecules related to myocardial inflammation in myocardium of mice induced by doxorubicin
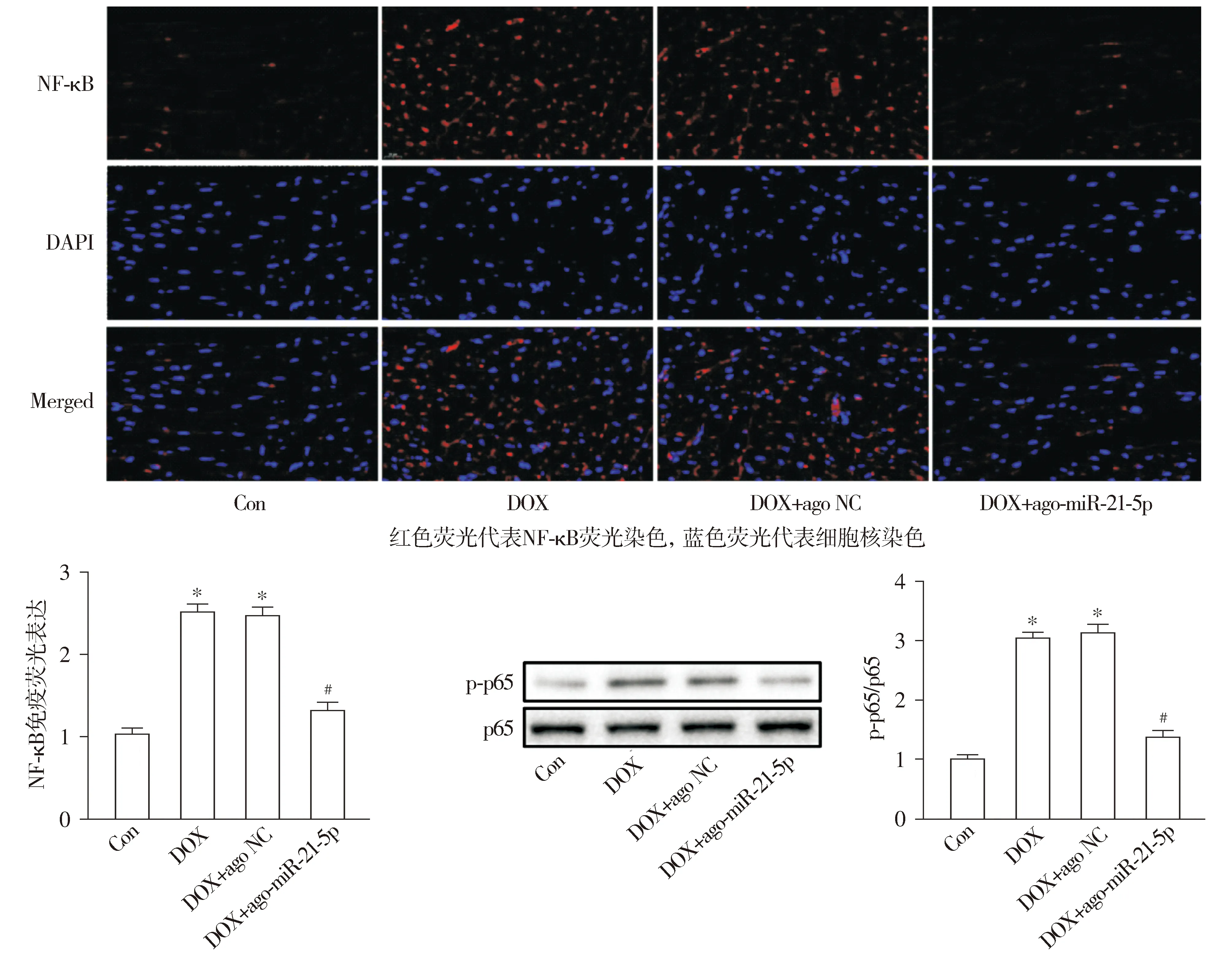
与Con组相比,*P<0.05;与DOX组相比,#P<0.05图9 miR-21-5p对阿霉素诱导的心肌组织NF-κB分子表达的影响 (×400)Figure 9 Effect of miR-21-5p on NF-κB expression in myocardial tissue induced by doxorubicin (×400)
3 讨论
DOX自20世纪60年代末以来在抗癌治疗方面取得了实质性的进展。然而,在临床情况下,DOX诱导的心脏毒性在接受化学疗法的肿瘤患者中却是非常令人关注的副作用之一,主要表现为心肌细胞死亡,进行性心肌病,甚至进展成充血性心力衰竭[12,13]。有研究表明,当DOX累积剂量达到700 mg/m2时,心力衰竭的发生率将增加到48%[14]。尽管DOX具有强大的抗肿瘤功能,但其应用往往受到其心脏毒副作用的限制。因此,有必要寻找有效的治疗措施,以对抗DOX诱导的心脏毒性。
微小RNAs(miRNAs)是一种小的非编码RNA,通过与靶mRNA结合调节基因表达。越来越多的证据显示,miRNAs参与心脏功能的调节,包括凋亡、电信号和心脏发育,可以被认为是治疗心肌损伤的潜在药物靶点[15,16]。其中微小RNA-21(miR-21)可通过多个作用靶点调节心肌细胞、内皮细胞、成纤维细胞、巨噬细胞等参与心血管疾病的进程[8]。Zhang等[9]发现,与表达miR-21-5p的BMSCs共培养可恢复缺血/再灌注损伤后H9C2细胞中miR-21-5p的表达,并进一步减少缺血/再灌注诱导的H9C2细胞凋亡。史东东等[10]观察到,miR-21-5p通过靶向下调TGF-β1的表达水平,促进大鼠H9C2心肌细胞增殖和抑制细胞凋亡。Li等[17]报道,miR-21-5p通过PTEN/Akt通路促进血管生成和心肌细胞存活,从而促进外泌体介导的心脏修复。然而miR-21-5p对DOX引起的心脏毒性的影响尚未见相关报道。我们的研究首次发现,与Con组相比,DOX组小鼠心肌组织miR-21-5p的表达显著下降,心肌组织发生显著的空泡化变性,心肌纤维排列紊乱、断裂明显,且心脏收缩功能明显下降,表明心肌组织损伤显著。提高心肌组织miR-21-5p的表达后,可显著改善小鼠心肌组织空泡化变性,降低血清中LDH及CK-MB的水平,改善心脏收缩功能,减轻了心肌损伤。然而进一步抑制心肌组织miR-21-5p的表达后,则进一步加重小鼠心肌组织空泡化变性,进一步增加小鼠血清内LDH及CK-MB的水平,进一步加重心脏收缩功能障碍,加剧了心肌损伤。因此,以上结果表明miR-21-5p治疗对DOX诱导的心脏毒性的保护作用有望获得较大的临床价值,并可能成为防治肿瘤患者化疗期间心脏毒性的重要策略。
大量研究证明DOX诱导的心脏毒性机制与心肌细胞的氧化应激密切相关[18]。DOX产生大量超氧阴离子自由基(·O2)和活性氧(ROS),进而诱导线粒体功能障碍和细胞损伤。此外一些重要的抗氧化酶(GSH、GSH-Px和SOD)消耗的增加也降低了细胞处理过氧化物的水平,导致细胞生存能力下降[19,20]。炎症反应在DOX诱导心脏毒性的发生发展中也起到了关键的作用[21]。促炎细胞因子如IL-1β、IL-6、MCP-1及TNF-α的表达增加介导的炎症反应增强是DOX诱导心脏毒性的另一个主要因素[22]。同时DOX刺激NF-κB的活化和磷酸化,已被证实可调节炎症因子的表达,导致不可逆的炎症损伤[23]。最近的研究也揭示了凋亡增加在DOX诱导的心脏毒性中的重要性,且DOX诱导的细胞凋亡加速与氧化应激和炎症反应增强关系密切[24,25]。本研究同样发现,与Con组相比,DOX组小鼠心肌细胞凋亡明显增加,Bax表达显著上升,Bcl-2表达显著下降。心肌组织MDA含量及ROS生成量显著增加,NOX2和NOX4表达显著上升,而SOD、GSH和GSH-Px的含量则明显减少。且心肌组织IL-1β、IL-6、MCP-1及TNF-α表达显著上调,NF-κB蛋白的荧光表达及磷酸化程度明显增强。以上结果表明抑制炎症和氧化应激被认为是减轻阿霉素诱导的心脏毒性的一种有前途的方法。
miR-21-5p可通过多种途径参与氧化应激和炎症的病理生理过程,发挥保护作用。Lv等[26]报道miR-21-5p可能通过PI3K/AKT通路减少大鼠脊髓组织的凋亡和炎症反应。Xue等[27]发现miR-21-5p通过调节PDCD4抑制脂多糖处理的H9C2细胞的炎症损伤。Nasci等[28]的结果表明,过表达miR-21-5p可以降低H9C2细胞的脂质含量和脂质过氧化,调节细胞对糖酵解和脂肪酸氧化途径的依赖发挥减轻氧化应激的作用。Yuan等[29]发现过表达miR-21-5p通过抑制自噬进而抑制氧化应激诱导的RSC96细胞凋亡。然而,miR-21-5p在DOX诱导的心脏毒性中是否同样发挥了抗氧化及抗炎作用有待进一步探究。我们的结果证实,与DOX组相比,高表达miR-21-5p处理可显著抑制心肌组织MDA及ROS的生成,显著下调NOX2和NOX4的表达,同时明显促进SOD、GSH和GSH-Px的合成。此外,心肌组织IL-1β、IL-6、MCP-1及TNF-α的表达也显著下降,NF-κB蛋白的荧光表达及磷酸化程度也明显被抑制,进而显著降低了心肌细胞凋亡。
综上所述,本研究首次证实,miR-21-5p可通过抑制心肌氧化应激和炎症发挥抗心肌细胞凋亡的作用,进而改善心脏功能,从而减轻了阿霉素诱导的心脏毒性。基于本研究结果,或可通过药物或miR-21-5p类似物调控靶基因的表达,作为潜在的临床治疗候选药物加以开发,以期为防治DOX治疗的患者发生心脏毒性提供新的可能。
