甲状腺乳头状癌分子标志物与超声特征相关性研究进展
2022-11-07夏蜀珺詹维伟
胡 艳,夏蜀珺,詹维伟
上海交通大学医学院附属瑞金医院超声科,上海 200025
甲状腺癌是全球第8大常见的癌症,在过去20年里发病率呈上升趋势,中国甲状腺癌总发病率(6.25/100 000)高于世界发病率(5.52/100 000)[1]。甲状腺乳头状癌(papillary carcinoma of the thyroid,PTC)是甲状腺癌最常见的类型,约占全部新发患者的92%[2]。PTC的发生、发展通常与各种遗传改变的逐渐累积有关,包括基因突变、基因表达调控因子的改变等[3]。对关键位点的分子检测有助于预测PTC进展、转移和复发的风险,对制订合理的临床治疗方案至关重要。国内外指南[4-5]对于分子标志物作为PTC诊断和预后评估的重要手段已达成共识。目前,临床使用的PTC分子标志物主要包括BRAFV600E基因突变和RAS基因点突变、RET/PTC重排以及TERT启动子突变等[6],主要利用有创性操作获得标本如细针穿刺活检(fineneedle aspiration biopsy,FNAB)或手术切除组织进行检测。由于分子突变对甲状腺组织学特征的影响,不同分子突变的PTC可能表现出不同的超声特征,许多研究对PTC分子突变与超声特征之间的关系进行了探索,有助于从影像学的角度更早地预测PTC的侵袭性与患者预后。
本文旨在对PTC不同分子标志物与超声特征的相关性进行综述,探讨特定超声特征指导不同分子标志物改变的PTC临床诊断的可行性。
1 分子标志物与超声特征的相关性分析
PTC被认为是一种丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)驱动的癌症,超过80%的PTC中存在MAPK信号转导通路中相关效应基因的改变,包括BRAF和RAS基因的点突变、RET重排等(图1)[6]。其中,BRAFV600E和RAS点突变被认为是两个相互排斥的驱动因素。BRAF编码的蛋白位于细胞质中,BRAFV600E突变会导致其对细胞外调节蛋白激酶(extracellular-regulated protein kinases,ERK)的持续活化所产生的负反馈信号不敏感,使得负反馈效应受损,从而导致MAPK信号持续高度激活。RAS编码相关蛋白定位于细胞膜内表面的G蛋白,位于BRAF的上游,发生突变时阻碍了MAPK信号转导通路的激活。RET基因是一种原癌基因,编码位于细胞膜的酪氨酸激酶受体。RET重排的改变类似于BRAF突变,会导致MAPK信号转导通路持续激活,因此也被称为BRAF样改变。

图1 甲状腺乳头状癌涉及的信号转导通路
TERT基因能够编码端粒酶的催化蛋白亚基,定位于细胞核中,通过在染色体末端添加端粒,维持染色体的完整性和基因组的稳定性[7]。TERT启动子突变是一种独立于MAPK信号转导通路的基因改变,会赋予细胞无限增殖的能力,促进正常组织恶性转化,从而促进PTC的发生[8]。期望通过对这些关键分子的检测以帮助预测PTC的生物学行为及临床预后。
2 BRAF突变
BRAF在PTC中的突变率为45%~60%,其中超过80%为BRAFT1799A的点突变,这会导致BRAF蛋白的600位残基处的缬氨酸取代为谷氨酸,即BRAFV600E突变[9]。
垂直位、边缘不规则、极低回声、微钙化和无声晕被认为是BRAFV600E突变最具预测性的超声特征[10-11](图2A)。垂直位可能与BRAFV600E突变的PTC增殖活跃、跨越正常组织平面生长有关[12]。微钙化被认为是PTC的特征性标志,可能是由病灶局部乳头状癌细胞坏死、钙化形成的层状钙盐沉积层不断发展而来,被认为是“坏死乳头状癌细胞的鬼影”[13]。此外,BRAFV600E突变与更强的侵袭性相关。相比于RAS突变的PTC,BRAFV600E突变的肿瘤更小、侵袭性更强,主要表现为甲状腺外组织侵犯、淋巴结转移、柱状细胞、高细胞等病理学特征[14]。
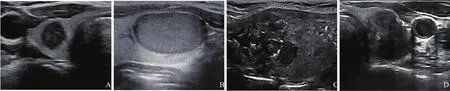
图2 PTC不同分子突变的超声图像
由于肿瘤组织和正常甲状腺组织中细胞的排列和组成不同,组织的弹性指数也不相同。Wang等[15]的研究证实,相较于BRAFV600E野生型,BRAFV600E突变型PTC的组织硬度更高。罗志艳等[16]的研究证实,超声弹性评分与BRAFV600E突变有相关性,超过70%的弹性评分≥4分的结节存在BRAFV600E突变。
不均匀增强是BRAFV600E突变的PTC超声造影的典型特点。Lin等[17]对1 315例PTC患者的超声造影结果分析表明,BRAFV600E突变会影响肿瘤血管床的数量,表现为向心性增强。具有BRAFV600E突变的肿瘤容易向外入侵,这可能会导致病灶形状不规则。当肿瘤较小时,PTC的血管床还不成熟,随着肿瘤体积的增加,不断增殖的肿瘤细胞压迫血管,会阻碍肿瘤的血液供应。
3 RAS突变
RAS突变存在于多种甲状腺肿瘤中,包括滤泡性腺瘤、滤泡性癌、低分化癌、未分化癌及乳头状癌。RAS突变主要与低分化甲状腺癌和间变性甲状腺癌有关,仅6%~10%的PTC中存在RAS突变[18]。
RAS突变的PTC通常表现出低回声或等回声、椭圆形、边界清晰、无钙化的超声特征[19](图2B)。Park等[20]对PTC的公共微阵列数据分析结果表明,RAS突变通过调控下游Wnt4信号转导,赋予RAS突变的PTC更惰性的生物学行为。只有20%的RAS突变PTC有实质低回声,约16%表现为边缘不规则,这表明超声在检测所有RAS突变PTC的灵敏度可能较低[19]。相比于经典PTC,RAS突变更常发生于滤泡型PTC(follicular variant PTC,FVPTC)中。FVPTC又分浸润性和包裹性,浸润性FVPTC的生物学行为与经典PTC相似,超声表现为低回声,边缘呈毛刺状/微分叶状,结节通常呈椭圆形或圆形,具有混合血管分布的特征[21]。
由于存在RAS突变的FVPTC往往表现出极惰性的生物学行为,因此是否足以被称作“恶性肿瘤”引发了广泛讨论。在2016年,由Nikiforov教授领导的包括病理学家、临床医师在内的专家小组[22]在对268例患者进行分析的基础上,将这种由高分化滤泡细胞组成、具有可疑的乳头状癌特征且非浸润的包裹性FVPTC重新命名为具有乳头样核特征的非浸润性甲状腺滤泡性肿瘤(noninvasive follicular thyroid neoplasm with papillary-like nuclear features,NIFTP)。尽管具有RAS突变的NIFTP具有等回声或高回声、边界清晰、无钙化等类似于良性肿瘤的超声表现,但RAS突变普遍存在于滤泡腺瘤、NIFTP及滤泡癌等多种甲状腺良恶性肿瘤中[23],且生物学行为以及超声特征在不同病理学类型的肿瘤中差异很大。
4 RET/PTC重排
PTC中RET/PTC重排的发生率为6%~30%[24],是PTC中第二常见的基因改变,是弥漫硬化型PTC最常见的基因改变,RET/PTC重排也常见于有颈部放射史的PTC患者中[25-26]。
RET/PTC重排的弥漫硬化型PTC病变特征包括1个或2个甲状腺叶弥漫性受累和散在的微钙化(“暴风雪”模式)。此外,这类PTC常累及颈外侧区淋巴结,表现为典型的淋巴结微钙化[27](图2C)。上述表现与RET/PTC突变导致的肿瘤细胞生物学行为改变密切相关,包括鳞状上皮化生、大量肿瘤细胞坏死形成砂粒体、淋巴细胞弥漫性浸润和广泛的间质纤维化。不同亚型的RET/PTC重排在弥漫硬化型PTC中的超声表现略有不同。RET/PTC1突变的患者常同时患有弥漫硬化型PTC和桥本甲状腺炎,其微钙化的发生率低于RET/PTC3重排的PTC[28]。在RET/PTC3重排的PTC中,等回声比低回声更常见,大多数患者表现为典型弥漫性受累伴有散在微钙化,而孤立结节很少见[26,28]。病理学表现上,RET/PTC1肿瘤呈现典型的乳头状结构,体积通常小于RET/PTC3重排的PTC,预后较好,而RET/PTC3重排则多为实性,侵袭性更强[29]。
5 TERT启动子突变
目前文献[30-31]报道,PTC患者TERT启动子突变的发生率为4.4%~11.3%。TERT启动子突变被认为是高危PTC的重要标志,与高龄、低分化程度和高复发风险密切相关[8]。
TERT启动子突变的PTC在超声上通常表现为多灶、微分叶边缘、低回声、微钙化,并且经常伴有多个颈部淋巴结转移[32](图2D)。Shi等[33]通过对351例经手术证实的PTC患者术前的临床及超声图像特征进行分析,建立了预测PTC中TERT启动子突变的风险评分系统,其中患者年龄大于50岁、垂直位、微分叶边缘、包膜受累为TERT启动子突变的独立危险因素。当存在3个以上的独立危险因素时,能够正确预测超过90%的TERT启动子突变。Xing等[34]的研究表明,超过90%的TERT启动子突变的PTC患者同时伴有BRAF突变。尽管TERT启动子突变可能发生在BRAF突变的PTC患者中,但两者之间没有显著关联。与仅存在BRAF突变的PTC相比,同时具有TERT启动子突变和BRAF突变的PTC与垂直位显著相关。另一项研究[35]指出,无突变、仅BRAF突变,以及TERT启动子和BRAF突变同时存在,这3种情况相比起来,低回声、非平行方向、毛刺/微分叶边缘和微钙化等恶性超声特征的概率依次呈线性增加,且上述基因突变的数量与恶性超声特征的比例之间存在关联。
6 其他分子突变
微小RNA(microRNA,miRNA)是一种非编码RNA,通过识别同源序列进而干扰转录、翻译或表观遗传学过程来调节基因表达[36]。miRNA参与许多细胞内调控过程,例如分化、增殖和凋亡,不同水平的miRNA可能会使PTC表现出不同的超声特征,miRNA-31高表达与边界模糊、边缘不光整、微钙化及边缘血供存在关联[37],miRNA-138-5p表达下调与边缘不规则、纵横比≥1有关[38]。
P16和RB基因为抑癌基因,定位于细胞核内,参与细胞周期的调控。有研究[39]表明,P16及RB基因的缺失与PTC远处转移及术后复发密切相关。此外,还与低回声、微钙化、Ⅲ级血流、纵横比≥1及淋巴结转移有关[40]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)在促进PTC血管生成和肿瘤细胞生长等方面具有重要作用,与病灶Ⅲ级血流、微钙化、低回声等特征密切相关,表明VEGF可作为辅助评估PTC病情的指标[41]。
相比于PTC中常见的分子标志物,上述改变与PTC超声特征的相关性尚处于探索阶段,仍需更多研究进行验证。
7 小结
不同分子标志物的改变能够在不同程度上影响PTC的生长模式和生物学行为,表现出不同的超声特征。BRAFV600E突变往往与边缘不规则、极低回声、微钙化等恶性超声征象有关。PTC中的RAS突变则更可能与良性超声特征和惰性生物学行为有关,而RET/PTC重排在弥漫硬化型PTC中具有典型的超声特征。TERT启动子突变与PTC病变的多灶性和淋巴结转移有关。更多的PTC分子标志物改变与超声特征之间的相关性尚在探索之中,对PTC的早期诊断、指导FNAB的进行以及制订个体化的诊疗方案具有长远意义。
