百蕊草有效成分提取工艺优化及生物活性检测
2022-11-07张丽杰谭维群
张 湄,张丽杰,谭维群,彭 岚,王 颖
(重庆理工大学 药学与生物工程学院, 重庆 400054)
0 引言
百蕊草属檀香科植物,为半寄生多年生植物[1],研究发现百蕊草中主要包含黄酮类、有机酸、生物碱、鞣质、酚类、多糖、甾醇、挥发油、矿物质、甘露醇等多种生物活性成分[2-4],具有抑菌、抗氧化、消炎、抗病毒、增强免疫力等生物活性[5-9],而其中具备药理作用的主要成分为黄酮类化合物[10],使百蕊草具有“调气”、“清热解毒”、“抗菌消炎”、“通顺气脉”的药理作用[11],具有植物抗生素的美称。

1 材料和方法
1.1 材料与试剂
1.1.1材料
百蕊草干全草,购于安康四季保健养生堂。
1.1.2试剂
芦丁对照品、D101大孔吸附树脂(北京索来宝科技有限公司)、LPS、亚硝酸钠、硝酸铝、DPPH(上海麦克林生化科技有限公司)、氢氧化钠(重庆川东化工有限公司)、胰蛋白酶、双抗、DMEM培养基(上海源培生物科技股份有限公司)、胎牛血清(上海吉泰依科赛生物科技有限公司)、MTT(北京酷来搏科技有限公司)、ABTS(生工生物工程股份有限公司)、氯仿、NaCl(成都市科隆化学品有限公司)、蛋白胨、酵母粉(北京奥博星生物技术有限公司)、琼脂(重庆市北碚化学试剂厂)。
1.1.3仪器与设备
超声波清洗机(SB-5200 DTD,宁波新芝生物科技股份有限公司)、紫外可见分光光度计(752N,上海仪电分析仪器有限公司)、酶标仪(Multiskan GO,美国Thermo Scientific公司)、恒温摇床(ZWY-240,上海智城分析仪器制造有限公司)、生化培养箱(SPX-250B-Z,上海博迅实业有限公司医疗设备厂)、CO2恒温培养箱(美国Thermo Scientific公司)。
1.2 试验方法
1.2.1百蕊草提取物的制备
取1 g百蕊草全草,加入70%乙醇溶液,超声提取,收集上清液为百蕊草提取物。
1.2.2标准曲线的绘制
1) 标准溶液的配置
用70%乙醇溶液将5 mg芦丁对照品超声溶解定容至25 mL。
2) 最大吸收波长的测定
参照文献[24]的方法并加以修正,取1 mL芦丁标液于比色管中,依次加入0.3 mL 5% NaNO2,静置反应6 min,0.3 mL 10% Al(NO)3溶液,静置反应6 min后加入4 mL 4% NaOH溶液,用70%乙醇定容至10 mL,静置反应15 min,全波长扫描,得到其最大吸收波长为507 nm。
3) 标准曲线的制作
标准曲线的制作参照文献[25],参照上述方法,在507 nm下检测溶液吸光度,以芦丁浓度C(mg/mL)为横坐标,吸光度A为纵坐标绘制芦丁标准曲线。提取液中黄酮含量α(mg/g)参照下式计算:
式中:C为浓度;N为稀释倍数;V为体积。
1.2.3提取工艺优化
1) 乙醇浓度对提取当量的影响
设定乙醇浓度为50%、60%、70%、80%、90%,在料液比为1∶10 g/mL、温度为50 ℃的条件下超声30 min,测定百蕊草提取液中的黄酮含量。
2) 超声时间对提取当量的影响
在乙醇浓度为60%、温度为50 ℃、料液比为1∶10 g/mL条件下,设定超声时间分别为20、30、40、50、60 min,测定百蕊草提取液中的黄酮含量。
3) 料液比对提取当量的影响
设定料液比为1∶10、1∶20、1∶30、1∶40、1∶50 g/mL,乙醇浓度为60%、温度为50 ℃条件下超声40 min,测定百蕊草提取液中的黄酮含量。
4) 温度对提取当量的影响
设定温度为40、50、60、70、80 ℃,乙醇浓度为60%、料液比为1∶30 g/mL条件下超声40 min,测定百蕊草提取液中的黄酮含量。
1.2.4响应面优化提取工艺
由于单因素实验中存在条件之间的交互影响,不能通过单因素优化实验确定最佳提取条件,利用Box-Behnken进行实验,以料液比、温度、提取时间、乙醇浓度为自变量,黄酮含量为响应值进行实验设计,采用Design-Expert 12进行响应面分析,建立回归方程,确定百蕊草黄酮的最佳提取工艺,实验因素与水平如表1所示。
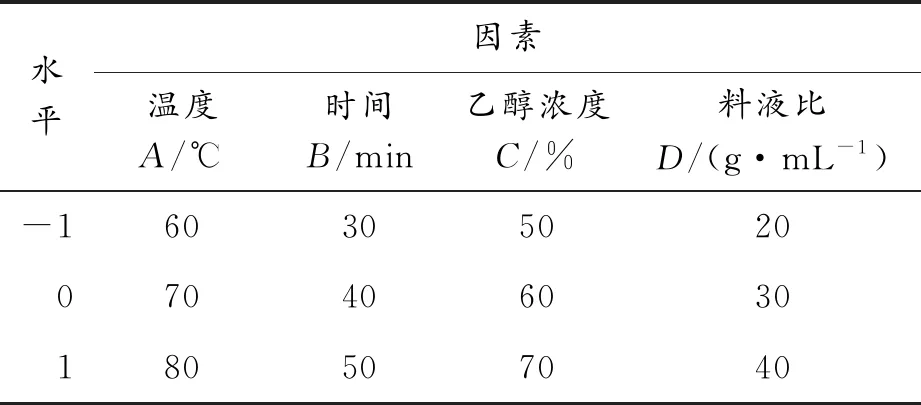
表1 实验因素与水平
1.2.5实验验证
按照预测模型中的最佳提取条件重复实验,计算黄酮的提取含量。
1.2.6萃取
将提取液合并后减压浓缩,转移至分液漏斗,按同等比例加入氯仿,静置分层,取水相上柱纯化富集。
1.2.7层析纯化
1) 树脂预处理
将D101大孔吸附树脂在95%乙醇中浸泡24 h,使树脂充分溶胀,以除去树脂内部残留的二乙烯苯、甲苯等未完全反应的引发剂和填加剂,用蒸馏水冲洗,除去悬浮颗粒和絮状物,抽滤清洗至无醇味且上清澄清,浸泡在蒸馏水中备用[26]。
2) 纯化富集
湿法上柱,将提取物以1.5 BV/h流速进行上样,蒸馏水洗涤,收集70%乙醇洗脱部位。
1.2.8体外抗氧化活性测定
配置400 μg/mL的提取液母液,自由基清除活性检测参照文献并稍作调整[27]。
1) DPPH自由基清除活性
将50 μL 0.2 mmol/L DPPH与50 μL不同浓度的提取液混合,避光静置30 min,测得ODi,以等体积50 μL乙醇代替DPPH溶液,测得ODj;以等体积乙醇代替提取液,测得OD0,VC和芦丁作为阳性对照。避光静置30 min后在517 nm处测吸光度。清除率ε(%)计算公式如下:
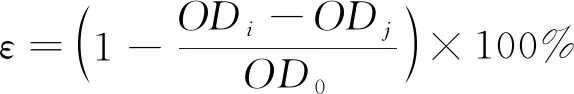
式中:ODi为样品组;ODj为空白对照组;OD0为模型对照组。
2) ABTS自由基清除活性
将7 mmol/L ABTS和2.5 mmol/L K2S2O8等体积混合避光静置12 h后得到ABTS储备液,稀释调整其吸光度OD734 nm为0.7±0.02,将100 μL ABTS储备液与50 μL提取液混合,测得ODi,以等体积100 μL无水乙醇代替ABTS溶液,测得ODj;以与样品等体积50 μL乙醇代替提取液,测得OD0;VC、芦丁代替提取液作为阳性对照组。避光静置8 min,在734 nm下测吸光度。清除率ε计算公式如下:
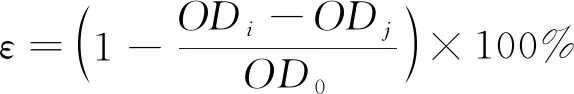
式中:ODi为样品组;ODj为空白对照组;OD0为模型对照组。
1.2.9细胞毒性检测
将L929小鼠成纤维细胞培养至对数生长期后接种于96孔板,设置空白组、阴性对照组、实验组,于37 ℃、5% CO2培养箱中培养3天,加入20 μL MTT溶液,避光孵育4 h后加入150 μL DMSO,避光震荡,490 nm波长下检测吸光度,根据下式计算细胞增殖率:
1.2.10药敏实验
1) 抑菌圈
在固体培养基上涂布100 μL稀释后的菌悬液,放置牛津杯(直径6 mm),加入100 μL药液37 ℃培养18~24 h,测量抑菌圈的直径。
2) MIC及抑制率
配制质量浓度为50 mg/mL百蕊草提取物作为母液,梯度稀释得到不同浓度的药液,第一孔仅加入200 μL液体培养基,第二孔加入100 μL培养基和100 μL菌液作为阴性对照,第3~10孔中分别加入终浓度为25、20、15、12.5、10、6.125、3.06、1.03 mg/mL的药液,加入100 μL 1×105CFU/mL的菌液作为实验组,以LB培养基和不同浓度的提取液混合液作为空白对照,在37 ℃培养箱中培养18~24 h,孔中的溶液透明澄清所对应的药液浓度即为MIC,并在600 nm下检测吸光度,根据下式计算细菌抑制率δ(%):
1.2.11抗炎性
1) 提取液对RAW264.7生长的影响
将RAW264.7细胞培养至密度为瓶底80%后,调整细胞密度为2×106个/mL,细胞贴壁后换入不同浓度的含药培养基,24 h后加入20 μL MTT,孵育4 h后,弃去MTT,加入150 μL DMSO,避光震荡,在490 nm波长下检测吸光度。
2) 提取液对LPS诱导RAW264.7分泌NO的影响
将RAW264.7以2×106个/mL的细胞密度加入96孔板,4 h后分组处理,以终浓度为1 μg/mL LPS的培养基作为阳性对照,不同浓度的含药培养基及LPS为实验组,24 h后,细胞上清液中的NO通过Griess法进行测定。
1.3 数据处理
采用Design-Expert 12进行响应面分析,SPSS 26进行显著性分析,Origin 2019绘图。
2 结果与分析
2.1 芦丁标准曲线
芦丁标准曲线如图1所示,进行线性回归得到回归方程:y=12.531 06x+0.000 6,R2=0.998。结果表明,标准液在0.01~0.1 mg/mL浓度范围内与吸光度呈良好的线性关系。
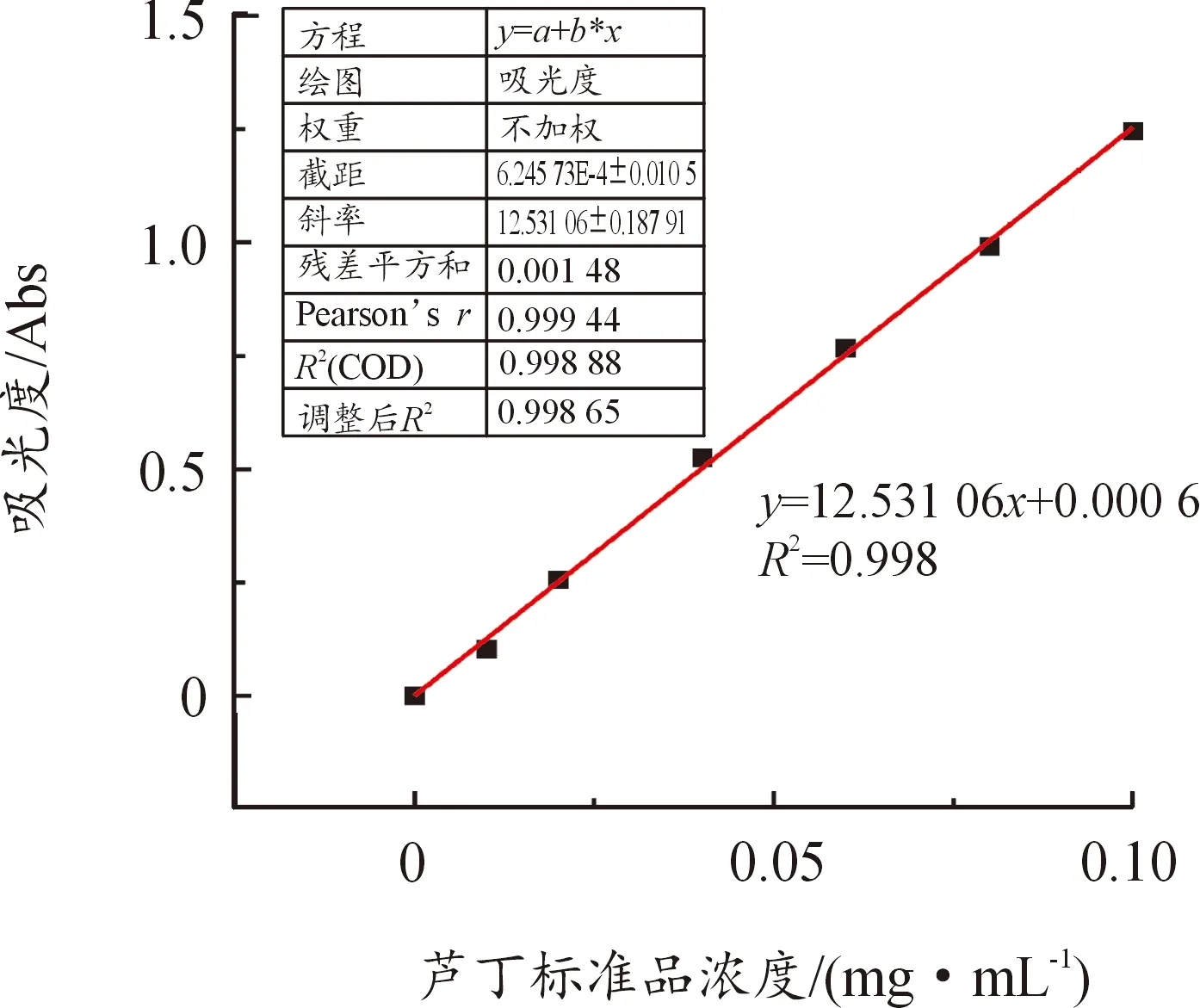
图1 芦丁标准曲线
2.2 单因素实验
2.2.1乙醇浓度对提取当量的影响

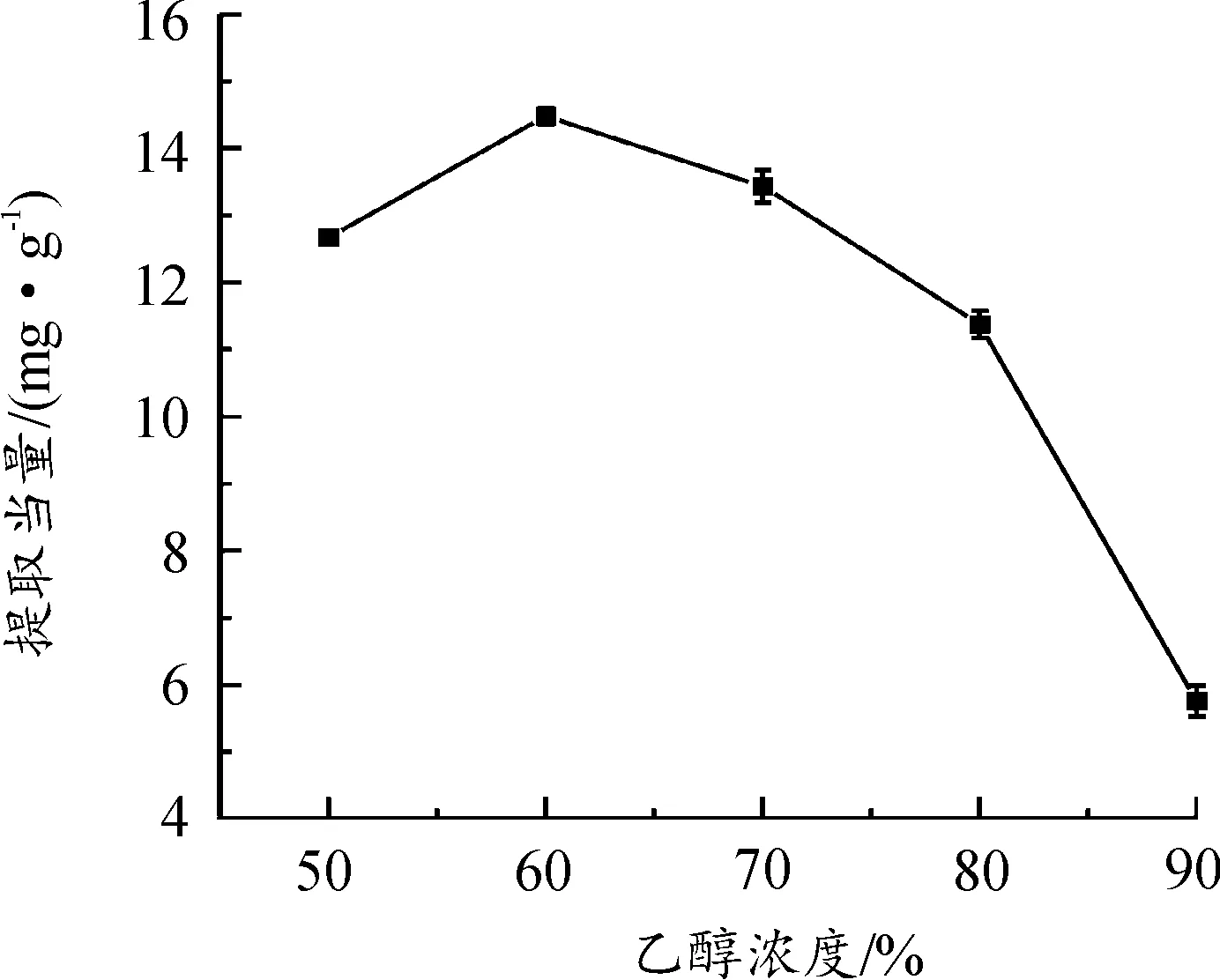
图2 乙醇浓度对黄酮提取当量的影响曲线
2.2.2超声时间对提取当量的影响
由图3可知,提取当量会随着超声时间的延长逐渐增大,提取当量在超声40 min时达到最大,40 min后,可能由于长时间的超声,百蕊草中的有效成分在空化作用下分解[29],提取当量随之下降。
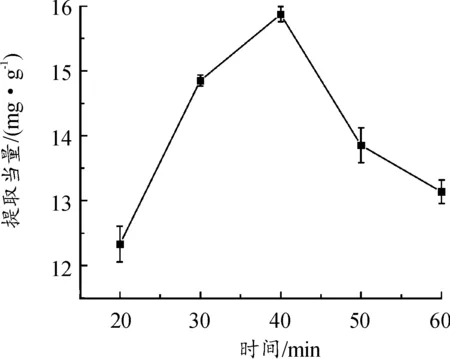
图3 超声时间对黄酮提取当量的影响曲线
2.2.3料液比对提取当量的影响
由图4可知,随着溶剂的增多,增加互溶机会,提取当量逐渐增大,有利于有效成分的溶出[30],当料液比为1∶30 g/mL时,提取当量达到最大,随着料液比的增大,对提取当量的影响不大,且为了节省溶剂,节约提取成本,选择提取料液比为1∶30 g/mL。
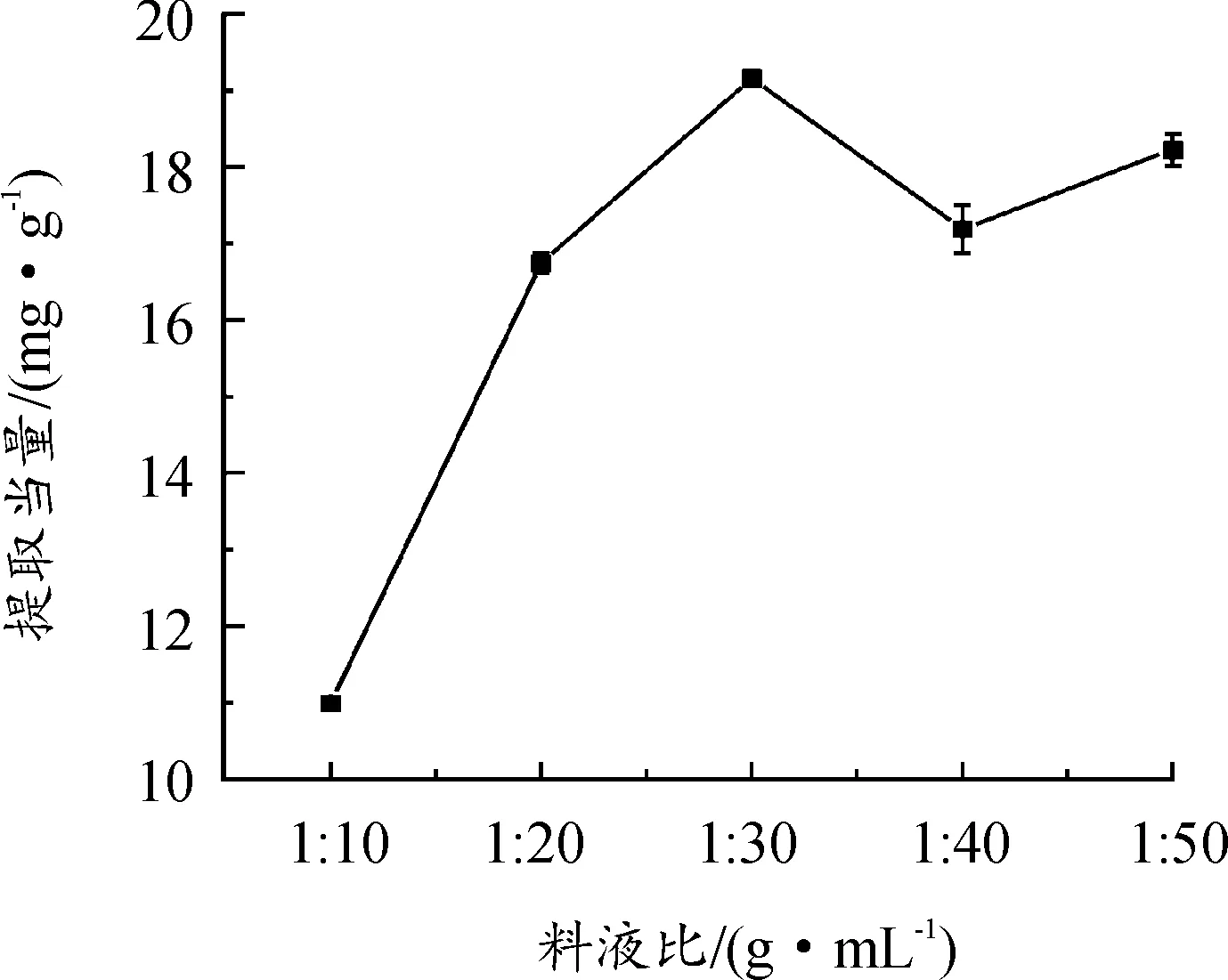
图4 料液比对黄酮提取当量的影响曲线
2.2.4提取温度对提取当量的影响
由图5可知,提取当量会随着温度的上升而逐渐增大,当温度为70 ℃时,提取当量达到最大,超过一定的温度,破坏黄酮的结构,致其分解[31],从而导致提取当量下降,因此选择提取温度为70 ℃。
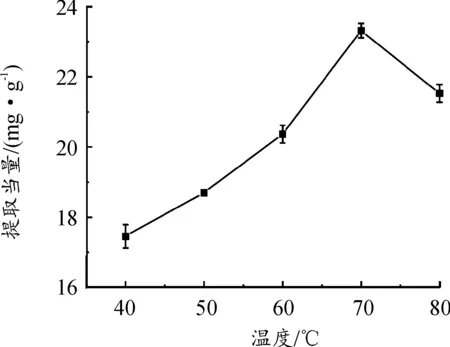
图5 温度对黄酮提取当量的影响曲线
2.3 响应面优化提取工艺
2.3.1响应面实验设计
采用Box-Behnken中心组合进行四因素三水平实验,条件及结果如表2所示。
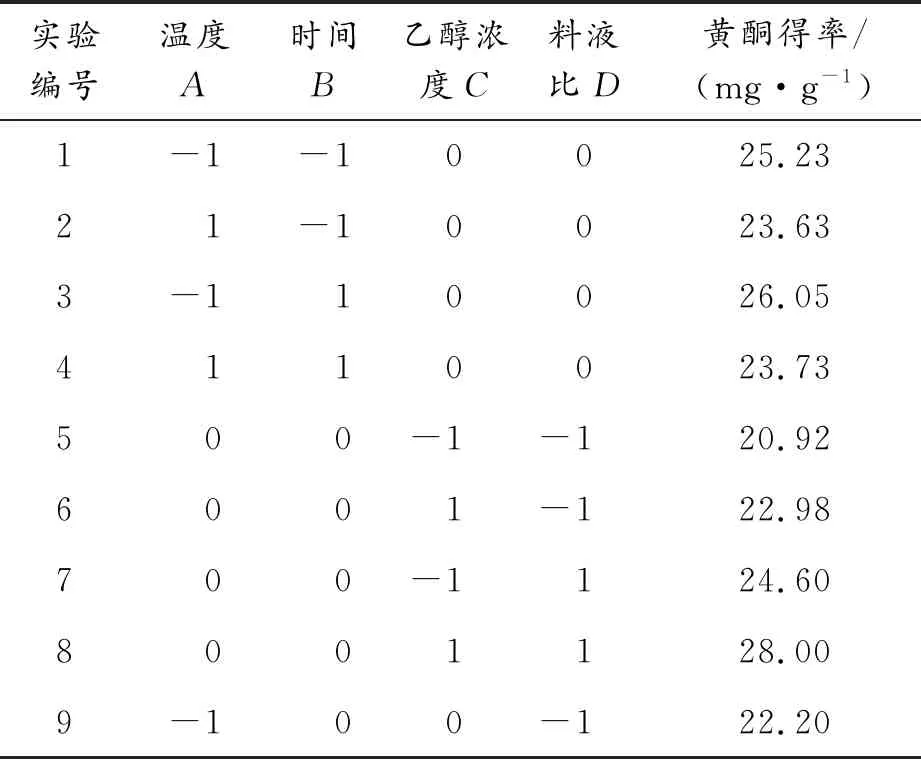
表2 Box-Behnken 实验数据
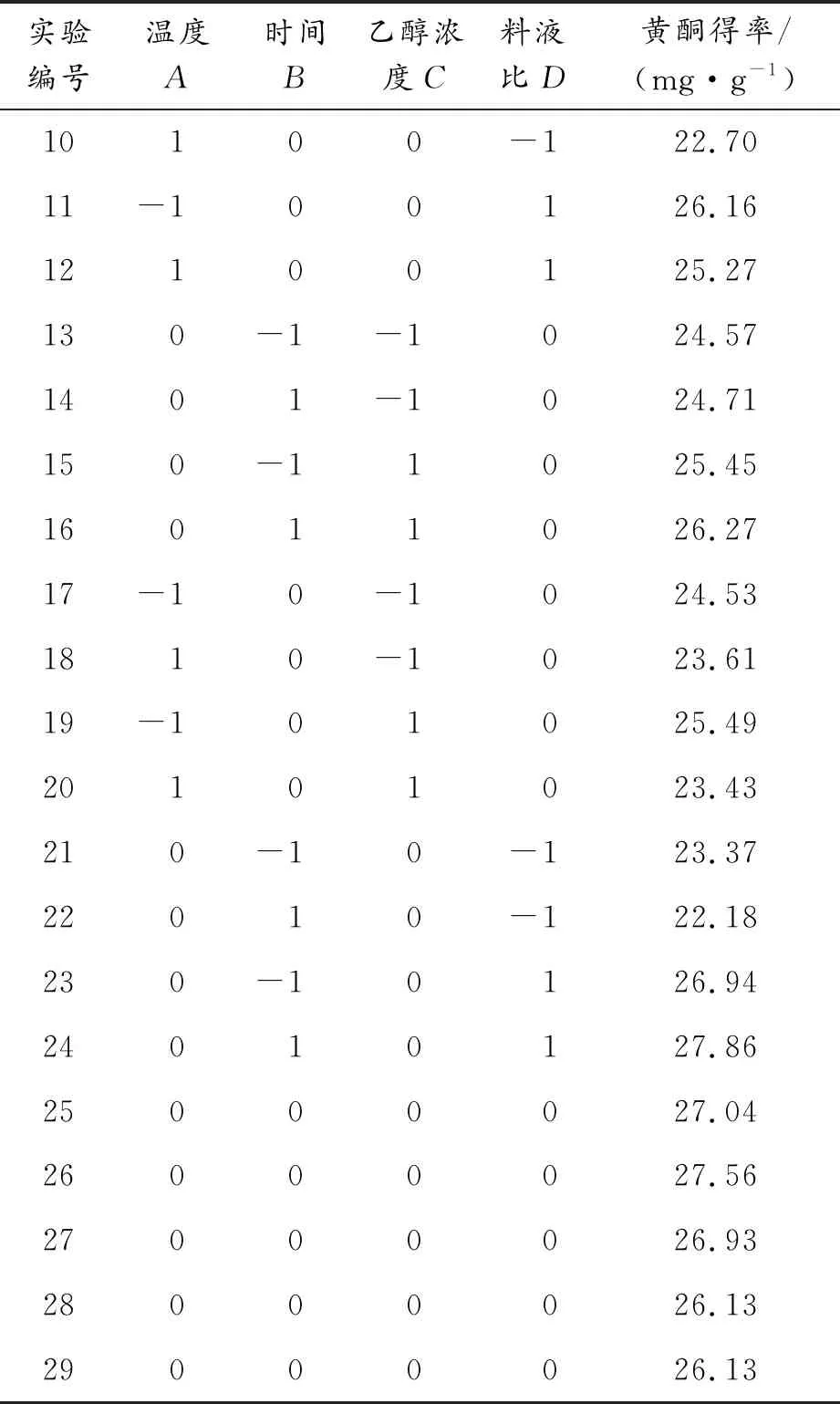
续表(表2)
2.3.2回归方程拟合及方差分析
回归方程拟合及方差分析结果如表3所示。
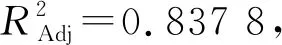
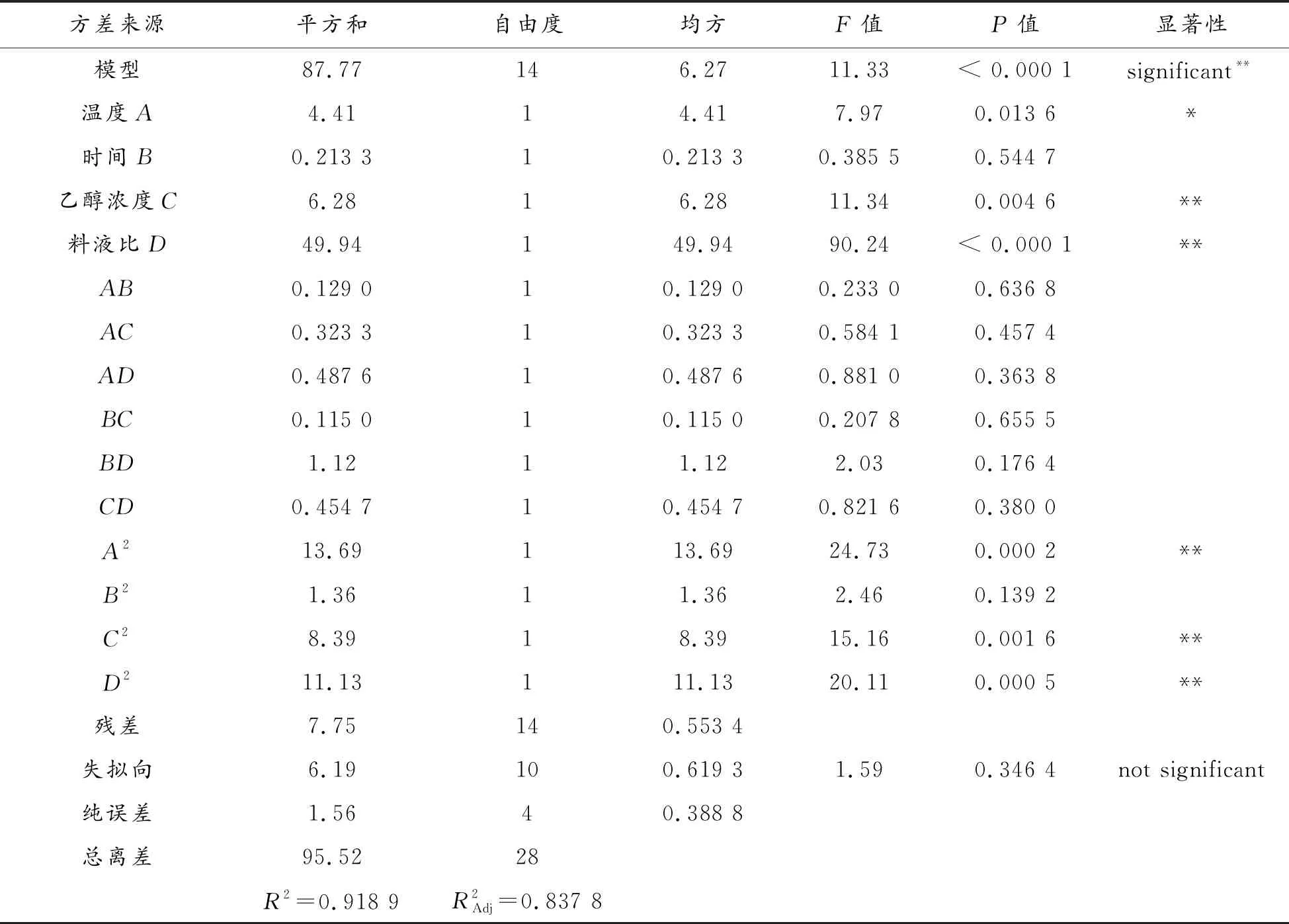
表3 回归方程拟合及方差分析结果
方差分析中可以看出乙醇浓度C、料液比D对黄酮提取量的影响显著(P<0.01),温度A的P值小于0.05,影响顺序从大到小依次为:D>C>A。二次项A2、C2、D2对百蕊草黄酮的提取具有极显著性影响。
2.3.3响应面分析
采用 BOX-Behnken设计实验,进行四因素三水平的响应面分析实验。数据采用Design Expert 12软件进行多元回归拟合分析,得到以百蕊草黄酮提取当量Y为目标函数的多元二次回归方程:
Y=26.76-0.606 2A+0.133 3B+
0.723 2C+2.04D-0.179 6AB-
0.284 3AC-0.349 1AD+0.169 6BC+
0.529 7BD+0.337 2CD-1.45A2-
0.458 0B2-1.14C2-1.31D2
图6—11所示为因素交互作用对百蕊草总黄酮提取当量的影响,3D响应面和等高图可以直观反映出因素的交互作用对响应值的影响程度。从图10中可以得出时间和料液比的交互作用对黄酮提取量的影响显著,且料液比对响应值的影响大于提取时间。由图7、8、11分析可知,该图响应面坡度稍陡,可以得出温度和乙醇浓度、温度和料液比、料液比和乙醇浓度的交互影响对黄酮提取量的影响稍显著。通过等高线的疏密可以从图7中判断在交互影响中乙醇浓度对响应值的影响大于温度;从图8、11中判断出料液的影响大于温度和乙醇浓度; 由图6、9分析可知,温度和时间以及时间和乙醇浓度的交互作用对黄酮提取量的影响不显著,且温度、乙醇浓度对响应值的影响大于时间。
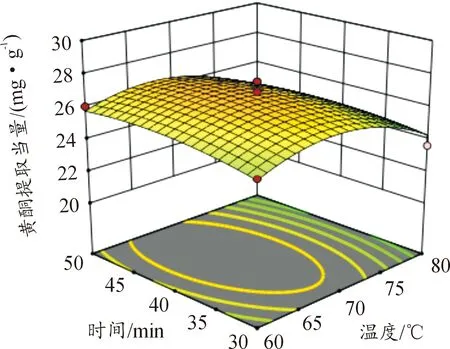
图6 Y=F(A,B)响应面和等高图
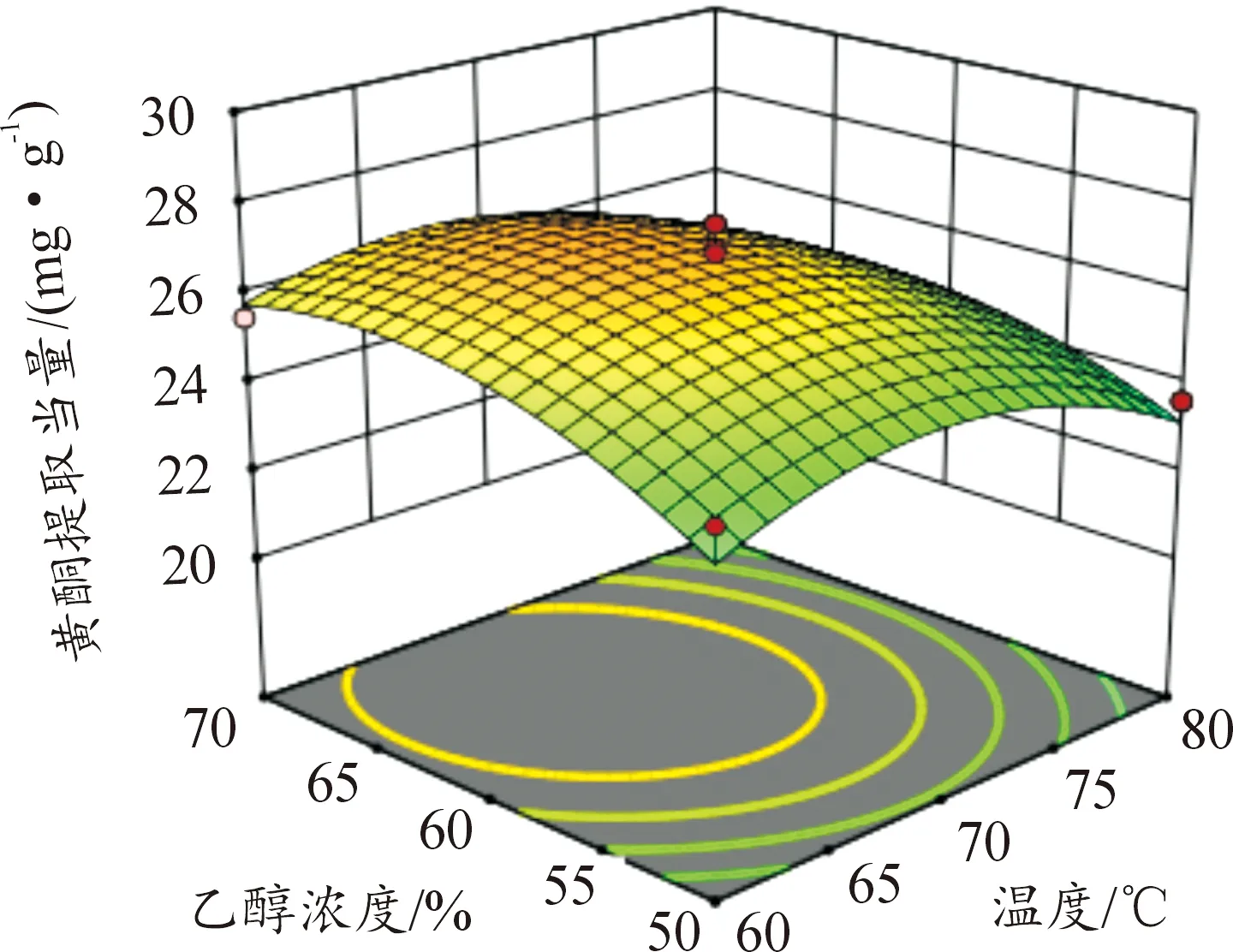
图7 Y=F(A,C)响应面和等高图
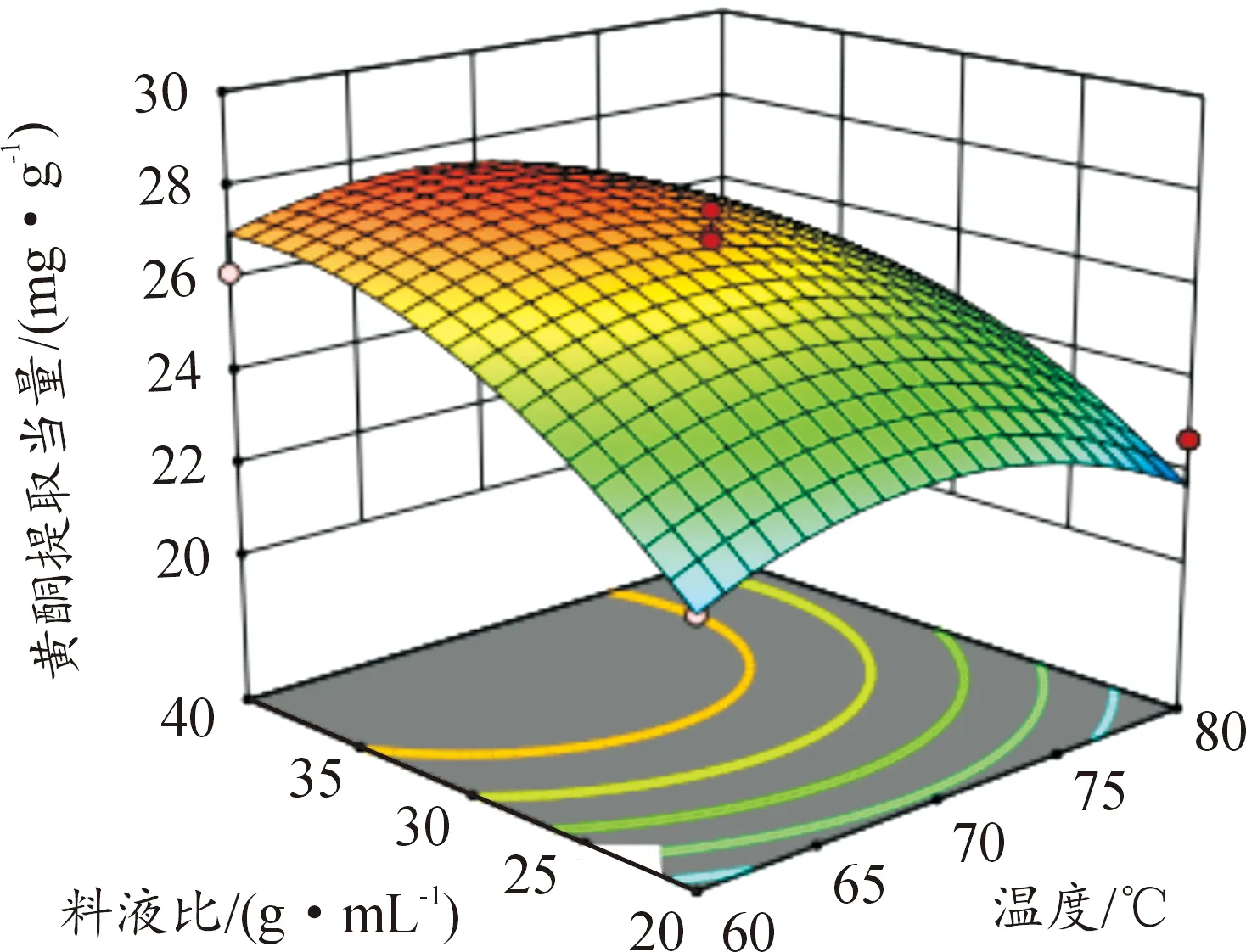
图8 Y=F(A,D)响应面和等高图
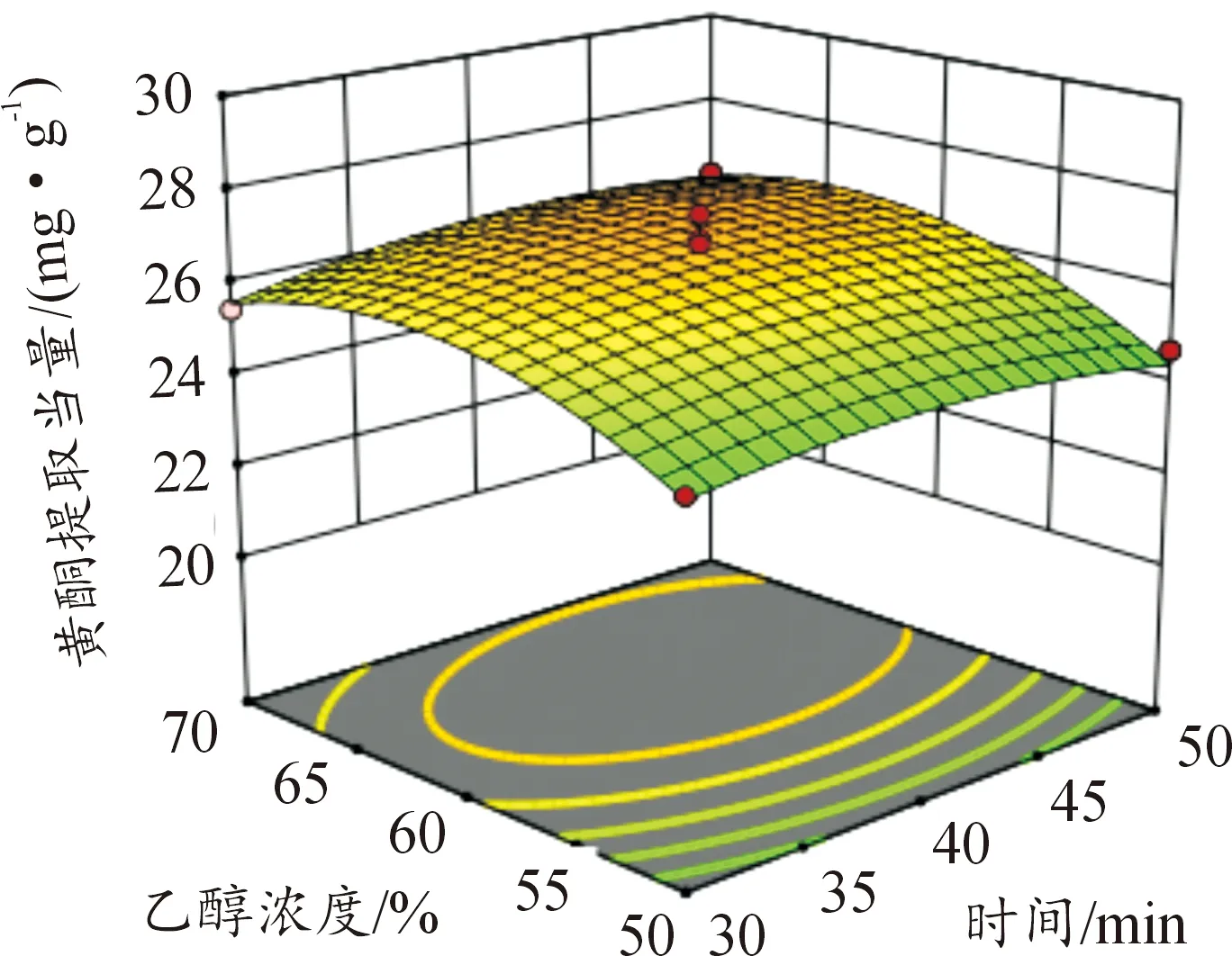
图9 Y=F(B,C)响应面和等高图
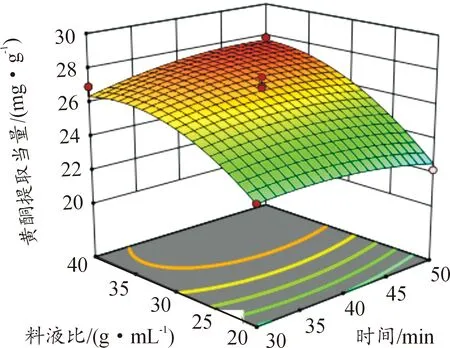
图10 Y=F(B,D)响应面和等高图
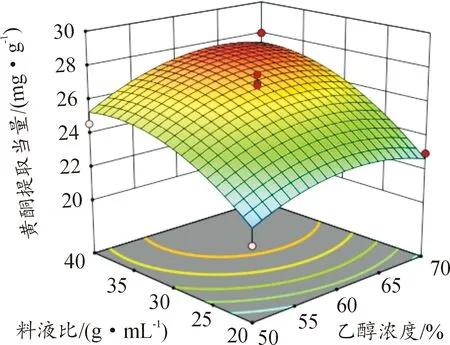
图11 Y=F(C,D)响应面和等高图
2.3.4回归模型验证
经软件进行分析得到预测最优提取条件,如表4所示。

表4 预测最优提取条件
后续对此条件进行验证,将提取条件修改为:温度A为65 ℃,提取时间为50 min,乙醇浓度为65%,料液比为1∶40 g/mL,得到百蕊草的总黄酮提取当量为28.227±0.52 mg/g,结果与模型预测的黄酮提取当量为28.317 mg/g相近,验证了理论模型的适用性和可靠性,能为百蕊草总黄酮的提取开发提供指导。
2.4 抗氧化性检测
2.4.1清除DPPH自由基活性测定
DPPH是一种较为稳定的自由基,常以自由基形态和含N=N+正离子态存在,在517 nm波长下有最大紫外吸收,应用于评价化合物对自由基的清除能力[32]。百蕊草粗提取液、纯化后的提取物、芦丁和抗坏血酸对DPPH自由基的清除活性如图12所示,可以看出,VC溶液的DPPH自由基清除能力高于芦丁标准液和提取液,在50~400 μg/mL的浓度范围内,VC的清除能力一直处于较高水平,清除率能达到97.6±0.17%,芦丁在50~200 μg/mL范围内,DPPH自由基清除能力逐渐增大,在200~400 μg/mL浓度范围内,清除能力逐渐趋于平缓,400 μg/mL时清除率达到93±0.24%,而提取液对DPPH自由基清除能力呈浓度依赖性,且纯化后的清除力有所提高,当浓度为400 μg/mL时,粗提取液的清除率达到76±1.69%,纯化后的提取物的清除率达到93.5±0.31%,说明提取物经萃取、富集纯化后黄酮类化合物的含量增多,黄酮类化合物结构上的酚羟基和羧羟基上的H+能将DPPH上的孤电子结合,抗坏血酸通过递电子、递质子使其生成DPPH2和还原N=N+使其还原成为三硝基苯胺[33],使得DPPH溶液褪色,褪色程度说明抗氧化剂对DPPH自由基的清除能力,以此来评判化合物的抗氧化能力。
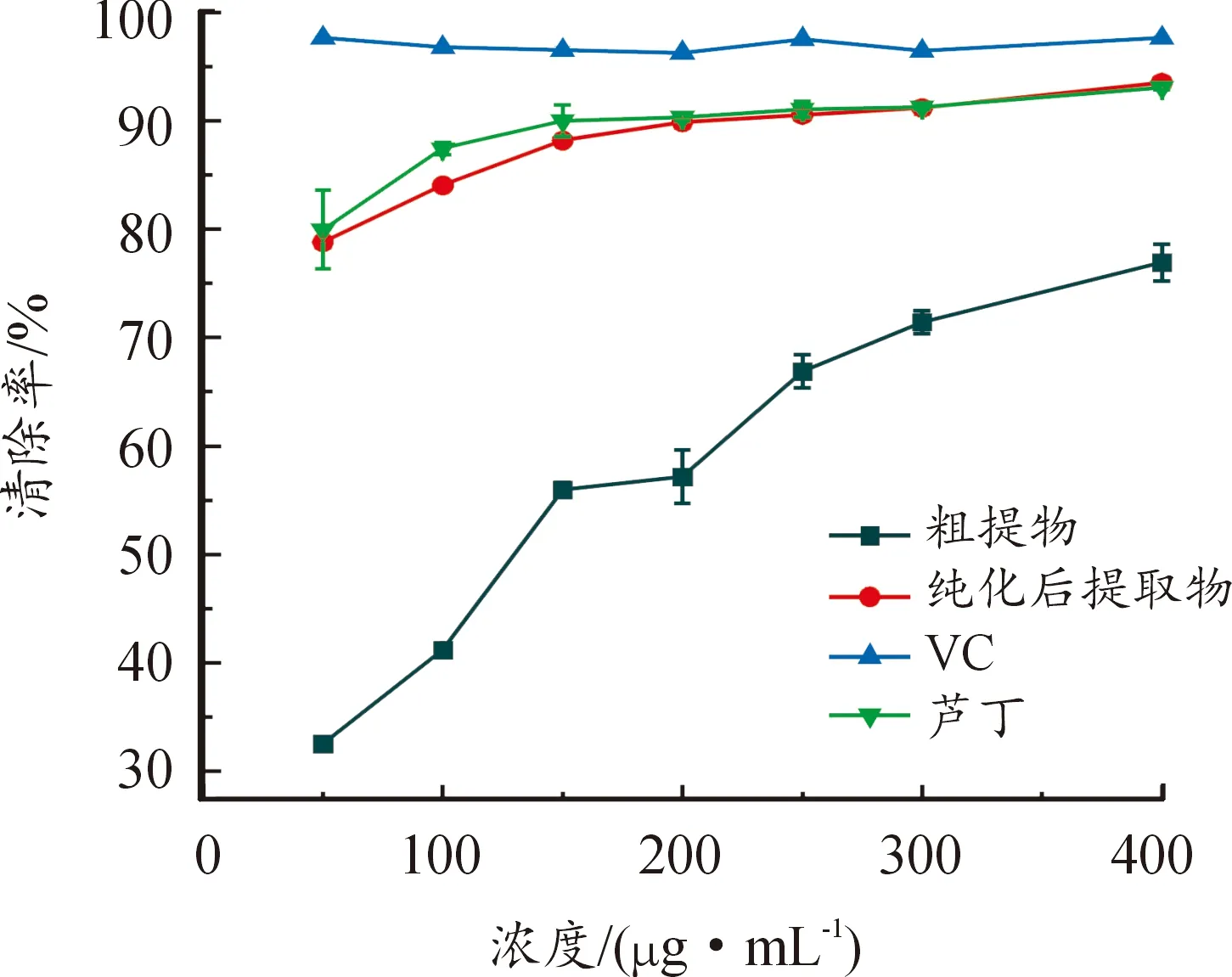
图12 DPPH自由基清除活性曲线
2.4.2清除ABTS自由基活性测定
ABTS是以氮原子为中心的自由基[34],ABTS被K2S2O8氧化后生成绿色的阳离子ABTS溶液,在734 nm波长下有最大紫外吸收,与黄酮类化合物结构上酚羟基提供的孤对电子或氢原子配对后,自由基减少,导致溶液褪色[35]。百蕊草粗提取液、纯化后的提取物、芦丁和VC对ABTS自由基的清除作用如图13所示,从图中可以看出,VC和芦丁标准液在50~100 μg/mL浓度范围内对ABTS的清除活性为较高水平,而提取物对ABTS自由基清除能力呈浓度依赖性,当浓度为400 μg/mL时,提取液的清除率达到最大(98.3±0.34%),纯化后的提取物对ABTS自由基清除率相较于达到最大(98.95±0.33%),在低浓度时的抗氧化能力比粗提物强,芦丁和提取物均属于黄酮类化合物,产生的自由基会与化合物上的质子结合,组合成稳定的结构阻断氧化过程,VC可通过与氧的相互作用消耗封闭系统中的氧[36],在低浓度的情况下也具有极强的抗氧化能力。
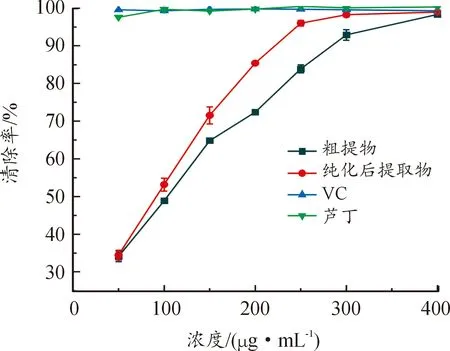
图13 ABTS自由基清除率曲线
2.5 细胞毒性
在组织修复中,成纤维细胞起着重要的作用,采用L929细胞评估百蕊草提取物对细胞增殖的影响,以期评估百蕊草提取物的安全性[37]。如图14(a)所示,在0.1~1 mg/mL浓度范围内,百蕊草提取物没有细胞毒性;图14(b)中细胞与含纯化后的提取物共培养3天后增殖率有所下降,说明提取物经过萃取纯化后,黄酮含量增多,增殖率均大于50%,总体没有细胞毒性。
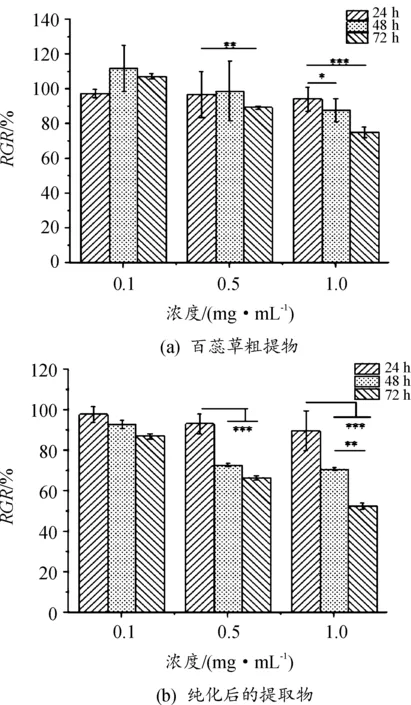
图14 百蕊草粗提物及纯化后的提取物对L929细胞增殖活性的影响
2.6 抑菌性检测
提取物对2种细菌的抑制情况如表5所示,大肠杆菌和金黄色葡萄球菌在10 mg/mL浓度下浑浊现象不明显,12.5 mg/mL浓度及以上未出现浑浊,因此最低抑菌浓度为10~12.5 mg/mL;提取物对金黄色葡萄球菌的抑制率低于大肠杆菌,大肠杆菌和金黄色葡萄球菌在提取液的作用下出现的抑菌圈分别为12 mm、10 mm;天然黄酮能通过影响细菌能量代谢、干扰细菌细胞壁中肽聚糖的合成、破坏细胞膜的完整性、改变细胞膜的通透性、抑制细菌菌体的核酸代谢等方式影响细菌的能量、代谢过程,从而起到抑制细菌生长作用[38],综上所述,说明大肠杆菌对百蕊草提取物的敏感度大于金黄色葡萄球菌,这与抑菌圈结果测定相符。
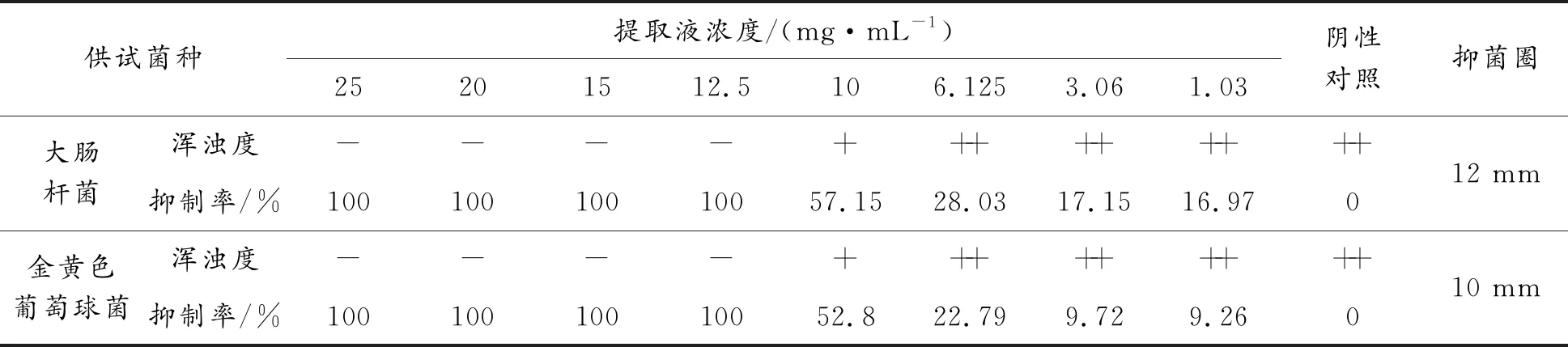
表5 百蕊草提取物对2种常见病原菌的抑制情况
2.7 抗炎性
RAW264.7经LPS刺激后会分泌大量炎症因子,NO是其中的一种,但是NO极其不稳定,易被氧化成亚硝酸盐,通过Griess法,在酸性环境中检测亚硝酸盐的浓度,从而检测出NO的分泌量[39]。从图15(a)中可以看出,将巨噬细胞与1、0.8、0.6、0.4、0.2 mg/mL提取液共培养24 h后,提取物对RAW264.7细胞的生长无明显抑制作用,表现出一定的促增殖活性。从图15(b)中可以看出,RAW264.7经过LPS刺激后,NO的分泌量与阴性对照具有显著性差异,说明LPS诱导成功,在0~1 mg/mL浓度范围内能够明显抑制LPS刺激巨噬细胞分泌NO,降低炎症反应,抑制作用呈现出一定的剂量依赖性,表明百蕊草提取物具有良好的抗炎性。

图15 提取物对RAW264.7生长及NO分泌量的影响
3 讨论
提取物中包含多种植物代谢产物,而百蕊草中含有的黄酮、多糖、生物碱、有机酸、甾醇等多种具有生物活性的化学成分为百蕊草的次生代谢产物。从百蕊草中分离鉴定出的木犀草素-7-O-葡萄糖苷、山奈酚、紫云英苷、芸香苷、蒙花苷、大蓟苷、高车前苷、芹菜素-5-O-葡萄糖-鼠李糖苷等化合物是以山奈酚为母核衍生的黄酮及其与糖类结合形成的黄酮苷类化合物,也是使百蕊草具有抗炎、抗氧化、抑菌等药理活性的主要活性物质[3,23]。实验结果表明,提取物经过氯仿萃取、树脂纯化后,有效成分得到了富集,生物活性也有所增强。抗氧化活性与黄酮类化合物母核上的酚羟基数目、多糖结构中的半缩醛羟基提供的氢原子及新生成自由基的稳定性相关,不同种类的化合物结构上的羟基位置不同,其活泼程度不同,所以抗氧化性能不同[40],多种化合物的共同作用,能够显著提高提取物的抗氧化活性。
目前针对抗生素产生的耐药性已经成为在抗感染领域中函待解决的问题,从天然植物中开发利用具有抑菌性的天然活性物质成为解决这个问题的另一种渠道,百蕊草中的黄酮及生物碱能够破坏细胞膜的完整性,改变细胞膜的结构和通透性,通过抑制DNA旋转酶的合成影响核酸复制、降低产生毒力因子的能力、阻碍细菌对蛋白质和糖分等营养物质的利用,影响正常代谢,从而抑制细菌的生长[41],因此提取物对临床常见的2种致病菌大肠杆菌、金黄色葡萄球菌的生长体现出不同程度的抑制作用,大肠杆菌、金黄色葡萄球菌在提取物浓度为50 mg/mL时产生的抑菌圈分别为12 mm和10 mm,这说明不同菌种对药液的敏感性不同,对革兰氏阴性细菌的抑制作用比革兰氏阳性细菌更强[42],提取物通过多种机制发挥抑菌作用,能够避免因抗生素细菌产生耐药性,且天然化合物与抗生素表现出一定的抑菌协同作用,降低MIC值,产生更好的疗效。
通过实验发现百蕊草提取物对巨噬细胞具有促增殖作用,能够抑制脂多糖诱导RAW264.7分泌NO,提取物浓度越高,NO分泌量越低,呈剂量依赖性。姜明言等[43]和Li等[44]发现黄酮类物质具有抗炎性,其机理为细胞外配体LPS通过刺激巨噬细胞表面的受体TLR4,激活巨噬细胞中NF-κB、MAPK和AP-1等调控炎症的信号通路,进一步激活下游激酶,促进iNOS、COX-2及NO等炎症因子的分泌和表达。百蕊草提取物中的山奈酚及其衍生物可以作为一种细胞因子调节剂[45],能够抑制LPS诱导RAW264.7细胞内NF-κB、MAPK信号通路的激活,对iNOS、COX-2蛋白的表达表现出极大的抑制作用,从而减少NO等炎症因子的表达,且随着提取物浓度的增大,对炎症活性的抑制作用也有所增强。通过细胞安全性实验发现1 mg/mL浓度范围内的提取物对L929细胞无明显细胞毒性,在安全范围内。全面探究了百蕊草提取物的生物活性,具有良好具有抑菌性、抗炎性和抗氧化性,细胞毒性评价有利于更好地控制用药剂量和进行药效评估,确保药物外用的安全性,为把百蕊草应用范围扩大到外科伤口中进行了重要摸索。
