谷氨酸棒杆菌中烷基过氧化物还原酶(CgAhp)抵御环境胁迫的作用机制*
2022-11-07李海燕胡梦蝶时玉珠廖鑫鸣司美茹
李海燕, 胡梦蝶, 刘 洋, 时玉珠, 廖鑫鸣, 司美茹
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
0 引 言
活性氧(ROS)是光合作用和呼吸代谢等正常代谢过程中产生的有毒副产物,受到氧化剂、低pH值、重金属、高温、联胺(diamide)和抗生素等不利环境刺激的诱导[1]. 活性氧是一种高反应性分子,如过氧化氢(H2O2)、超氧阴离子(O2·-)和有机过氧化物等,能够对蛋白质、DNA和细胞膜进行修饰并造成不同程度的损伤,甚至导致细胞内氧化还原稳态破坏并引发氧化应激[2]. 在一定条件下活性蛋白结构的改变或由于蛋白活性需要巯基的特异性氧化,2个半胱氨酸巯基之间形成二硫键使蛋白失活[3]. 为了对抗ROS毒性,细胞产生各种抗氧化酶,以持续监测细胞内氧化还原状态的变化并促进蛋白的正确折叠[4].
ROS的酶清除系统涉及不同细胞区室中的许多酶催化反应. 从古细菌、低等原核生物到高等真核生物中发现基于硫醇的过氧化物酶构成了一个大家族,包括过氧化物酶(Prx)、谷胱甘肽过氧化物酶(GPx)和有机醇过氧化物酶(Ohr)[5,6]. 基于硫醇的过氧化物酶通过保守的活性半胱氨酸残基代谢过氧化物时,这些残基会发生氧化. 为了完成催化循环,必须对半胱氨酸残基进行还原. 这些过氧化物酶依赖不同的还原系统,包括烷基氢过氧化物还原酶亚基F(AhpF);硫氧还蛋白(Trx)和硫氧还蛋白还原酶(TrxR);分枝硫醇氧化还原酶(Mrx1)、硫醇二硫化物交换蛋白类分枝硫醇氧化还原酶(DsbA-like Mrx1)、分枝硫醇还原酶(Mtr)、分枝硫醇(MSH);烷基过氧化物还原酶D(AhpD)、二氢硫辛酰胺脱氢酶(Lpd)、二氢硫辛酰胺琥珀酰转移酶(SucB)[7,8]等. 氧化过氧化物酶二硫氧化还原酶,如AhpF,Trx,Mrx1,DsbA-like Mrx1和AhpD,是还原系统的核心成员,直接与氧化过氧化物酶相互作用并将电子转移到氧化过氧化物酶.
由4种不同亚单位AhpC,AhpD,AhpE和AhpF组成的烷基过氧化物还原酶Ahp是一类二硫键氧化还原酶的已知成员[9],也是具有传播自由基链式反应和直接解毒ROS能力的巯基依赖性Prx家族的成员[10]. 细菌中的AhpC和AhpE催化H2O2、叔丁基过氧化氢(t-BHP)、异丙苯过氧化氢(CHP)和过氧亚硝酸盐的还原[11,12]. AhpF是一种具有氧化还原酶活性的黄素蛋白,可将氧化的AhpC还原为还原形式[8]. 在一些不含ahpF的细菌中,ahpD与ahpC或ahpF都没有序列相似性,但在分枝杆菌和除虫链霉菌中起到与ahpF类似的作用[9].因此,ahp的表达在氧化应激中起重要作用. 谷氨酸棒杆菌是一种工业重要的革兰氏阳性细菌,它含有3种Ahp同系物[NCgl2286(AhpD1),NCgl2349(AhpD2),NCgl0877(假定的Ahp)][13]. 谷氨酸棒杆菌AhpD1和AhpD2能协同Lpd/SucB/NADH系统通过自身活性位点二硫醇再生多种硫醇依赖性过氧化物酶[14],但有关NCgl0877的研究很少. 最近,Si等人发现NCgl0877是OsaR(有机过氧化物和抗生素敏感调节剂)的主要靶点之一,而OsaR参与氧化应激反应[15]. NCgl0877具有Cys-Pro-Gly-Cys(C-P-G-C)活性位点,与AhpDs中的C-G-T-C或C-V-Y-C不同. 前期研究发现,CXXC基序中半胱氨酸之间的2个中间残基的差异会引起过氧化物酶二硫键还原酶的酶促反应速度和底物偏好特性不同[16]. 因此,新C-P-G-C活性位点的发现促使研究NCgl0877(即CgAhp)在谷氨酸棒杆菌抗氧化中的作用.
1 材料与方法
1.1 菌株和生长条件
本研究使用的菌株和质粒列于表1[17,18]. 采用Luria-Bertani(LB)肉汤和平板分别在37 ℃和30 ℃下培养大肠杆菌或谷氨酸棒杆菌RES167. 根据司美茹[4]的方法制备Δcgahp基因缺失菌株和相应互补菌株. 含500 mM山梨糖醇(BHIS)的脑心浸液肉汤培养基用于产生和维持谷氨酸棒杆菌RES167中基因的突变体[19]. 在培养基中加入0.5 mM异丙基β-D-硫代半乳糖苷(IPTG)(Sigma-Aldrich)诱导互补菌株中pXMJ19-cgahp衍生物上cgahp基因的表达. 大肠杆菌DsbA来自广东深圳市鑫博生生物科技有限公司. 抗生素添加浓度为:卡那霉素,大肠杆菌50 μg/mL,谷氨酸棒杆菌25 μg/mL;萘啶酮酸,谷氨酸棒杆菌40 μg/mL;氯霉素,大肠杆菌20 μg/mL,谷氨酸棒杆菌10 μg/mL.

表1 菌株、质粒和引物
1.2 质粒构建
本研究使用的引物如表1所示. 采用引物对Ocgahp-F和Ocgahp-R从谷氨酸棒杆菌 RES167基因组DNA中扩增出谷氨酸棒杆菌cgahp基因(ncgl0877)区域并克隆到EcoRI和XhoI位点之间的pET28a载体中,得到pET28a-cgahp.
利用引物对Dcgahp-F1/Dcgahp-R1和Dcgahp-F2/Dcgahp-R2采用两步重叠PCR方法构建读码框缺失483-bp的DNA片段,并进行双酶切插入自杀质粒pK18mobsacB中获得pK18mobsacB-Δcgahp[20].
利用引物对Ccgahp-F/Ccgahp-R从谷氨酸棒杆菌基因组DNA中扩增cgahp基因开放阅读框区DNA片段,获得pXMJ19-cgahp. 将得到的DNA片段用SalI和BamHI进行剪切,然后克隆到SalI和BamHI位点之间的pXMJ19载体上.
1.3 重组蛋白的过表达和纯化
将BL21(DE3)(pET28a-cgahp)菌株在含有卡那霉素(50 μg/mL)的LB培养基中进行37 ℃、220 rpm振荡培养. 当OD600 nm为0.6时,加入0.5 mM IPTG,22 ℃培养10 h后,4 ℃离心收集细胞. 细胞颗粒悬浮在30 mL裂解缓冲液中[10 mM Tris(pH 6.8),10%甘油和10 mM β-巯基乙醇(β-ME)]经超声处理,10 000×g离心60 min. 用His•Bind Ni-NTA树脂(Novagen,Madison,WI)纯化上清中的目标蛋白. 纯化的His6-tag蛋白在4 ℃下用PBS透析浓缩,用于进一步的实验[通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)估计纯度大于95%].
1.4 氧化剂、烷化剂、重金属和还原剂敏感性检测
根据Rawat等人[21]的研究,采用纸片扩散对菌株的药剂敏感性进行分析. 取100 μL对数中期的培养物(约107cfu)涂在LB平板上,然后将10 μL试剂原液浸泡过的滤纸片轻轻放于LB平板上. 试剂原液为200 mM H2O2,0.5 mM次氯酸(HClO),5 mM diamide,11 mM CHP,60 mMt-BHP,70 mM 1-氯-2,4-二硝基苯(CDNB),1 mM碘乙酰胺(IAM),25 mg/mL链霉素(STR),5 mg/mL环丙沙星(CIP),0.5 mM氯化镉(CdCl2)和10 mM硫酸镍(NiSO4). 在30 ℃下孵育2~3 d,测量抑菌圈的直径. 实验至少进行3个独立生物学重复.
1.5 氧化型CgAhp-S2的体外制备
根据Van Laer等人[22]的方法制备氧化型CgAhp-S2(含分子内二硫键的CgAhp).
1.6 TrxR/NADPH,MSH/Mtr/NADPH和Lpd/SucB/NADH途径氧化CgAhp-S2的稳态动力学研究
在340 nm(ε340=of 6220 M-1cm-1)处连续监测TrxR/NADPH、MSH/Mtr/NADPH或Lpd/SucB/NADH途径中NADPH或NADH作用的氧化型CgAhp-S2依赖性氧化,反应混合物为300 μL,含有50 mM Tris-HCl缓冲液(pH 7.5),1 mM EDTA,不同浓度的氧化型CgAhp-S2和可能作为电子供体的还原Trx生成系统[5 μM TrxR、40 μM Trx、300 μM NADPH]、MSH系统[5 μM Mtr,500 μM MSH,300 μM NADPH]或Lpd系统[5 μM Lpd,5 μM SucB,300 μM NADH]. 反应均于37 ℃进行. 在于37 ℃温育3 min后的反应混合物中加入氧化型CgAhp-S2开启反应. 以不含CgAhp-S2作为对照.kcat和Km值通过GraphPad Prism 5程序对Michaelis-Menten方程进行非线性拟合获得.
1.7 CgAhp协同Lpd/SucB/NADH电子途径还原过氧化物酶活性测定
参照王建波等人[18]的方法进行活性测定.
1.8 统计分析
统计分析是通过成对的双尾学生t检验确定的. 用GraphPad Prism Software进行统计分析(GraphPad Software,San Diego California USA).
2 结果与讨论
2.1 CgAhp的特性
谷氨酸棒杆菌ncg10877基因位于bp 969458至969940之间,编码由160个氨基酸残基组成的假定Ahp,分子量为18.0 kDa. 如图1所示,NCgl0877蛋白与Achromobacterxylosoxidans、Nitrosococcuswatsonii,Citrobacterfreundii,Simplicispirasuum和CandidatusNitrosoglobus中Ahp的Cys-XX-Cys活性位点氨基酸序列相似性分别为51.3%、53.9%、52.9%、50.0%和52.4%.

图1 CgAhp与其他生物体中Ahp的多序列比对
迄今为止,Ahp蛋白根据功能特征分为2类:二硫化物氧化还原酶包括2-Cys AhpD和1-Cys AhpF,以及巯基过氧化物酶家族的Prx,包括AhpC和AhpE[10,23]. 根据氨基酸序列,进一步发现谷氨酸棒杆菌的NCgl0877与2-Cys AhpD共享一个高度保守的Cys-X-X-Cys(C-X-X-C)催化特征基序,这与具有2个活性半胱氨酸的过氧化物酶不同,例如AhpC这一过氧化物(如图1B). AhpC通过保守的N末端半胱氨酸残基(Cp)分解过氧化物而被氧化. 为了完成催化循环,氧化性Cp会被C端半胱氨酸残基CR还原,导致AhpC形成分子内二硫键[12,24]. 2-Cys AhpD通过Cys-X-X-Cys活性位点的N端和C端Cys将氧化的过氧化物酶恢复为还原态[14]. 因此,推测谷氨酸棒杆菌的NCgl0877可能作为氧化态过氧化物酶的还原酶,而不是充当过氧化物酶.
根据CXXC催化基序,迄今为止报道的谷氨酸棒杆菌过氧化物酶的还原酶可以分为7种:Trx[Cys-Gly-Pro-Cys(C-G-P-C)],Mrx1[Cys-Pro-Tyr-Cys(C-P-Y-C)],AhpD[Cys-Gly-Thr-Cys(C-G-T-C),Cys-Val-Tyr-Cys(C-V-Y-C)],DsbA-like Mrx1[Cys-Pro-Phe-Cys(C-P-F-C)],NrdH[Cys-Val-Gln-Cys(C-V-Q-C)]和Mrx3 [Cys-Gly-Ser-Cys(C-G-S-C)](如图1B). NCgl0877形成了1个新的种类,保留了Cys-Pro-Gly-Cys(C-P-G-C)活性位点. 此外如图1B所示,NCgl0877的CXXC 催化基序中2个半胱氨酸之间的残基与Mrx1(C-P-Y-C)和DsbA-like Mrx1(C-P-F-C)更相似,而与AhpD(C-G-T-C或C-V-Y-C)不同. 以前的研究表明,催化CXXC基序中2个半胱氨酸间插入残基的差异导致二硫键氧化还原酶具有不同的酶促反应速率和底物偏好特性[16]. 因此,新型C-P-G-C活性位点的发现促使研究谷氨酸棒杆菌NCgl0877. 根据其类似于二硫化物氧化还原酶的活性行为,将其命名为CgAhp.
2.2 cgahp的缺失突变体对有机过氧化物胁迫敏感
最近,Si等人发现谷氨酸棒杆菌的cgahp基因是OasR的主要靶点之一,它与谷氨酸棒杆菌的氧化应激反应密切相关[15]. 因此,推测CgAhp也可能在氧化应激中发挥作用. 为了了解CgAhp在氧化应激抗性反应中的生理功能,通过同源重组基因敲除获得的谷氨酸棒杆菌 RES167 菌株中cgahp缺失突变体,并以纸片扩散实验测定其抗ROS的表型. 如图2所示,由带有氧化应激诱导试剂的纸片(φ=5 mm)引起的含有高拷贝数空质粒pXMJ19的谷氨酸棒杆菌RES167亲本菌株(该菌株命名为WT)、Δcgahp(pXMJ19)突变株(缺乏cgahp基因的菌株含有空的pXMJ19)和Δcgahp(pXMJ19-cgahp)(Δcgahp被携带野生型cgahp基因的质粒补充)的抑制区直径(cm). 点图显示了每种试剂的3个样本的平均值和标准误差. 插图显示了正常条件下菌株的生长曲线. 通过在指定时间点测量A600来监测LB中指定菌株的生长.
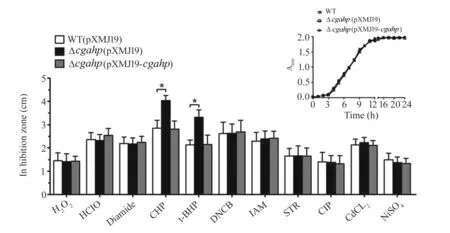
图2 谷氨酸棒杆菌的Δcgahp菌株对有机过氧化物胁迫更敏感
在正常生长条件下CgAhp被认为在谷氨酸棒杆菌RES167中是非必需的,但与WT(pXMJ19)菌株(含有空质粒pXMJ19的野生型谷氨酸棒杆菌菌株)相比,Δcgahp(pXMJ19)菌株(含pXMJ19空质粒且缺失cgahp的突变体)对CHP和t-BHP的耐受性降低,其抑菌圈明显大于WT(pXMJ19)菌株. 为了证实其敏感性是由于缺少cgahp基因造成的,将含有野生型谷氨酸棒杆菌cgahp基因的质粒pXMJ19引入Δcgahp缺失突变体中,构建互补菌株Δcgahp(pXMJ19-cgahp),并进行互补实验. 如图2所示,互补菌株Δcgahp(pXMJ19-cgahp)在CHP和t-BHP下产生明显小的抑菌圈,与WT(pXMJ19)菌株相当,其抗性表型几乎完全在Δcgahp(pXMJ19-cgahp)菌株中恢复. 然而WT(pXMJ19)、Δcgahp(pXMJ19)和Δcgahp(pXMJ19-cgahp)菌株在H2O2、HClO,diamide,CDNB,IAM,STR,CIP,CdCl2和NiSO4胁迫下无显著性差异. 因此,CgAhp参与抗有机过氧化物胁迫的过程.
2.3 氧化型CgAhp优先利用Lpd/SucB/NADH电子途径再生
谷氨酸棒杆菌通过MSH/Mtr/NADPH系统、TrxR/NADPH系统和Lpd/SucB/NADH系统3种普遍存在的电子转移途径来还原氧化还原酶活性位点半胱氨酸之间的二硫键,为了确定可能与氧化CgAhp还原耦联的电子供体途径. 首先用联胺制备CgAhp-S2,其活性位点半胱氨酸之间有单个二硫键(CgAhpox). 再添加CgAhp-S2作为电子转移途经的底物测定稳态动力学.
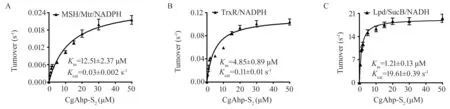
图3 氧化的CgAhp-S2优选通过Lpd/SucB/NADH途径还原
使用GraphPad Prism 5程序,通过Michaelis-Menten稳态动力学评估MSH/Mtr/NADPH(A),TrxR/NADPH(B)或Lpd/SucB/NADH(C)途径对氧化型CgAhp-S2的还原. 数据表示为3个独立实验的平均值±SD表示. 将不同浓度的氧化CgAhp-S2与预培养的反应混合物混合.
如图3所示,CgAhp-S2对于MSH/Mtr/NADPH,TrxR/NADPH或Lpd/SucB/NADH电子供体途径的Km值、Kcat值和催化系数分别为12.51±2.37 μM,0.03±0.002 s-1和(2.39±0.08)×103M-1s-1,4.85±0.89 μM,0.11±0.01 s-1和(2.27±0.13)×104M-1s-1,1.21±0.13 μM,19.61±0.39 s-1和(1.63±0.04)×107M-1s-1. 虽然CgAhp-S2可通过上述3种电子途径被还原,但CgAhp-S2与Lpd/SucB/NADH途径的催化系数比TrxR/NADPH和MSH/Mrt/NADPH途径的催化系数高几个数量级,表明CgAhp-S2更倾向于Lpd/SucB/NADH途径. 因此,CgAhp-S2主要通过Lpd/SucB/NADH还原系统来还原,这与Su等人针对谷氨酸棒杆菌AhpDs报告的结果一致[14].
2.4 CgAhp协同Lpd/SucB/NADH电子途径还原过氧化物酶
为确定CgAhp是否能够再生硫醇依赖性过氧化物酶,在饱和浓度的过氧化物和不同浓度的CgAhp(0~500 μM)下,协同CgAhp/Lpd/SucB/NADH还原系统进行了过氧化物酶活性的测定.
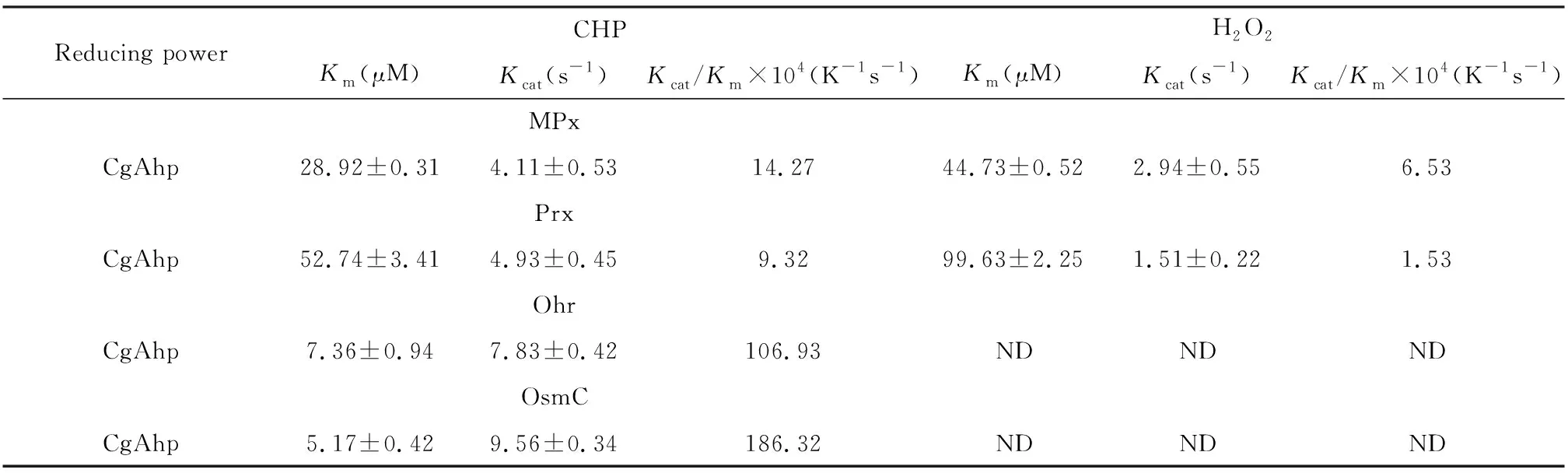
表2 CgAhp具有硫醇依赖性过氧化物酶还原能力
通过CgAhp系统(0~500 μM CgAhp,5 μM Lpd,和5 μM SucB)对过氧化物(500 μM的MPx and Prx,或1 mM的Ohr和OsmC)和过氧化物酶(0.5 μM MPx和Prx,或0.1 μM Ohr和OsmC)进行过氧化物酶测定. 数据为3次独立测定值的平均值,并使用GraphPad Prism 5程序进行非线性回归分析. ND表示在使用的条件下没有可检测到的活性.
如表2所示,MPx协同CgAhp/Lpd/SucB/NADH系统对CHP的Kcat和Km值分别为4.11±0.53 s-1和28.92±0.31 μM. 获得催化效率14.27×104M-1s-1与谷氨酸棒杆菌中AhpD2对MPx(约34.7× 104M-1s-1)的数据相似[14]. 在以CgAhp/Lpd/SucB/NADH体系为电子受体还原Prx、Ohr和OsmC中也观察到类似的结果. CgAhp/Lpd/SucB/NADH系统中Prx、Ohr和OsmC对CHP的催化效率分别为9.3×104M-1s-1,106.9×104M-1s-1和186.3×104M-1s-1. 虽然CgAhp/Lpd/SucB/NADH系统在以H2O2为底物时支持MPx和Prx的过氧化物酶活性,但催化活性相对低. 当H2O2作为底物时,CgAhp/Lpd/SucB/NADH还原系统对Ohr和OsmC活性的促进作用非常差,这与Si等人分别报导的谷氨酸棒杆菌中仅有且主要是用于有机过氧化物解毒的Ohr和OsmC的结果相一致[25,26]. 与谷氨酸棒杆菌AhpD1和AhpD2一样,CgAhp具有更广泛的还原能力[14]. 它不仅能再生有机过氧化物解毒过氧化物酶,还能再生无机过氧化物解毒过氧化物酶. 尽管先前的研究表明Ohr和OsmC可以采用Trx再生系统还原底物CHP(Ohr和OsmC的催化效率分别为10×104M-1s-1和21.2×104M-1s-1),但它们在体外对CgAhp的亲和力高于Trx. 这些数据表明CHP而非H2O2作为底物时,CgAhp/Lpd/SucB/NADH系统更有效地支持Ohr和OsmC的活性. 此外,CgAhp优先支持Ohr和OsmC的活性. 当使用CHP作为底物时,MPx和Prx在CgAhp/Lpd/SucB/NADH体系中的催化效率显著低于谷氨酸棒杆菌MPx和Prx在Trx体系中的催化效率(MPx,58.5×104M-1s-1;Prx,264.1×104M-1s-1)[27,28],比谷氨酸棒杆菌Ohr和OsmC催化CgAhp/Lpd/SucB/NADH体系的反应低约8~20倍. 综上所述,CgAhp优选还原依赖NADH的过氧化物酶Ohr和OsmC;CgAhp具有更广泛的还原能力;CgAhp是一种重要的胞质烷基过氧化氢氧化还原酶,参与过氧化物酶的再生.
3 结 语
在本研究中,通过生理生化分析揭示了一种新的烷基过氧化氢还原酶CgAhp. CgAhp增强了谷氨酸棒杆菌对有机过氧化物胁迫的抗性. CgAhp优先通过耦联Lpd/SucB/NADH电子途径,将各种氧化态过氧化物酶还原. 另外,CgAhp能更有效地支持有机过氧化物清除酶Ohr和OsmC的活性. 因此,CgAhp属于二硫化物氧化还原酶的成员,而不是硫醇特异性抗氧化蛋白过氧化物酶家族的成员. 简而言之,本研究首次证明具有一个新的C-P-G-C活性位点的CgAhp代表了一类类似AhpD的分子,主要通过维持Ohr和OsmC的过氧化物酶活性来实现谷氨酸棒杆菌的抗氧化防御. 同时本研究为其他生物体类似酶的正确分类铺平了道路,并扩大了二硫化物氧化还原酶的类型.
