理筋手法通过PI3K-Akt通路干预兔静力性损伤的机 制 研 究
2022-11-07孙文静马惠昇魏晓歌
孙文静 马惠昇 穆 静 宋 斐 杨 楠 魏晓歌
(1.宁夏医科大学中医学院,宁夏银川750001;2.宁夏少数民族医药现代化教育部重点实验室,宁夏银川750001)
《素问·长刺节论》云:“病在筋,筋挛节痛,不可以行,名曰筋痹”[1],筋伤常表现为肌肉筋骨等软组织挛缩、僵硬和疼痛[2],临床上此病患者常见颈部疼痛明显,形成结节及条索状物,严重者出现头晕、头痛、恶心等交感神经兴奋症状。颈部肌肉长时间紧张收缩,局部缺血缺氧,产生微循环障碍,代谢产物堆积,引起炎症反应及肌肉纤维化改变,日久不愈则形成粘连及条索状物[3]。理筋手法立足于中医经络学说,具有松解肌肉粘连,缓解痉挛,减轻局部炎症反应,促进血液循环的作用[4]。
损伤的骨骼肌修复主要依赖肌卫星细胞(muscle satellite cells,MSCs)的增殖与分化。骨骼肌损伤后,肌纤维坏死伴有炎症因子浸润,处于静息状态的肌卫星细胞被激活[5],此时胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)与成肌分化 抗 原(myogenic differentiation antigen,MyoD)参与调控成肌细胞融合、分化,在肌细胞再生并生长为成熟肌纤维的过程中发挥重要作用[6]。本研究通过观察运用理筋手法干预兔骨骼肌慢性静力性损伤后颈后肌组织磷脂酰肌醇-3激酶(PI3K)-蛋白激酶B(Akt)信号通路相关蛋白以及IGF-1和MyoD表达的变化,探索理筋手法促进骨骼肌修复的相关机制。
1 实验材料
1.1 实验动物 选择6月龄日本大耳白兔38只,体重(2.0±0.6)kg,雌雄各半,实验动物由陕西君行生物科技有限公司提供,许可证号:SCXK(陕)2017-001,饲养于宁夏医科大学实验动物房,常规分笼饲养。室温为15~20 ℃,湿度为50%~60%,12 h/12 h明暗周期,自由饮食饮水。实验过程中对动物的处置符合国家实验动物伦理的相关规定,严格遵守宁夏医科大学实验动物伦理原则。
1.2 主要试剂 苏木素-伊红(HE)染液(珠海贝索生物技术有限公司,批号:BA-4041),二甲苯(国药集团化学试剂有限公司),无水乙醇(天津市永大化学试剂有限公司),分化液(上海碧云天生物技术有限公司,批号:C0163M),DBA显色剂(北京中杉金桥生物技术有限公司,批号:ZLI-9018),RIPA裂解液(北京索莱宝公司,批号:R0020),ECL发光试剂盒(北京中杉金桥生物技术有限公司,批号:sc-2048),PVDF膜(Millipore公司,批号:IPVH00010),山羊抗兔二抗(北京中杉金桥生物技术有限公司,批号:ZB2301),山羊抗鼠二抗(北京中杉金桥生物技术有限公司,批号:ZB2305)。
1.3 主要仪器 包埋机(武汉俊杰电子有限公司),病理切片机(上海徕卡仪器有限公司),光学显微镜系统(日本尼康公司),组织摊片机(浙江金华科迪仪器设备有限公司),低温高速离心机(Eppendorf公司),电泳仪(北京六一公司),转膜仪系统(ATTO公司),酶标仪(芬兰雷勃Multiskan)、移液器(吉尔森公司)。
2 实验方法
2.1 分组 兔适应性饲养1周后,根据随机数字表法选取3只作为空白组,剩余35只制作颈部静力性损伤模型。造模成功后,随机选取5只作为模型组,其余30只随机分为模型对照组15只和手法治疗组15只。
2.2 造模 参照刘志华[7]报道的方法,制作改良颈部模型固定架,建立兔颈部静力性损伤模型。适当调整固定架大小,以不影响兔正常呼吸为度,且四肢活动正常。固定后兔头颈前屈45°,每天持续5 h,连续60d。课题组在前期研究中已证明,采用该法造模后,兔颈后肌肌纤维排列扭曲,结构紊乱甚至断裂溶解,证明此法可以造成兔颈后肌发生慢性静力性肌损伤,但未造成颈椎骨性生理曲度的改变。
2.3 干预方法 课题组前期研究已明确理筋手法最佳刺激量为2 kg。为保证手法力量及频率的标准化,选2名熟悉理筋手法操作要点的干预者,先在SF-Ⅲ型智能推拿手法参数测定仪上进行手法力量、频率等动力学参数训练,待两人手法的动力学参数稳定并且达到标准后,再于兔颈部实施手法。手法治疗组兔均予松筋、拨筋、顺筋3种手法。松筋手法是将大拇指和食指指腹着力于颈椎两侧肌肉,自上而下循环拿揉,频率100次/min,共5min[8];拨筋手法以大拇指指腹着力于一侧颈肩部肌肉,两侧交替反复进行拨动,频率80次/min,共5min;顺筋手法将两手拇食指指腹着力于枕骨粗隆下,自上而下推捋颈部肌肉,频率80次/min,共5min。手法治疗组兔每日予手法干预1次,每次15min,连续干预30d。模型对照组不予任何治疗,造模成功后观察30d。
2.4 取材 造模结束后,将空白组3只与模型组5只兔禁食12 h后采用耳缘静脉空气栓塞法处死;模型对照组分别于观察10d、20d、30d后,随机选取5只兔,禁食12 h后处死;手法治疗组分别于干 预10d、20d、30d后,随 机 选取5只 兔,干 预结束后禁食12 h处死。各组兔处死后各取两块约0.5 cm×0.5 cm×0.5 cm的颈后肌组织放入4%多聚甲醛中固定,48 h后常规脱水、固定、石蜡包埋,以分别进行HE染色及免疫组织化学法(IHC法)检测;另各取一块约50mg的颈后肌组织,迅速放入液氮中冻存,以进行蛋白免疫印迹法(Western blot法)检测。
2.5 观察指标
2.5.1 一般情况 造模结束后,观察造模兔饮食水情况、颈部触觉及行为学变化,并与空白组兔的一般情况进行比较。
2.5.2 组织形态学 将空白组和模型组兔颈后肌组织石蜡包块制作切片(厚度为5 µm),常规脱蜡、脱水后放入苏木素染色液,流水冲洗,盐酸乙醇分化,继续放入伊红溶液染色,流水冲洗,梯度脱水后进行透明及中性树脂封固。分别于100、200倍光镜下观察肌纤维排列走向等组织形态学变化。
2.5.3 IHC法检测颈后肌组织IGF-1与MyoD阳性表达 各组兔颈后肌组织石蜡切片常规脱蜡水化,放入柠檬酸修复液高压修复,加入3%甲醇双氧水20min,水洗后用PBS浸泡1min,5%BSA中孵育30min,滴 加 一 抗IGF-1(1∶100)、MyoD(1∶100)4 ℃过夜,PBS缓冲液洗3次,每次5min,DAB显色后水洗,苏木素复染后脱水、透明及中性树胶封片。显微镜下观察并分析阳性表达的平均光密度值。
2.5.4 Western blot法检测颈后肌组织IGF-1、MyoD、PI3K、Akt蛋白表达 取50mg组织,研磨分装于离心管中,加入250 µL的RIPA裂解液匀浆(使用前5min加入蛋白酶抑制剂),4 ℃过夜裂解,提取蛋白。根据蛋白定量结果,加入蛋白样品及裂解液,轻轻混合后95 ℃变性10min。制备SDS-PAGE凝胶,依次进行蛋白上样、电泳、转膜,将转移膜置于封闭液中,封闭后的膜放入一抗中,4 ℃孵育过夜(β-actin 1∶3000,P-PI3K 1∶800,P-Akt 1∶400,IGF-1 1∶1000,MyoD 1∶500),将反应膜放入平皿中洗膜,放入二抗工作液中孵育90min(山羊抗兔1∶3000、山羊抗鼠1∶3000),显色曝光,胶片扫描后,用Image J软件测定条带灰度值,进行定量分析。
2.6 统计学方法 实验数据用SPSS 26.0统计软件进行分析,所有数据经正态性检验及方差齐性检验后,均符合正态分布且方差齐,结果以(±s)表示,多组间样本比较用单因素方差分析(One-way ANOVA),组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
3 实验结果
3.1 造模兔与空白组兔一般情况比较 兔造模前期与空白组相比,较烦躁,易激惹,不易抓取,造模后期出现精神倦怠、蜷缩少动、饮食饮水减少等表现。触碰造模兔颈部时,表现为精神紧张、易躲闪,颈部肌肉较僵硬,可触及条索状物。
3.2 空白组与模型组兔颈后肌组织形态学比较 如图1所示,细胞核呈蓝色,细胞质呈红色。空白组兔颈后肌组织可见肌纤维排列整齐,细胞核呈卵圆形,形态规则,无组织水肿及炎性浸润;模型组兔颈后肌组织肌纤维扭曲变形,排列紊乱,肌间隙宽窄不一,可见大量炎性物质渗出。结果显示骨骼肌静力性损伤形成,提示造模成功。
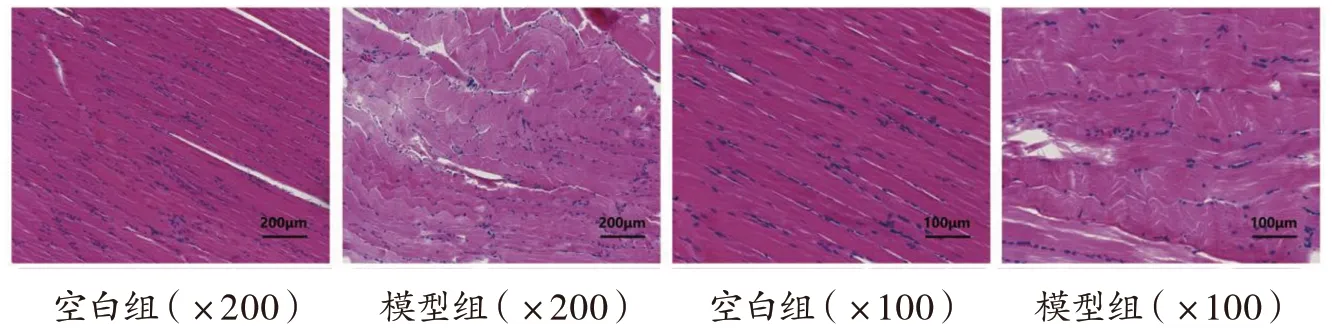
图1 空白组与模型组兔颈后肌组织形态学表现(HE染色)
3.3 IHC法观察各组兔颈后肌组织IGF-1、MyoD表达 如图2、图3所示,细胞核染色为蓝色,IGF-1、MyoD阳性表达为棕黄色。空白组细胞核分布均匀,棕黄色范围较小;模型组棕黄色范围显著增加。模型对照组观察10d时可见肌间隙明显增宽,见染色不均,说明只出现了部分IGF-1、MyoD阳性表达;手法治疗组干预10d时可见肌间隙明显增宽,大范围棕黄色分布,此时IGF-1、MyoD阳性表达较高。模型对照组观察20d时可见局部肌纤维增宽,棕黄色面积较10d前减少,散在分布,着色不均;手法治疗组干预20d时可见肌间隙变小,IGF-1棕黄色分布面积较治疗10d时减少,MyoD棕黄色呈散在分布。模型对照组观察30d时染色部分变少,细胞核分布逐渐均匀,但仍有局部聚集;手法治疗组干预30d时细胞核分布均匀,棕黄色染色基本消失。

图2 各组兔颈后肌组织IGF-1阳性表达(IHC法,×200)

图3 各组兔颈后肌组织MyoD阳性表达(IHC法,×200)
如表1所示,与空白组比较,模型组兔颈后肌组织IGF-1与MyoD表达量均显著升高(P<0.05);与模型对照组同一观察时点比较,手法治疗组干预10d、20d时IGF-1表达量均显著升高(P<0.05),干预10d时MyoD表达量显著升高(P<0.05);随着观察/干预时间的延长,模型对照组和手法治疗组IGF-1和MyoD表达量均逐渐降低,均以观察/干预10d时表达量最高。
表1 各组兔颈后肌组织IGF-1、MyoD表达比较(±s,IHC法)
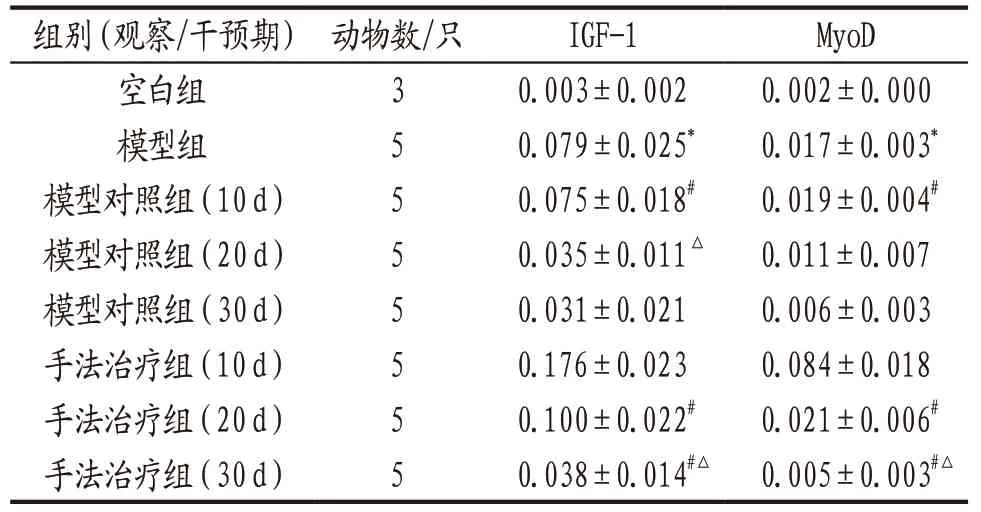
表1 各组兔颈后肌组织IGF-1、MyoD表达比较(±s,IHC法)
注: 与空白组比较,*P<0.05;与手法治疗组(10 d)比较,#P<0.05;与手法治疗组(20 d)比较,△P<0.05。
组别(观察/干预期)动物数/只 IGF-1 MyoD空白组 3 0.003±0.002 0.002±0.000模型组 5 0.079±0.025* 0.017±0.003*模型对照组(10d) 5 0.075±0.018# 0.019±0.004#模型对照组(20d) 5 0.035±0.011△ 0.011±0.007模型对照组(30d) 5 0.031±0.021 0.006±0.003手法治疗组(10d) 5 0.176±0.023 0.084±0.018手法治疗组(20d) 5 0.100±0.022# 0.021±0.006#手法治疗组(30d) 5 0.038±0.014#△0.005±0.003#△
3.4 Western blot法观察各组兔颈后肌组织IGF-1、MyoD、P-PI3K、P-Akt蛋白表达 结果见表2、图4。模型组兔颈后肌组织IGF-1、MyoD、P-PI3K、P-Akt蛋白表达量均显著高于空白组(P<0.05);手法治疗组干预10d、20d时IGF-1、MyoD蛋白表达量均显著高于同时期模型对照组(P<0.05),手法治疗组干预30d时IGF-1、MyoD蛋白表达量显著低于同时期模型对照组(P<0.05);手法治疗组干预10d、20d、30d时P-PI3K、P-Akt蛋白表达量均显著高于同时期模型对照组(P<0.05)。
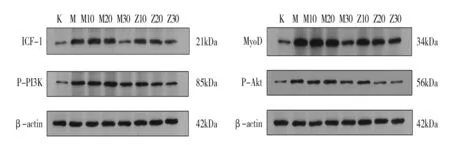
图4 Western blot法检测各组兔颈后肌组织IGF-1、MyoD、P-PI3K、P-Akt蛋白表达量
表2 各组兔颈后肌组织IGF-1、MyoD、P-PI3K、P-Akt蛋白表达比较(±s,Western blot法)
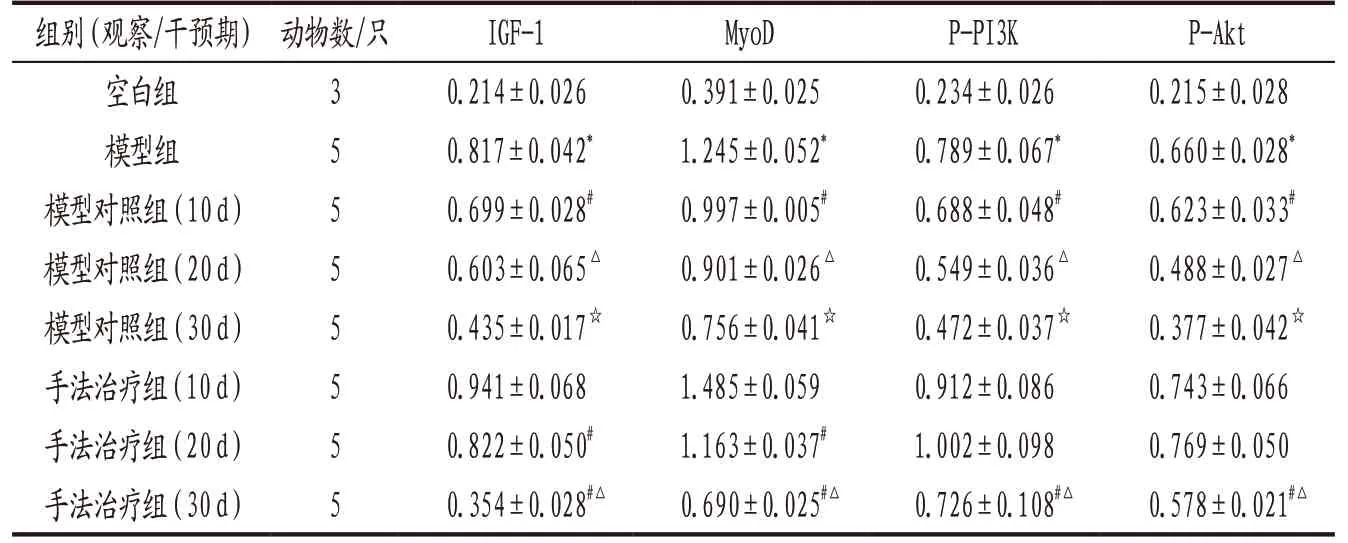
表2 各组兔颈后肌组织IGF-1、MyoD、P-PI3K、P-Akt蛋白表达比较(±s,Western blot法)
注: 与空白组比较,*P<0.05;与手法治疗组(10 d)比较,#P<0.05;与手法治疗组(20 d)比较,△P<0.05;与手法治疗组(30 d)比较,☆P<0.05。
组别(观察/干预期)动物数/只 IGF-1 MyoD P-PI3K P-Akt空白组 3 0.214±0.026 0.391±0.025 0.234±0.026 0.215±0.028模型组 5 0.817±0.042* 1.245±0.052* 0.789±0.067* 0.660±0.028*模型对照组(10d) 5 0.699±0.028# 0.997±0.005# 0.688±0.048# 0.623±0.033#模型对照组(20d) 5 0.603±0.065△ 0.901±0.026△ 0.549±0.036△ 0.488±0.027△模型对照组(30d) 5 0.435±0.017☆ 0.756±0.041☆ 0.472±0.037☆ 0.377±0.042☆手法治疗组(10d) 5 0.941±0.068 1.485±0.059 0.912±0.086 0.743±0.066手法治疗组(20d) 5 0.822±0.050# 1.163±0.037# 1.002±0.098 0.769±0.050手法治疗组(30d) 5 0.354±0.028#△ 0.690±0.025#△ 0.726±0.108#△ 0.578±0.021#△
随着观察/干预时间的延长,模型对照组和手法治疗组IGF-1和MyoD蛋白表达量均逐渐降低,均以观察/干预10d时表达量最高。随着观察/干预时间的延长,模型对照组P-PI3K、P-Akt蛋白表达量逐渐降低,而手法治疗组P-PI3K、P-Akt蛋白表达量呈现先增高后降低的趋势。
4 讨论
《灵枢·刺节真邪》中提道:“一经上实下虚而不通者,此必有横络盛加于大经,令之不通,视而泻之,此所谓解结也。”[9]此处“横络”可理解为经筋走行上出现的局部条索状的肌索及结节,“解结”则是针对“横络”的治疗方法,即松解“横络”对经脉、关节的卡压[10]。我们临床通过松解肌筋、理筋止痛、正骨顺筋的方式,治疗颈部筋伤疾病,获得了较好的疗效。课题组前期研究发现,理筋手法中常用的松法、拨法、顺法三种手法,广泛应用于临床且疗效显著[11],故设计本研究以探讨理筋手法治疗静力性损伤的作用机制。
本研究通过建立兔颈部前屈静力性损伤模型,观察理筋手法对颈后肌PI3K-Akt信号通路相关因子表达以及IGF-1、MyoD蛋白表达的影响。骨骼肌损伤后,炎性细胞浸润增多,处于静息状态的肌卫星细胞在生长因子和其他信号蛋白的作用下开始活化,迁移到损伤部位进行增殖,分化的肌卫星细胞形成新生肌管,与原有肌纤维融合或形成新的肌纤维,修复受损骨骼肌[12-14]。
IGF-1是一种蛋白多肽,可以促进蛋白质的合成,有效刺激肌卫星细胞的增殖,增加细胞核数量,刺激肌纤维分化成熟[15]。骨骼肌损伤后在肌卫星细胞的不同阶段,肌卫星细胞、成肌细胞和肌管都会分泌IGF-1,IGF-1对肌卫星细胞的增殖具有促进作用[16]。骨骼肌损伤后IGF-1合成和分泌增加,在细胞表面结合受体IGF-1R[17],受体构象发生改变,激活酪氨酸活性和自身磷酸化,作用于胰岛素受体 底 物-1(IRS-1)[18]。IRS-1通过其结构域与受体结合后被磷酸化,激活PI3K,从而导致质膜内磷脂的生成,使Akt磷酸化,致mTOR和p70S6激酶(p70S6K)的激活[19]。该通路的激活提高下游基因的转录水平,导致蛋白质合成增加,刺激肌卫星细胞增殖,促进肌细胞分化,恢复肌细胞增殖与凋亡的平衡状态,加速骨骼肌修复[20]。MRFs基因家族的四种转录基因相互作用调控,共同促进肌细胞的生成,调控肌肉组织的生长发育[19]。成肌调节因子之一的MyoD主要在活化的肌卫星细胞中表达,使未分化和已分化的细胞转化为成肌细胞,促进肌细胞融合形成肌管,是肌卫星细胞激活和增殖的标志[21]。细胞转录抑制因子抑制素2(PHB2)能抑制MyoD所依赖的基因转录,从而降低肌分化,Akt能抑制MyoD与PHB2的结合,这可能是Akt介导MyoD激活和促进肌分化的机制之一[22]。
本研究结果显示,骨骼肌损伤形成后,局部肌肉中IGF-1和MyoD蛋白表达量较空白组明显升高(P<0.05),说明此时肌卫星细胞开始激活。手法治疗组各观察时点兔颈后肌组织P-PI3K、P-Akt表达量均显著高于同时期模型对照组(P<0.05),说明理筋手法作用于PI3K-Akt信号通路。手法治疗组干预10d时颈后肌组织IGF-1和MyoD蛋白表达量达到最高(P<0.05),可能肌卫星细胞此时高度增殖。随后,IGF-1通过级联反应向PI3K-Akt信号通路传导刺激信号,所以手法治疗组干预10d、20d时颈后肌组织P-PI3K、P-Akt表达量显著高于干预30d时(P<0.05),但干预10d、20d两个时点上述指标比较差异无统计学意义(P>0.05),说明手法干预10d、20d时,颈后肌组织P-PI3K、P-Akt表达量显著升高,促进肌蛋白合成。手法治疗组干预20d时颈后肌组织IGF-1和MyoD蛋白表达量较干预10d时明显降低(P<0.05),且免疫组织化学法检测可见阳性细胞核已转至新生细胞核附近表达,说明此时肌卫星细胞由增殖开始进入分化阶段,形成新生肌管,融合成肌纤维,促进骨骼肌的修复。手法治疗组各观察时点比较发现,干预30d时颈后肌组织MyoD阳性表达最低,说明此时肌卫星细胞基本分化成熟,重新回到静息状态,骨骼肌修复及重塑已基本完成。
综上,理筋手法可通过调控MyoD的表达量,加快激活肌卫星细胞增殖分化出成肌细胞,同时介导IGF-1激活PI3K-Akt信号通路,促进损伤部位成肌细胞进一步分化融合,向损伤部位迁移,形成新的肌管修复肌组织损伤。骨骼肌损伤与修复的作用机制较为复杂,涉及多个信号通路,且相互之间交叉影响,因此后期还需进一步深入探索理筋手法对Wnt信号通路、FOXO3信号通路等的影响,以及研究肌细胞骨架蛋白相关机制等,为临床治疗提供基础理论指导。
