Y编码样睾丸特异性蛋白5在心肌缺血再灌注损伤中的保护作用
2022-11-06范怡伦吴佳伟丁丹黄一航薛松黄日太
范怡伦 吴佳伟 丁丹 黄一航 薛松 黄日太
心肌缺血再灌注损伤的发生涉及多种机制,如氧自由基的产生、钙离子超载、炎性反应等[1-4]。如何减轻缺血再灌注引起的心肌损伤,仍是心血管临床医生面临的难题。
Y 编码样睾丸特异性蛋白5 基因(TSPYL5)位于染色体8q22 位点,是1 种与乳腺癌预后不良有关的独立标记物[5-6]。有研究显示TSPYL5 可以刺激多种细胞增殖[7],参与细胞生长调节关键物p53 的负向调控[6],如通过抑制p53 促进内皮细胞的增殖和功能[8]。本研究探究在心肌缺血再灌注损伤中,TSPYL5 能否通过抑制p53 信号通路,减少心肌细胞凋亡,从而起到保护心肌的作用。
1 材料与方法
1.1 材料
本实验所用主要试剂与仪器有H9c2 心肌细胞株(上海中国科学院细胞库);抗TSPYL5、GAPDH、p53、Bcl-2、caspase-3 抗体(ABclonal);TUNEL 细胞凋亡检测试剂盒(碧云天);聚合酶链反应(PCR)扩增试剂盒(TaKaRa);Lipofectamine 3000 转染试剂(Invitrogen);BCA试剂盒(碧云天)等。
1.2 H9c2心肌细胞培养与分组
将H9c2 心肌细胞培养于DMEM 培养基中。将细胞随机分组:对照组按照常规方式培养细胞;缺氧复氧组将常规培养基换为无血清培养基,置于含1%O2、95%N2的缺氧培养箱中培养12 h,再将细胞放回37 ℃、5%CO2培养箱中培养6 h。
1.3 TSPYL5过表达体系的构建
将H9c2 细胞接种在6 孔板中培养24 h。将2.1 μg TSPYL5 过表达质粒与5 μL 的P3000 溶于100 μL 无血清无抗生素的培养基中混匀;再将5 μL Lipofectamine 3000 溶于100 μL 无血清无抗生素的培养基中混匀,静置15 min;将上述两者轻柔混匀后,加入换有新鲜正常培养基的培养孔。继续培养48 h 后,过表达体系构建完成。
1.4 小鼠心脏缺血再灌注模型的构建
给予6~8 周雄性C57BL/6 小鼠腹腔注射1.2%异氟烷进行麻醉,气管插管后于小鼠胸骨左侧3、4肋间剪开皮肤,打开胸腔,用手术缝线对侧牵拉肋骨使心脏暴露。剪开心包,找出左心耳下缘的红色血管即左前降支,打1 活结进行结扎,暂时关闭胸腔。30 min 及2 h 后再次开胸,打开活结,看到心壁苍白区域再次变红,即为再灌注成功。
1.5 TUNEL染色检测细胞凋亡
将细胞种入底部放有玻片的12 孔板,经缺氧复氧处理后使用多聚甲醛固定30 min,使用PBS 洗涤后根据凋亡试剂盒说明书进行操作。直接置于光学显微镜下观察。
1.6 Western blot检测蛋白水平
细胞蛋白经RIPA 裂解提取后,使用BCA 定量法测定蛋白浓度。使用10%的SDS-PAGE 凝胶电泳分离出分子量大小不同的蛋白,将其转移至PVDF 膜上,使用快速封闭液将膜封闭后,一抗孵育过夜。TBST 洗膜后常温避光孵育二抗2 h,洗膜后使用Odyssey Clx 扫膜。
1.7 统计学分析
使用Graphpad Prism 9 软件进行统计学分析与作图,实验数据采用均数±标准差表示,其中非配对t检验用于进行2 组样本间的比较。以P<0.05为差异有统计学意义。
2 结果
2.1 缺血再灌注后小鼠心肌TSPYL 5表达下调
为探究动物模型中TSPYL 5 的表达水平是否与缺血再灌注损伤有关,实验设立了对照组、缺血0.5 h 组、再灌注0.5 h 组与再灌注2 h 组,进行蛋白表达水平检测。与对照组相比,缺血再灌注0.5 h和2 h 后小鼠心肌组织TSPYL5 的蛋白表达水平明显下降。再灌注2h 的小鼠TSPYL5 的蛋白表达水平下降最显著(P均<0.05)。见表1。

表1 小鼠心肌细胞缺血再灌注后的蛋白表达水平
2.2 缺氧/复氧后H9c2细胞凋亡显著增加
与对照组相比,缺氧/复氧后细胞TSPYL 5 的表达水平显著下降,与此同时,p53、caspase-3 的蛋白表达水平显著上调,促凋亡蛋白Bcl-2 的表达显著下调(P均<0.05),提示细胞在缺氧/复氧后发生凋亡,见表2。

表2 H9C2细胞中TSPYL 5与凋亡通路蛋白表达水平
2.3 TSPYL5过表达逆转了缺氧/复氧后的细胞凋亡
在H9c2 细胞中建立TSPYL5过表达体系,p53 与caspase-3 的蛋白表达水平显著下调,Bcl-2的蛋白表达水平显著上调(P均<0.05),提示在过表达TSPYL5后细胞凋亡被明显抑制。见图1、表3。

表3 过表达TSPYL5后凋亡通路蛋白表达水平

图1 TSPYL5过表达的构建
在转入质粒后,与对照组相比,TSPYL5的高表达显著抑制了缺氧/复氧后细胞的凋亡水平,见图2。
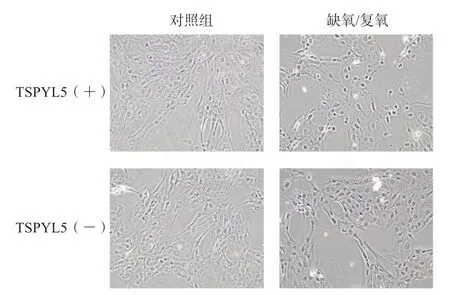
图2 缺氧/复氧后Tunel染色结果(×25)
3 讨论
TSPYL5 在细胞中广泛表达,既往研究表明其可以促进多种肿瘤细胞的增殖[7],也可以通过与泛素特异性蛋白酶7(USP7)结合的方式对p53 通路产生抑制作用[6],通过这种作用可以促进内皮细胞的增殖和功能[8]。然而,TSPYL5 蛋白能否通过抑制p53 通路在心肌缺血再灌注损伤中产生保护作用,还尚未有报道。
首先,本研究发现在小鼠缺血再灌注模型中TSPYL 5 的表达水平均有下调,其中再灌注2 h 组下调最显著。在后续的体外实验中,这样的差异也同样被验证。这说明TSPYL 5 的表达水平与心肌缺血再灌注存在一定的联系。
p53 是肿瘤抑制蛋白,在细胞面临缺氧/缺血压力时,它是细胞周期与凋亡的关键调节物[9-10]。本研究检测到p53 凋亡信号通路蛋白即Bcl-2、caspase-3、p53 表达水平的变化,证实了H9c2 细胞在缺氧/复氧模型中发生了显著凋亡。
已有研究表明,抑制p53 介导的凋亡信号通路可以显著地减少缺血再灌注导致的心肌损伤[11-12]。而且TSPYL5 已被证明可以通过与USP7 相互作用抑制p53,从而消除p53 介导的凋亡效应[6],比如促进内皮细胞的增殖[8]等。本研究已经验证TSPYL5 在缺氧/复氧后表达水平会发生下调,由此进一步探究在水平心肌细胞缺氧/复氧模型中,高表达TSPYL5是否能通过抑制p53 信号通路对细胞产生保护作用。TSPYL5过表达细胞体系被成功构建之后,结合蛋白表达水平与Tunel 染色结果提示,过表达TSPYL5通过抑制p53 信号通路逆转了心肌细胞缺氧/复氧后的凋亡水平。
以上研究结果表明,TSPYL 5 在心肌缺血再灌注后表达下调,通过抑制p53 信号通路的方式,发挥心肌细胞保护作用。本研究仅在体外验证了TSPYL5 对心肌细胞的保护作用,尚未进行体内实验。TSPYL5 能否在小鼠缺血再灌注模型中实现对心肌的保护作用,以及在未来如何将TSPYL5 作为潜在靶点,从而减轻心肌缺血再灌注损伤,需要后续深入研究。
