敲低miR-34c-5p抑制低氧诱导的大鼠骨髓间充质干细胞的凋亡
2022-11-06李幸幸徐忠诚
董 扬,张 芬,李幸幸,吴 杰,徐忠诚
(金华市人民医院 心内二科, 浙江 金华 321099)
间充质干细胞(mesenchymal stem cells,MSCs)具有临床获取容易、增殖迅速和基因修饰简便等优点,是组织工程的理想种子细胞。因此,MSCs移植在临床治疗方面具有广阔的应用前景[1]。但是,MSCs移植后,其存活率较低,已成为当前临床应用的最大障碍。有研究表明,移植环境中局部组织低氧环境是造成MSCs生存率低的主要原因之一[2]。
微RNA(microRNA,miRNA)是一类非编码短链RNA,可与靶基因 mRNA的3′非翻译区(3′-UTR)互补结合,抑制其翻译,调控细胞增殖、分化、迁移和凋亡[3]。研究显示miR-34c过表达可导致细胞凋亡和细胞周期停滞[4]。miR-34c-5p作为miR-34c家族的重要一员,对细胞的凋亡也具有重要的调控作用[5]。但鲜有关于miR-34c-5p在低氧条件下对细胞凋亡作用的研究。
本文通过构建miR-34c-5p敲低的大鼠骨髓MSCs(bone marrow derived MSCs, BM-MSCs)系,建立低氧诱导模型,探究敲低miR-34c-5p对低氧诱导的BM-MSCs凋亡的作用。为进一步的实验研究提供实验依据。
1 材料与方法
1.1 材料
6周龄雄性清洁级SD大鼠30只,体质量180~220 g(武汉大学中国典型培养物保藏中心,动物许可证:20170005024712),实验过程中对动物的处置符合动物伦理学标准。DMEM培养基、胎牛血清、ELISA kit、TRIzol reagent、RT-qPCR kit、DAPI和LipofectamineTM2000(Invitrogen公司);Caspase-3和caspase-9抗体、Bcl-2和Bax兔单抗抗体、HRP标记羊抗兔IgG二抗、RIPA裂解液、BCA蛋白浓度测定试剂盒、极超敏ECL化学发光试剂盒、TUNEL凋亡检测试剂盒(上海碧云天生物技术有限公司);ADP/ATP rate分析试剂盒(Abnova公司);荧光标记的2-脱氧葡萄糖类似物:2-deoxy-2-[(7-nitro-2,1,3-benzoxadiazol-4-yl) amino]-D-glucose,2-NBDG(Amgicam公司)。
1.2 方法
1.2.1 MSCs的分离、培养及转染:按以往建立的方法分离和培养大鼠BM-MSCs[6],分离后进行传代培养,取第3代以后的BM-MSCs 进行相关实验。
敲低miR-34c-5p转染BM-MSCs按照已建立的方法进行[7]。
1.2.2 细胞的处理及分组:BM-MSCs低氧诱导模型参照已有方法进行构建[8]。建模后,将MSCs分为常氧组(normoxia组)、低氧组(hypoxia组)、常氧抑制剂阴性对照组(normoxia inhibitor NC组)、低氧抑制剂阴性对照组(hypoxia inhibitor NC组)、常氧miR抑制剂组(normoxia miR inhibitor组)和低氧miR抑制剂组(hypoxia inhibitor miR组)。
1.2.3 RT-qPCR检测miR-34c-5p mRNA相对表达:Trizol试剂裂解细胞提取总RNA,然后反转录为cDNA,稀释10倍后按20 μL反应体系扩增。反应条件: 95 ℃预变性25 s;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸40 s,40个循环;72 ℃再延伸10 min。以GAPDH为内参,用2-△△Ct计算目的基因相对表达量。
1.2.4 流式细胞测量术检测细胞凋亡率:对数期细胞接种于6孔板上,培养48 h后,根据annexin V-APC/7-AAD试剂盒说明书,采用FACS Calibur流式细胞仪检测细胞凋亡率。
1.2.5 TUNEL法检测细胞凋亡:4%多聚甲醛固定细胞45 min,PBS洗涤3次,加入TUNEL检测液,37℃避光孵育1 h。PBS洗涤细胞3次,滴加DAPI避光孵育5 min。PBS洗涤细胞5 min,共3次。最后在荧光显微镜下观察并采集图像。
1.2.6 Western blot检测调亡相关蛋白质:RIPA裂解液提取细胞总蛋白质,BCA蛋白质检测试剂盒测定总蛋白含量。蛋白质样品进行SDS/PAGE。然后将样品转移到PVDF膜上。加入5%脱脂奶粉封闭缓冲液孵育1 h。添加兔抗cleaved caspase-3(1∶1 000稀释)、cleaved caspase-9(1∶1 000稀释)、Bcl-2(1∶1 000稀释)、Bax(1∶1 000稀释)和 β-actin(1∶500稀释)单克隆抗体(一抗),4 ℃孵育过夜。加入HRP标记的二抗(1∶1 500稀释)室温下孵育1.5 h。显影,对蛋白质表达水平进行分析。β-actin作为内参。
1.2.7 RT-qPCR检测IGF、HGF、bFGF和VEGF mRNA相对表达:培养细胞48 h,Trizol试剂裂解细胞提取总RNA,反转录为cDNA,稀释10倍后按20 μL反应体系扩增。反应条件: 95 ℃预变性5 min;95 ℃变性1 min,58.5 ℃退火1 min,72 ℃延伸1 min,30个循环; 72 ℃再延伸10 min。以GAPDH为内参,用2-△△Ct计算目的基因相对表达量。
1.2.8 ELISA检测IGF、HGF、bFGF、VEGF的分泌量:培养细胞48 h,根据相应的ELISA试剂盒操作说明书检测IGF、HGF、bFGF和VEGF的分泌量。
1.2.9 生化试剂盒检测ATP/ADP:根据ADP/ATP ratio分析试剂盒操作说明书,分别测量ADP和ATP发光值,计算ATP/ADP的比值。
1.2.10 流式细胞测量术检测细胞摄取葡萄糖能力:细胞与100 μmol/L 2-NBDG混合[9],37 ℃培孵育30 min。克雷布斯林格缓冲液(Krebs Ringer buffer,KRB)洗3次,0.25% 胰蛋白酶消化,收集每组细胞,使用流式细胞仪检测细胞内平均荧光强度,并记录实验数据。
1.3 统计学分析
2 结果
2.1 miR-34c-5p在低氧诱导后MSCs内的表达情况
Hypoxia 组中miR-34c-5p表达水平为2.241±0.238,明显高于Normoxia组的1.000±0.519。
2.2 敲低miR-34c-5p对细胞凋亡的影响
Hypoxia inhibitor NC组细胞凋亡率显著高于normoxia inhibitor NC或normoxia miR inhibitor组(P<0.01)。与hypoxia inhibitor NC组相比,miR inhibitor可明显降低细胞凋亡率(P<0.01)(图1A)。TUNEL结果和流式细胞结果一致,红色荧光代表凋亡细胞,蓝色荧光代表活细胞(图1B)。Hypoxia inhibitor NC组cleaved caspase-3,-9和Bax蛋白表达量明显高于normoxia inhibitor/miR NC组。Hypoxia miR inhibitor组的cleaved caspase-3,-9和Bax的蛋白表达量明显低于hypoxia inhibitor NC组(P<0.01)。而Bcl-2蛋白表达量的变化与此相反,差异显著(P<0.01)(图1C)。
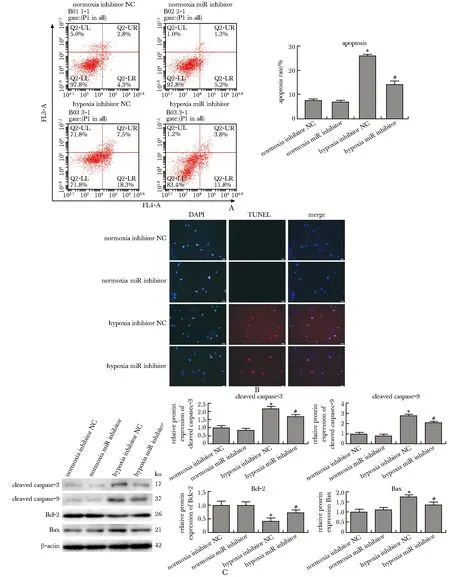
A.apoptosis was detected by flow cytometry; B.cell apoptosis was detected by TUNEL(×200); C.expression levels of cleaved-caspase-3,9, Bcl-2 and Bax by Western blot; *P<0.01 compared with normoxia inhibitor NC/miR inhibitor group; #P<0.01 compared with hypoxia inhibitor NC group
2.3 敲低miR-34c-5p对低氧诱导后MSCs 内IGF、HGF、bFGF和VEGF表达的影响
Hypoxia inhibitor NC组IGF、HGF、bFGF和VEGF表达水平明显低于normoxia inhibitor NC或normoxia miR inhibitor(P<0.01)。与hypoxia inhibitor NC组比较,miR inhibitor可显著提高IGF、HGF、bFGF和VEGF表达水平(P<0.05,P<0.01)(图2A,B)。

A.relative expression of VEGF, bFGF, HGF and IGF by RT-qPCR; B.expression of VEGF, bFGF, HGF and IGF by ELISA; *P<0.01 compared with normoxia inhibitor NC/miR inhibitor group; #P<0.05, ##P<0.01 compared with hypoxia inhibitor NC group
2.4 敲低miR-34c-5p对低氧诱导后MSCs能量代谢的影响
Hypoxia inhibitor NC组ATP/ADP比率和葡萄糖的摄取率均明显低于normoxia inhibitor NC或normoxia miR inhibitor组(P<0.01)。与hypoxia inhibitor NC组比较,miR inhibitor可显著提高ATP/ADP比率和葡萄糖的摄取率(P<0.05,P<0.01)(图3A,B)。
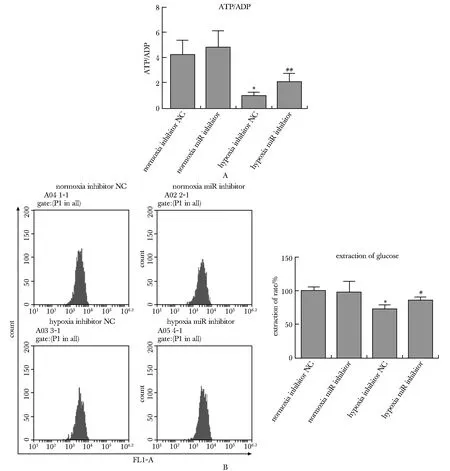
A.effect of miR-34c-5p knockdown on ATP/ADP; B.extraction of glucose by flow cytometry; *P<0.01 compared with normoxia inhibitor NC/miR inhibitor group; #P<0.05, ##P<0.01 compared with hypoxia inhibitor NC group
3 讨论
MSCs移植到体内,所处生存环境因损伤导致氧浓度变低,这种低氧环境极大的影响 MSCs存活率,这也是决定移植治疗效果的重要因素[10]。因此,通过改变移植细胞自身抗凋亡能力以提高存活率成为了重点研究方向。miR-34c-5p作为miR-34c家族的重要一员,对细胞的凋亡具有重要的调控作用。但鲜有关于miR-34c-5p在细胞凋亡中作用的研究。本研究发现miR-34c-5p可促进低氧诱导后BM-MSCs凋亡。
细胞凋亡是受基因严格控制的细胞程序性死亡表现,受多种信号通路和基因调控。Caspase信号级联通路是细胞凋亡的主要介导途径,其中caspase-3,-9是促凋亡调节基因,激活后可诱导多种细胞凋亡[11]。Bcl-2基因家族与细胞凋亡密切相关,根据功能和结构分为两类,一类是起抗凋亡作用的基因,如Bcl-2。另一类是具有促凋亡作用的基因,如Bax。本研究证实敲低miR-34c-5p可明显降低低氧诱导后BM-MSCs的凋亡率,显著下调cleaved caspase-3,-9和Bax蛋白的表达,同时明显上调Bcl-2的表达。此结果与相关研究结果类似[12]。
有研究表明,通过基因修饰而促进 MSCs在低氧环境下存活的机制,主要是通过Akt通路和VEGF等达到。而Akt通路的激活与IGF、HGF、bFGF和VEGF密切相关[13]。本研究结果表明,敲低miR-34c-5p可显著上调低氧诱导后BM-MSCs内IGF、HGF、bFGF和VEGF分泌量,说明敲低miR-34c-5p可能通过提高IGF、HGF、bFGF和VEGF表达量激活Akt通路,进而增强MSCs在低氧环境下的存活能力。
葡萄糖摄取充足时,MSCs可通过糖酵解途径维持其在低氧环境中的存活[14],因此,MSCs可存活较长时间。本研究证实敲低miR-34c-5p可显著提高ATP/ADP比率和葡萄糖摄取率。miR-34c-5p敲低可以提高低氧诱导后BM-MSCs中能量代谢水平,进而提高存活率。
本研究只是在体外初步探索了miR-34c-5p在低氧诱导的BM-MSCs凋亡中的调控作用,其在体内是否具有相应的作用还需进一步深入探究。希冀为早日实现临床上高效移植MSCs提供新的线索及研究思路。
