味精生产中有机酸含量的抑制型离子色谱测定及焦谷氨酸产生原因分析
2022-11-05林樟楠
王 睿,王 倩,赵 轩,林樟楠,丛 威*
(1.中国科学院 过程工程研究所 生化工程国家重点实验室,北京 100190;2.中国科学院大学 化学工程学院,北京 100049;3.北京电子科技职业学院 生物工程学院,北京 100176)
味精生产主要包括谷氨酸发酵、谷氨酸提取和味精精制三个部分。在谷氨酸发酵过程中,谷氨酸的生物合成包括酵解途径(embden-meyerhof-parnas,EMP)、磷酸己糖途径(hexose monophosphate pathway,HMP)、三羧酸(tricarboxylic acid,TCA)循环、乙醛酸循环、Wood-Werkman反应(CO2固定反应等)[1]。在微生物生长和谷氨酸的生物合成过程中有机酸随之产生,有机酸的浓度变化反映工业菌株产生代谢情况,对于研究谷氨酸发酵代谢具有重要意义。同时,过高的有机酸浓度可能会降低谷氨酸提取后晶体的纯度。此外,味精生产过程中,由于浓缩、结晶等操作使料液长时间处于高温缺水条件,导致谷氨酸脱水环化成焦谷氨酸[2-4]。焦谷氨酸的产生不仅使谷氨酸收率降低,而且影响谷氨酸的结晶性能,影响味精的品质[5-6]。因此,建立味精生产中快速准确的有机酸检测方法是必要的。
目前,同时检测发酵液中多种有机酸有很多文献报道,包括液相色谱(liquid chromatography,LC)法[7-12]、毛细管电泳(capillary electrophoresis,CE)法[13]和离子色谱(ion chromatography,IC)法[14-16]。高效液相色谱(high performance liquid chromatography,HPLC)法具有简单、便捷、快速等优点,刘志成等[9]采用HPLC法同时测量谷氨酸发酵液中的谷氨酸、丙酮酸、α-酮戊二酸、乳酸、柠檬酸和琥珀酸,避免了谷氨酸的衍生处理。但实际生产中谷氨酸发酵液的谷氨酸含量远大于其他有机酸,制备样品时稀释倍数大导致有机酸测量不准确。此外,HPLC法还存在谷氨酸和谷氨酰胺与焦谷氨酸难分离的问题[17-18]。
离子色谱法近年来因其独特的分离原理和高灵敏度、高选择性而得到广泛应用[19]。离子色谱实现离子分离的依据是待测离子与分离柱功能基团的亲和力差异。进样后,待测离子首先被吸附在分离柱的功能基团上,再与淋洗液中具有相同电荷的离子进行可逆交换后洗脱。在某一淋洗液和操作条件下,不同待测离子的保留时间不同,在电导检测器上的电导响应值也不同,可通过标准曲线法计算待测离子含量。淋洗液的组成和浓度、柱温和流速等条件均会影响待测离子的分离性能。离子色谱法根据淋洗液条件下待检测离子所带电荷种类不同,可分为阳离子色谱和阴离子色谱。常规阴离子交换柱可检测Cl-、NO3-、F-、SO42-等无机阴离子,目前文献中多采用常规阴离子交换柱同时检测多种有机酸,主要应用于食醋、酱油、果汁、白酒等食品的检测。在实际味精生产中,硫酸的加入导致谷氨酸提取后料液中存在大量SO42-,同时料液中存在大量氨基酸,对阴离子交换柱检测有机酸均产生影响。离子色谱的有机酸柱是一种特殊的阴离子交换柱,相比于常规阴离子交换柱在弱酸分离上更具优势,且不易受阴离子或氨基酸离子的影响[20-22]。
本研究采用离子色谱有机酸柱建立味精生产中同时检测柠檬酸、酒石酸、丙二酸、苹果酸、琥珀酸、乳酸、富马酸、甲酸、乙酸和焦谷氨酸的方法,并且对味精生产各工段有机酸种类和含量进行跟踪测定,进一步就味精生产中焦谷氨酸的产生原因进行初步探讨,以期为味精生产过程有机酸的监控和产品质量评价提供实用性的手段。
1 材料与方法
1.1 材料与试剂
味精生产各工段料液样品:由某味精生产企业提供。
柠檬酸、L-苹果酸、乳酸、琥珀酸(均为分析纯):国药集团化学试剂有限公司;丙二酸、酒石酸(均为分析纯)、乙酸(色谱纯):西陇化工股份有限公司;富马酸、甲酸、焦谷氨酸(均为分析纯):阿拉丁控股集团有限公司;乙腈(色谱纯):赛默飞世尔科技(中国)有限公司。采用的高纯水电阻率为18.2 MΩ·cm。
1.2 仪器与设备
940ProfessionalICVario离子色谱仪(配有电导检测器、化学抑制器、二氧化碳抑制器、低脉冲串联式双活塞往复泵和MagICNet3.2色谱数据处理软件)、MetrosepOrganicacids-250/7.8分析柱、Metrosep Organic Acids Guard/4.6保护柱:瑞士万通中国有限公司;SQP电子天平:赛多利斯科学仪器有限公司;Spring-R3O纯水机:厦门锐思捷水纯化技术有限公司。
1.3 方法
1.3.1 样品预处理及标准溶液配制
称取柠檬酸、酒石酸、丙二酸、苹果酸、琥珀酸、富马酸和焦谷氨酸的标准品和用酸碱滴定法标定准确浓度的乳酸、甲酸和乙酸的标准品,用高纯水配制成各有机酸质量浓度均为1 000 mg/L的标准混合溶液。
1.3.2 色谱条件
采用Metrosep Organic acids-250/7.8分析柱;淋洗液:0.5 mmol/L的硫酸和丙酮添加比例为15%的混合溶液;最大流速为0.6 mL/min;进样量20 μL;检测器:电导检测器;抑制液:50 mmol/L氯化锂。根据文献[23-24]报道的不同有机改进剂对于多种离子分离效果的影响结果表明,乙腈相较于丙酮和甲醇等其他有机改进剂具有洗脱能力强、灵敏度高和柱压小的优势。本研究考察了淋洗液中硫酸浓度(0.5 mmol/L、1.0 mmol/L、1.5 mmol/L和2.5 mmol/L)、柱温(10 ℃、20 ℃和30 ℃)、流速(0.1 mL/min、0.3 mL/min和0.5 mL/min)、乙腈添加比例(0、5%、7%、10%和20%)对10种有机酸分离效果的影响。
1.3.3 标准曲线绘制
分别吸取一定量的1 000 mg/L标准混合溶液于容量瓶中,用高纯水配制成质量浓度分别为1 mg/L、2 mg/L、5 mg/L、10 mg/L、20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L的混合标准系列工作溶液。以峰面积(y)为纵坐标,有机酸的质量浓度(x)为横坐标绘制标准曲线,进行线性回归分析和样品定量分析。
1.3.4 焦谷氨酸产生评价方法
用谷氨酸损失率表示转化为焦谷氨酸的谷氨酸含量占初始谷氨酸含量的比值,如式(1)所示:
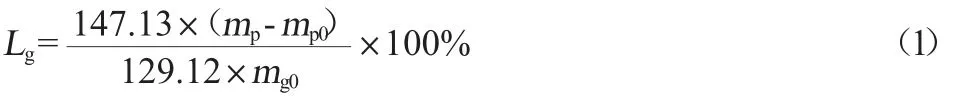
式中:Lg为谷氨酸损失率,%;mp为焦谷氨酸总量,kg;mp0为初始发酵液中焦谷氨酸总量,kg;mg0为初始谷氨酸总量,kg;147.13为谷氨酸的相对分子质量;129.12为焦谷氨酸的相对分子质量。
企业提供的初始谷氨酸发酵液中谷氨酸质量浓度为187 g/L,体积为420 m3的发酵罐4个,计算得初始谷氨酸总量为314 950 kg。
1.3.5 分离度的测定
分离度Rs是衡量相邻洗脱组分的分离情况,分离度越大,相邻两组分分离越好,分离度计算公式如下[25]:

式中:t1和t2表示两个洗脱峰的保留时间,min;W(1/2)1和W(1/2)2
表示两个洗脱峰的半峰宽,min。
1.3.6 数据分析
采用MagIC Net 3.2色谱数据处理软件,根据色谱图中样品的保留时间和标准品的保留时间比对进行定性分析,根据各有机酸的峰面积和标准曲线对样品中的有机酸进行定量分析。用Microsoft Excel 2019、Origin 8.6软件对实验数据进行处理。
2 结果与分析
2.1 离子色谱法测定味精中有机酸条件优化
本研究对淋洗液中硫酸浓度、柱温、流速和淋洗液中乙腈添加比例进行优化,考察10种有机酸的分离效果。首先通过预实验检测了谷氨酸和谷氨酰胺在有机酸柱上的保留情况,结果显示二者均不出峰,不影响焦谷氨酸检测。
2.1.1 淋洗液中硫酸浓度的选择
考察淋洗液硫酸浓度(0.5mmol/L、1.0mmol/L、1.5mmol/L和2.5 mmol/L)变化对10种有机酸的分离效果,结果见图1。由图1可知,硫酸浓度增加导致有机酸的保留时间增加,其中,硫酸浓度的改变对富马酸和焦谷氨酸的影响较大。硫酸浓度>1.0 mmol/L时,可以实现焦谷氨酸与其他有机酸基线分离。在考察的硫酸浓度范围内不能分离琥珀酸和乳酸。选取硫酸浓度为1.0 mmol/L进行后续试验。
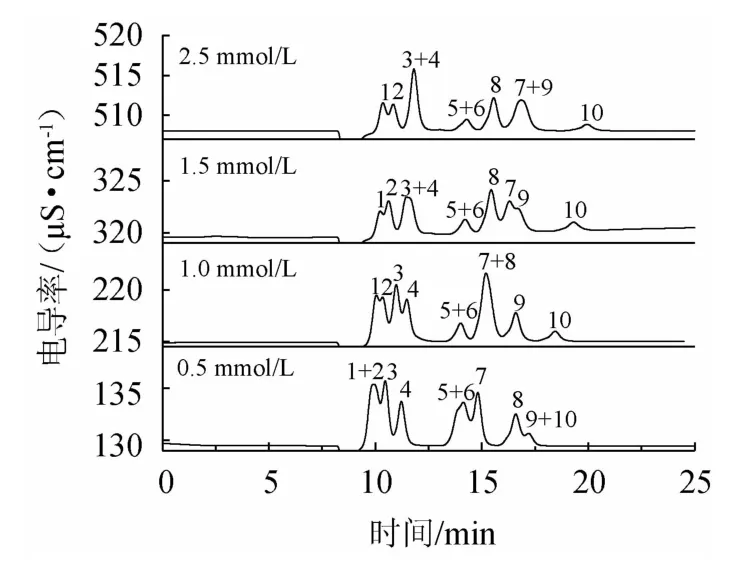
图1 10种有机酸在不同硫酸浓度下的离子色谱图Fig.1 Ion chromatograms of 10 organic acids at different sulfuric acid concentration
2.1.2 柱温的选择
柱温会影响有机酸的分离度和保留时间,考察柱温分别为10 ℃、20 ℃和30 ℃条件下的有机酸分离情况,结果见图2。由图2可知,随着柱温增加,富马酸和焦谷氨酸的保留时间缩短,其他有机酸的保留时间基本不变。琥珀酸和乳酸在考察的温度范围内不能实现分离,富马酸和乙酸在10 ℃时不能完全分离,30 ℃时富马酸和甲酸的峰重叠。因此选择柱温为20 ℃进行后续实验。
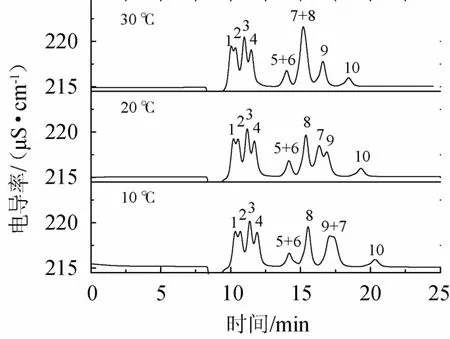
图2 10种有机酸在不同柱温下的离子色谱图Fig.2 Ion chromatograms of 10 organic acids at different column temperature
2.1.3 流速的选择
在离子色谱分离时,流速升高,柱压增加;而流速过小,可能造成峰形变形和拖尾。降低流速会增加分离度、增加峰面积和峰宽,考察流速为0.1 mL/min、0.3 mL/min和0.5 mL/min时对有机酸分离的影响,结果见图3。由图3可知,有机酸的出峰顺序不受流速影响,为评价流速对相邻洗脱组分分离情况的影响,根据式(2)计算相邻有机酸的分离度。随着流速降低,相邻有机酸的分离度略有增加,如丙二酸和苹果酸的分离度在流速为0.5 mL/min、0.3 mL/min和0.1 mL/min时依次为0.81、0.94和1.05。但流速降低,有机酸保留时间大幅增加,灵敏度下降。综合考虑,选择流速0.3 mL/min进行后续实验。
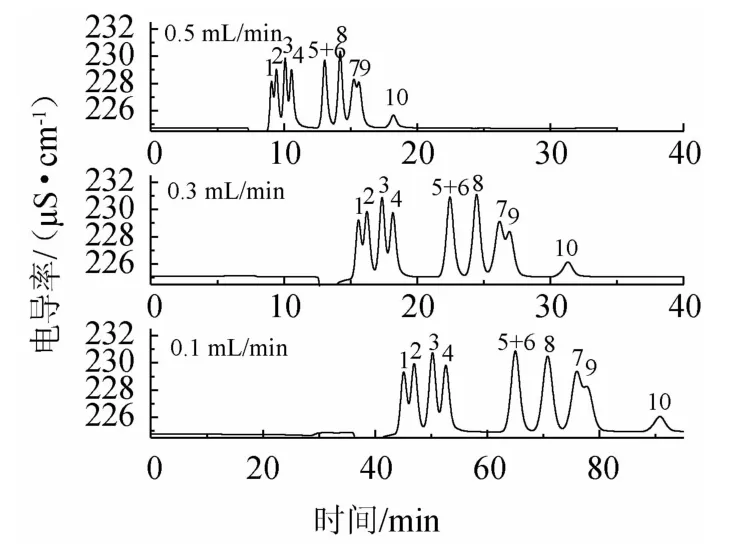
图3 10种有机酸在不同流速下的离子色谱图Fig.3 Ion chromatograms of 10 organic acids at different flow velocity
2.1.4 淋洗液中乙腈添加比例的选择
淋洗液中乙腈的加入可以降低淋洗液的极性,缩短分析时间,对不同待测离子保留时间影响很大,同时改善离子的峰型[26]。考察淋洗液中乙腈添加比例为0~20%时的有机酸分离效果,结果见图4。由图4可知,随着乙腈添加比例的增加,淋洗液电导率下降,有机酸的保留时间缩短。富马酸和焦谷氨酸的保留时间受乙腈添加影响最大。添加乙腈比例在7%以上能够有效的分离琥珀酸、乳酸,但添加比例过大时影响了酒石酸、丙二酸和苹果酸的分离。乙腈添加比例为7%时分离效果最好。
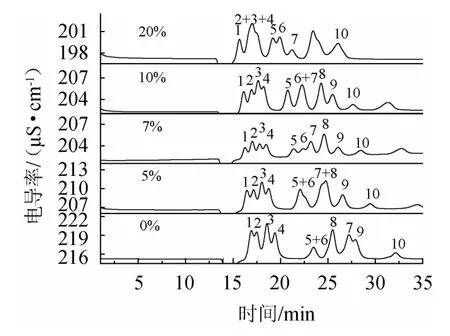
图4 10种有机酸在不同乙腈添加比例下的离子色谱图Fig.4 Ion chromatograms of 10 organic acids at different acetonitrile addition ratio
2.2 方法学考察
2.2.1 10种有机酸线性关系
根据以上优化实验的结果,采用淋洗液中硫酸浓度为1.0 mmol/L和乙腈添加比例为7%、柱温为20 ℃、流速为0.3 mL/min的离子色谱条件进行检测,配制一系列混合标准溶液,以峰面积(y)和有机酸质量浓度(x)进行线性拟合,其线性关系、线性范围、检出限、定量限和相关系数(r2)见表1。由表1可知,10种有机酸的线性相关系数均可达0.998以上,线性良好,以3倍信噪比计算10种有机酸的检出限为0.028~0.971 mg/L,以10倍信噪比计算定量限为0.092~3.236 mg/L。
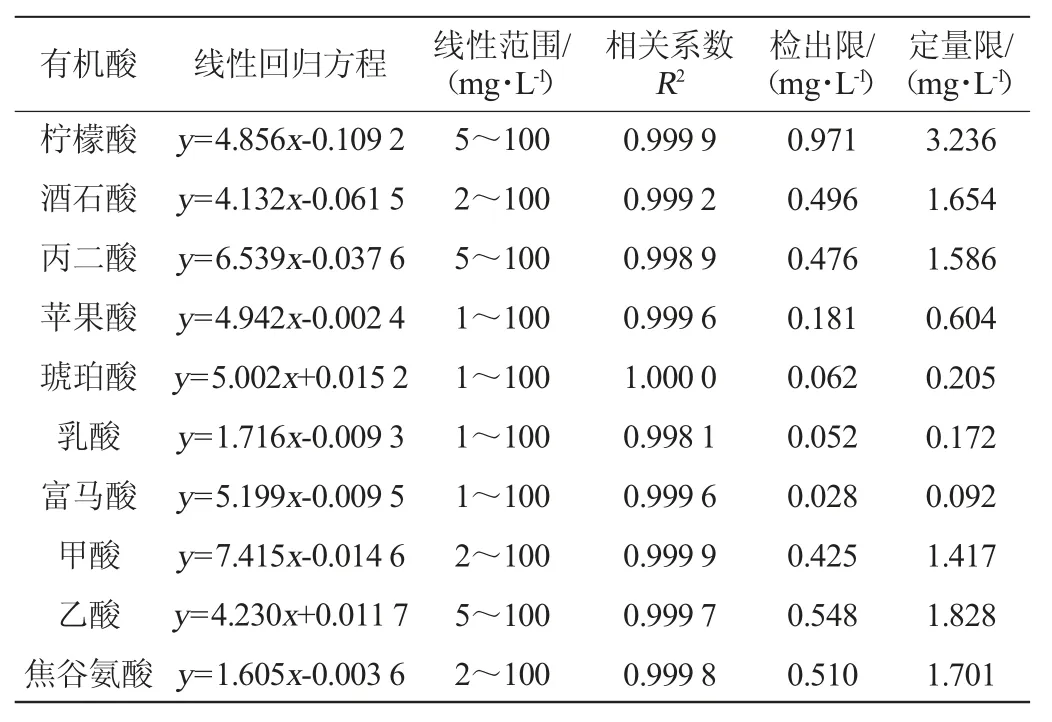
表1 10种有机酸的标准曲线回归方程、线性范围、线性系数、检出限和定量限Table 1 Standard curve regression equation,linear range,linear coefficient,detection limit and quantification limit of 10 organic acids
2.2.2 加标回收率试验结果
向谷氨酸发酵液中加入一定量的混合标准溶液,稀释250倍,用0.22 μm的滤膜过滤,平行测6次,根据加标浓度和测定浓度计算有机酸的加标回收率和相对标准偏差(relative standard deviation,RSD),结果见表2。由表2可知,10 种有机酸的加标回收率为92.1%~106.2%,RSD 为0.171%~0.938%,除丙二酸、琥珀酸和乙酸外,其余有机酸的回收率均在95%~106.2%范围内,10种有机酸回收率测定结果的RSD均<1%,表明该方法准确可靠,满足实际样品的分析。
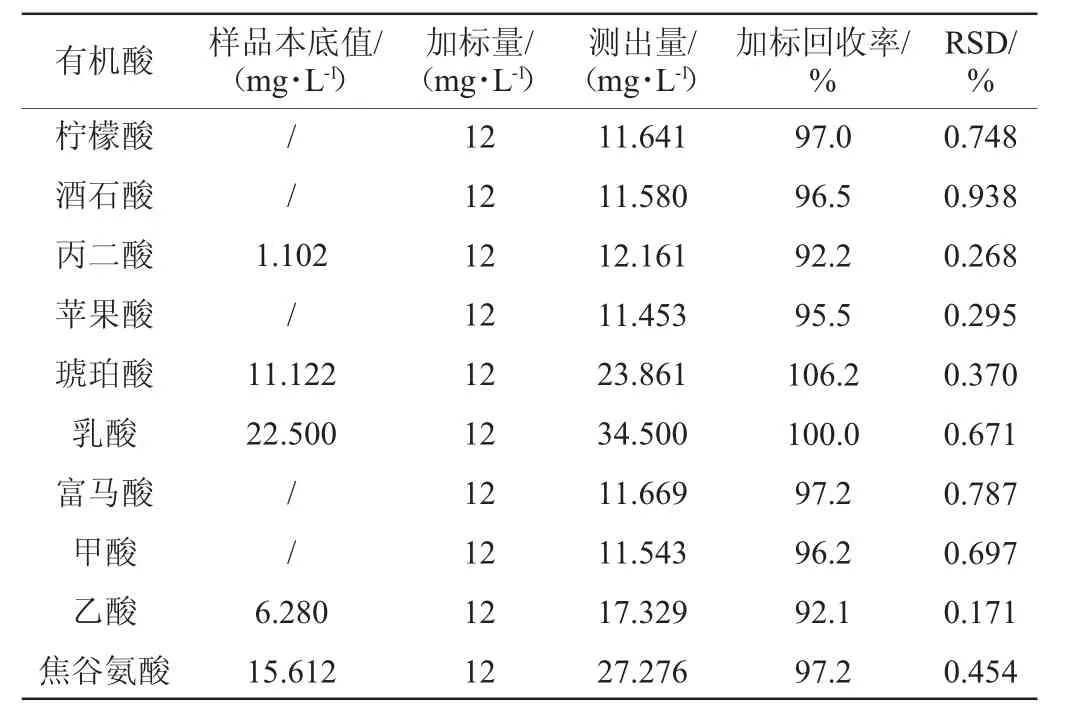
表2 谷氨酸发酵液中6个水平下的加标回收率和相对标准偏差Table 2 Standard recovery rate and relative standard deviation of 6 spiked samples in glutamic acid fermentation broth
2.3 味精生产各工段有机酸含量的测定
2.3.1 离子色谱法检测味精生产各工段料液中有机酸浓度
一次母液为等电提取分离谷氨酸后得到的上清液,二次母液为洗涤谷氨酸结晶得到的洗水,其中洗涤谷氨酸结晶的用水包含转晶过程和味精结晶过程带来的料液。采用离子色谱在优化条件下检测了典型味精生产工艺各工段实际料液中的谷氨酸发酵液、一次母液、二次母液及其浓缩液的各有机酸含量,结果见表3。由表3可知,实际料液中检测到酒石酸、丙二酸、苹果酸、琥珀酸、乳酸、甲酸、乙酸和焦谷氨酸,检测到的谷氨酸发酵液中有机酸的总量为谷氨酸总量(谷氨酸发酵液中谷氨酸的质量浓度为187 g/L)的3.8%,其中乳酸、乙酸和焦谷氨酸的浓度较高。除焦谷氨酸外,其他有机酸在各个工段样品中未见明显变化,而焦谷氨酸质量浓度在二次母液和二次母液浓缩液中分别高达40.20 g/L和84.28 g/L。除焦谷氨酸外检测到的少量其他有机酸在谷氨酸发酵过程中产生,其含量在之后的工段中保持稳定。而大量焦谷氨酸的产生表明在味精生产过程中有大量谷氨酸转化,造成产品的损失,因此在味精生产过程中应加强对焦谷氨酸含量的监测,本研究进一步对焦谷氨酸的产生原因进行初步探讨。
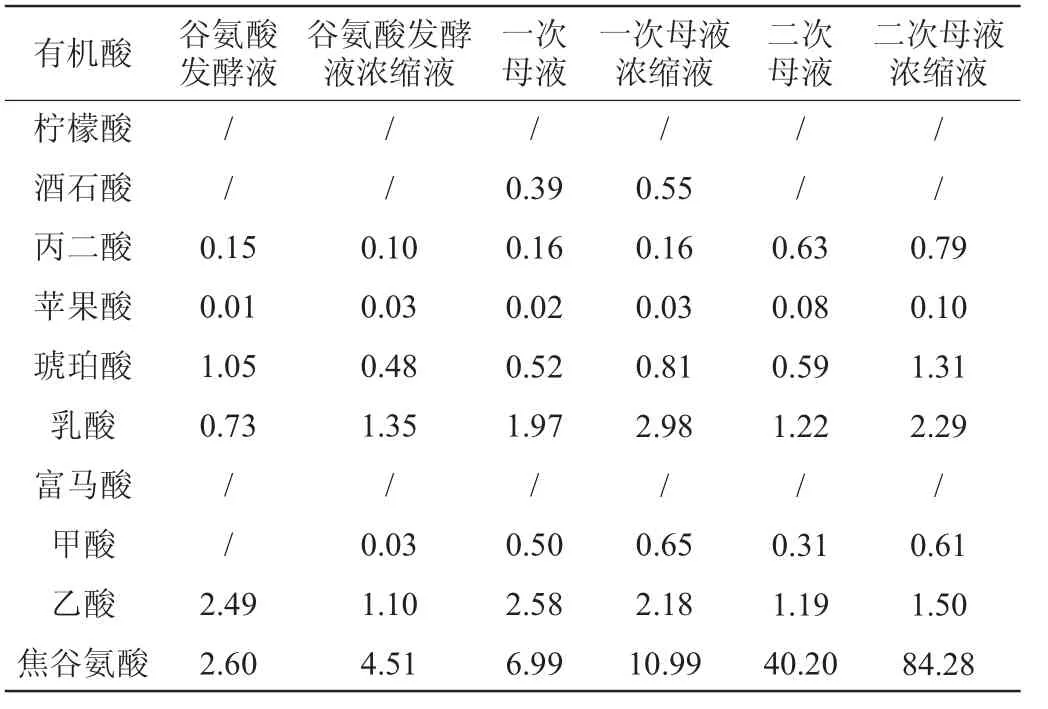
表3 味精生产不同工段料液中有机酸含量测定结果Table 3 Determination results of organic acid contents in the broth of different section of monosodium glutamate production g/L
2.3.2 焦谷氨酸产生原因探讨
焦谷氨酸是由于料液长时间高温缺水导致谷氨酸脱水环化而产生的。在连续浓缩等电法中,可能产生焦谷氨酸的工段主要有料液浓缩过程、转晶过程和结晶过程。料液浓缩过程包括发酵液浓缩、一次母液浓缩和二次母液浓缩过程。其中,影响谷氨酸收率的过程为发酵液浓缩和二次母液浓缩。根据表3中各工段料液中焦谷氨酸浓度测定结果,结合企业提供的各工段料液体积信息,计算得到各工段焦谷氨酸总量和相应的谷氨酸损失率,结果见表4。
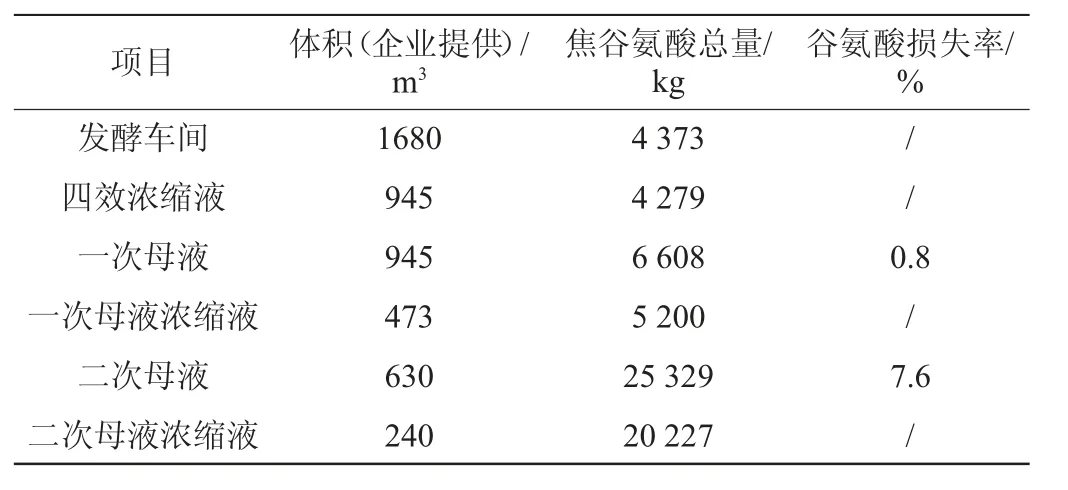
表4 味精生产各工段料液焦谷氨酸含量及谷氨酸损失率Table 4 Pyroglutamate content and glutamic acid loss rate of broth of different section of monosodium glutamate production
由表4可知,对比三段浓缩过程可以看出,与浓缩前相比,浓缩后的料液中焦谷氨酸的量未见增加,因此,浓缩过程对焦谷氨酸的产生影响不大。转晶过程和味精结晶过程产生的焦谷氨酸体现在二次母液中,焦谷氨酸总量是初始发酵液的5.8倍,若不进行回收会损失7.6%的谷氨酸。实际生产过程中,二次母液浓缩后用硫酸水解使焦谷氨酸开环生成谷氨酸,水解液回到等电罐中调节发酵液pH,通过这一操作可对该部分谷氨酸进行回收[27]。一次母液与初始谷氨酸发酵液相比焦谷氨酸总量提高了51%,说明在等电过程引入了焦谷氨酸,二次母液浓缩液焦谷氨酸水解不完全,相当于有0.8%的谷氨酸在一次母液中未被回收。因此在典型味精生产工艺中转晶过程和味精结晶过程有大量焦谷氨酸产生,通过酸解可回收大部分谷氨酸,但仍有少量损失进入一次母液中。为减少产品损失和水解焦谷氨酸的酸用量,应进一步研究具体操作条件对焦谷氨酸产生的影响,在此基础上改进转晶过程和味精结晶过程的工艺条件。上述结果表明经优化后的抑制型离子色谱法适用于监测味精生产中的有机酸含量,为产品质量评估提供了有效的检测手段。
3 结论
测定味精生产中有机酸的含量对味精生产工艺评价和产品质量提升意义重大。本研究建立了抑制型离子色谱法测定味精生产中有机酸,采用有机酸柱对柠檬酸、酒石酸、丙二酸、苹果酸、琥珀酸、乳酸、富马酸、甲酸、乙酸和焦谷氨酸10种有机酸进行分离。该方法具有线性范围广、结果准确、灵敏度高、重复性好等优点,样品过滤后即可直接进样检测,与液相色谱相比发酵液中谷氨酸和谷氨酰胺不影响焦谷氨酸的检测,适用于在高氨基酸和高无机离子浓度下有机酸的检测,为其他类似的有机酸的定性和定量检测提供借鉴。
