传染性喉气管炎病毒UL56蛋白在不同感染模式中的表达及其亚细胞定位分析
2022-11-05马德青张金城徐贝贝冯伟民
马德青,张金城,徐贝贝,冯伟民,陈 鑫,韦 平,黄 腾
(广西大学动物科学技术学院,广西 南宁 530005)
传染性喉气管炎(Infectious laryngotracheitis,ILT)是由ILT 病毒(ILTV)感染引起鸡的急性、高度接触性上呼吸道疾病。发病鸡的临床表现有张口呼吸、甩头咳出带血粘液,眼结膜出现中度至重度红肿[1]。该病具有感染性强、发病急、传播快等特点,严重威胁养鸡业的健康发展[2]。接种ILTV 减毒活疫苗是当前防控该病流行的有效措施之一,常见活疫苗类型有鸡胚来源(Chicken embryo origin,CEO)和组织来源(Tissue culture origin,TCO),但长期且大范围使用这两种疫苗存在疫苗株毒力返强的风险,引起疫苗型ILT(Vaccinal ILT)[3]。
ILTV 在分类学上属疱疹病毒科、α 疱疹病毒亚科,其双链DNA 基因组编码的开放阅读框(Open reading frame,ORF)在位置和结构上与哺乳动物疱疹病毒有较高同源性[4]。UL56是α 疱疹病毒所特有的基因,编码一种II 型跨膜蛋白UL56,该蛋白位于病毒囊膜与核衣壳之间的皮层区(Tegument)。人单纯疱疹 病 毒II 型(Herpes simplex virus type 2,HSV-2)UL56 能够促进感染细胞内Nedd4 蛋白(Neural precursor cell expressed developmentally down-regulated protein 4,Nedd4)的泛素化,使之在蛋白酶体内降解,但UL56 的具体生物学作用尚不明确[5]。猪伪狂犬病病毒(Pseudorabies virus,PRV)UL56 与病毒的扩散和致病性增强有关[6],而马疱疹病毒I 型(Equine herpesvirus type 1,EHV-1)UL56 能够阻碍感染细胞表面主要组织相容性复合体I(Major histocompatibility complex class I,MHC-I)分子的递呈[7]。ILTV 与其他α 疱疹病毒的UL56 氨基酸序列相似,均含有PY motif 和跨膜域(TMD)关键结构域,保守性较高,但其是否具有与其他α 疱疹病毒类似的作用尚待研究。
本研究将UL56 蛋白氨基酸序列中两个PY motif的所有的脯氨酸(Pro,P)均突变为丙氨酸(Ala,A);还将其TMD 删除,分别构建了pUL56(WT)及其突变体的真核表达质粒pUL56(AY)、pUL56(ΔTMD)。将ILTV 分别感染鸡胚肾(CEK)细胞和气管环(TOC)后,通过western blot 检测不同感染模式中UL56 蛋白的表达特征,并通过激光共聚焦试验观察UL56(WT)及其不同突变体的亚细胞定位,分析影响其亚细胞定位的关键区域,为解析UL56 在ILTV 致病过程中的作用奠定基础。
1 材料与方法
1.1 主要实验材料HEK293T 细胞、DF-1 细胞、pDsRed2-N1 质粒由本实验室保存;鸡ILTV 活疫苗(K317 株,5 000 EID50/mL,JX458824.1)购自哈药集团生物疫苗有限公司;血液/细胞/组织基因组DNA提取试剂盒购自TIANGEN 公司;无内毒素质粒中提试剂盒购自CWBIO 公司;限制性内切酶购自Thermo Fisher 公司;蛋白酶抑制剂、磷酸酶抑制剂购自TransGen 公 司;TranslT@-LT1 Transfection Reagent 转染试剂购自Mirus 公司;4%多聚甲醛固定液、Triton X-100、QuickBlockTM封闭液(TBS)、HRP 标记山羊抗兔或抗鼠IgG(IgG-HRP)、AlexaFluor 488 羊抗兔或抗鼠IgG 购自Beyotime 公司;鼠抗tubulin、抗HA 标签单克隆抗体(MAb)购自Abmart 公司;5×SDS loading buffer购自Solarbio 公司;RIPA裂解液、ECL化学发光试剂盒购自NCM 公司;DMEM 购自Gibco 公司;鼠抗高尔基体58k 多克隆抗体(pAb)购自Novus Biologicals公司;兔抗ILTV UL56 多克隆抗体(pAb)为本实验室制备,抗原多肽序列:30DPHQDDFPRDADSPN44。
1.2 表达UL56 及其突变体重组质粒的构建与鉴定根据基因序列(AGN48313.1)设计上游引物UL56 F: 5′- TCAAGCTTGCCACCATGTCTTCAGAGGACACA TC-3′/下游引物UL56 R:5′-CAGAATTCTAGCGTAGTCT GGGACGTCGTATGGGTATCCCGGAGTC-3′,提 取ILTV疫苗株K317的基因组DNA作为模板,利用上述引物经PCR扩增UL56基因及HA标签(共862 bp),经Hind III/EcoR I双酶切后克隆至pDsRed2-N1载体,构建重组质粒pUL56(WT)。利用UniProt、IEDB等在线蛋白分析软件分析UL56蛋白关键氨基酸序列和结构域分布(图1A),分别将UL56 蛋白氨基酸序列中2 个PY motif(PPPY、PPSY)的所有P 均突变为A,并由武汉金开瑞生物工程有限公司合成编码突变体的基因及HA 标签(共855 bp),引入NheI/Hind III酶切位点并克隆至pDsRed2-N1 载体,构建突变体质粒pUL56(AY)(图1B)。采用同样方法合成无TMD 序列的UL56基因及HA 标签(共793 bp),引入Hind III/EcoR I 酶切位点并克隆至pDsRed2-N1 载体,构建突变体质粒pUL56(ΔTMD)(图1B)。以上3个重组质粒均采用酶切方法鉴定。

图1 ILTV UL56氨基酸序列(A)、pUL56(WT)及其突变体质粒(B)的构建Fig.1 The amino acid sequence of ILTV UL56(A)and the construction of pUL56(WT)and its mutants(B)
1.3 UL56 及其突变体瞬时表达的western blot 鉴定利用转染试剂盒将2 μg 重组质粒pUL56(WT)、pUL56(AY)、pUL56(ΔTMD)分别转染6 孔板中的DF-1 细胞,pDsRed2-N1 转染的DF-1 细胞作为阴性对照。48 h后收获细胞,加入200 μL RIPA 裂解液(含蛋白酶、磷酸酶抑制剂)冰浴30 min裂解细胞后,离心取上清,加入5×SDS loading buffer,95 ℃10 min 后,分别以兔抗UL56 pAb、鼠抗HA、鼠抗tubulin MAb(1∶5 000)为一抗,分别以山羊抗兔和抗鼠IgG-HRP(1∶5 000)为二抗,通过western blot 检测UL56(WT)及其突变体UL56(AY)、UL56(ΔTMD)的表达。
1.4 ILTV K317 株感染鸡胚肾细胞(CEK)、气管环(TOC)后UL56 表达特征的western blot 检测取20日龄SPF 鸡胚,参照文献[8]方法制备TOC,并以25个环/孔培养于含3% DMEM 培养基的12 孔板中培养。同时参照文献[9]制备CEK 细胞,并于含5%FBS DMEM 培养基的6 孔板中培养;待CEK 细胞长至密度为70%~80%单层、TOC 培养48 h 后,将5 000 EID50/mL ILTV K317 株分别接种CEK 细胞及TOC,同时以不感染病毒的CEK 细胞和TOC 为阴性对照。CEK 细胞置37 ℃孵育2 h、TOC 孵育24 h后,弃培养基,用PBS 洗3 次,加入新鲜培养基继续培养,同时在接种病毒后24 h、48 h、72 h、96 h、120 h 收获CEK 细胞及气管环TOC。TOC 经液氮研磨后,再分别以200 μL RIPA 裂解液裂解细胞和TOC,冰 浴30 min 后,参 照1.3 的western blot 鉴 定UL56 蛋白在上述两种感染体系中的表达特征。
1.5 UL56 及其突变体亚细胞定位的激光共聚焦试验将1 μg 重组质粒pUL56(WT)、pUL56(AY)、pUL56(ΔTMD)分别转染HEK293T 细胞,以空载体pDsRed2-N1 转染的HEK293T 细胞为阴性对照。48 h 后弃细胞培养液,加入4%多聚甲醛固定细胞10 min,在含0.1% Triton X-100 的PBS 中处理20 min,Quick-BlockTM封闭液(TBS)封闭10 min;加入高尔基体58k抗体(1∶100)为一抗, 再以Alexa Fluor 488 标记的羊抗鼠IgG(1∶500)为二抗,室温孵育1 h 后加入含DAPI 染料的缓冲液,室温作用20 min。利用激光共聚焦显微镜观察并分析UL56(WT)、UL56(AY)、UL56(ΔTMD)的亚细胞定位。
2 结 果
2.1 pUL56 及其突变体真核表达载体的构建及鉴定结果将构建的重组质粒pUL56(WT)、pUL56(AY)、pUL56(ΔTMD)分别采用HindⅢ/EcoR I、NheI/Hind III、Hind III/EcoR I 双酶切,分别得到862 bp、855 bp 和793 bp 的目的片段,而pDsRed2-N1 空载体经上述酶切仅得到一条约4 600 bp(图2),与预期结果一致。将各质粒测序并利用SnapGene 软件比对测序结果,结果显示插入片段与设计并合成的目的基因序列完全一致,表明重组质粒pUL56(WT)及其突变体质粒pUL56(AY)、pUL56(ΔTMD)正确构建。

图2 重组质粒pUL56(A)及其突变体质粒pUL56(AY)(B)、pUL56(ΔTMD)(C)的酶切鉴定结果Fig.2 Digestion identification of recombinant plasmids pUL56(A)and its mutants plasmids pUL56(AY)(B),pUL56((ΔTMD)(C)digestion identification results
2.2 UL56 及其突变体表达的western blot 鉴定结果将重组质粒pUL56(WT)、pUL56(AY)、pUL56(ΔTMD)分别转染DF-1细胞,48 h后收获细胞裂解处理后经western blot鉴定。结果显示,采用UL56 pAb及HA MAb分别作为一抗均能检测到一条约81 ku的特异性条带(图3),而UL56 理论预测值为57.4 ku,推测UL56 可能形成了二聚体或存在翻译后修饰。以上结果表明,UL56(WT)及其突变体UL56(AY)、UL56(ΔTMD)均在DF-1 细胞中获得了瞬时表达。
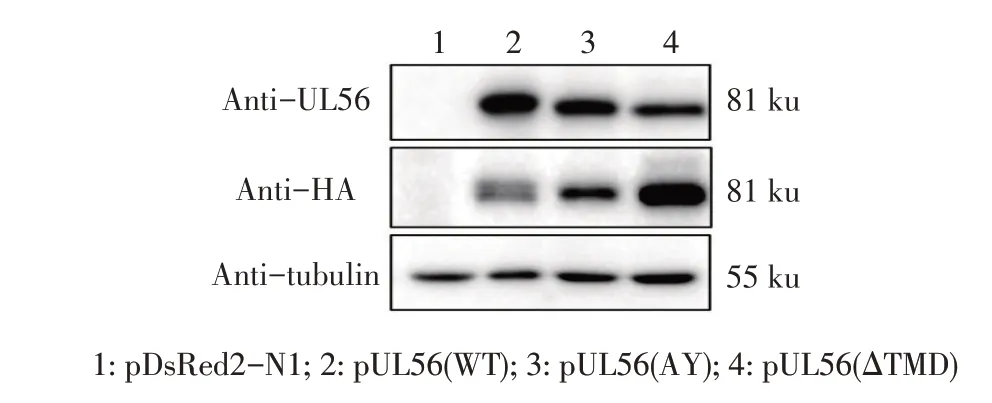
图3 pUL56及其突变体在DF-1细胞中瞬时表达的western blot鉴定Fig.3 Western blot identification of transient expression of pUL56 and its mutants in DF-1 cells
2.3 ILTV K317 株感染CEK、TOC 后UL56 表达规律的western blot 鉴定结果利用ILTV K317 株以5 000 EID50/mL 的剂量分别感染CEK 细胞及气管环TOC 后,收集不同感染时间点的细胞及气管环提取总蛋白,通过western blot 检测UL56 的表达规律。结果显示, UL56 在CEK 中的分子量约为84 ku,从感染后24 h 开始表达,48 h 达到峰值,随后逐渐降低,但降低并不明显(图4A)。UL56 在TOC 中的分子量约为104 ku,于感染后24 h 开始表达,此后表达量持续升高,至96 h 达到峰值;阴性对照组均无相应条带(图4B)。表明UL56 在ILTV 感染的CEK 细胞和TOC 均有表达,且其在这两种感染体系中的表达规律并不一致。

图4 ILTV感染后鸡胚肾细胞(CEK)(A)和气管环(TOC)(B)UL56蛋白表达的western blot鉴定结果Fig.4 Detection of the expression for UL56 protein in infectedchicken embryo kidney(CEK)cells(A)and tracheal organ cultures(TOC)(B)after ILTV infection by western blot
2.4 UL56 及其突变体亚细胞定位的检测结果将重组质粒pUL56(WT)、pUL56(AY)、pUL56(ΔTMD)瞬时转染HEK293T 细胞,48 h 后以高尔基体58k 抗体为一抗,再加入相应二抗后利用激光共聚焦显微镜观察。结果显示,空载体pDsRed2-N1 转染的细胞中,红色荧光充满整个细胞。野生型UL56 和突变体UL56(AY)均定位于细胞质的核周区域,且二者的荧光信号均与高尔基体标记蛋白有重叠,呈黄色的斑块状分布,表明UL56(WT)与UL56(AY)均定位于高尔基体。删除TMD 后,突变体UL56(ΔTMD)从细胞质向细胞核内聚集(图5)。上述结果表明PY 基序不影响UL56 的定位,而TMD 则对其在细胞中的定位起决定性作用。

图5 UL56(WT)及其突变体UL56(AY)、UL56(ΔTMD)亚细胞定位的激光共聚焦试验结果Fig.5 Subcellular localization of UL56(WT),its mutants UL56(AY)and UL56(ΔTMD)by laser confocal analysis
3 讨 论
哺乳动物α 疱疹病毒UL56 与宿主细胞存在复杂的相互作用并发挥广泛的生物学功能。HSV-2 UL56与胞内囊泡转运和病毒粒子释放有关[10],并能增强病毒的致病性[11]。PRV UL56 能够促进病毒的神经致病性[12],并通过下调高尔基体相关蛋白Rab6a 的表达,导致高尔基体碎片化,从而调节病毒粒子的组装[13]。EHV UL56 干扰树突状细胞表面免疫分子的表达,介导CD83 和CD86 的部分下调表达[14]。EHV UL56 还可以促使细胞表面MHC-I 分子进入动力蛋白(Dynamin)依赖的内吞途径,并最终被溶酶体降解[15]。然而,ILTV UL56 在感染细胞或动物中发挥的作用未见报道。
研究表明ILTV 感染后UL56 可以发生磷酸化,western blot 检测哺乳动物HSV-2、EHV-1 感染的细胞样品,结果显示UL56 均存在2 条特异性条带,利用Lambda 蛋白磷酸酶处理后分子量较大的条带消失[7]。但本研究中ILTV UL56 则无该现象,无论在感染还是转染条件下其均呈单一条带,这提示UL56 蛋白磷酸化可能只发生在特定的病毒与宿主的互作过程,这也是本研究中ILTV UL56 蛋白表达的独特之处。本研究对比了两种不同感染模型下ILTV UL56的表达差异,结果显示感染后48 h 原代CEK 细胞中UL56 的表达量最高,而在离体组织TOC 中UL56 表达量的峰值则出现在感染后96 h,且特异性条带的分子量相差20 ku,由此推测ILTVUL56基因可能存在组织特异性的可变剪接转录本或蛋白翻译后修饰,导致其在不同组织中的表达规律出现较大差异。
UL56 蛋白家族的长亲水区域有1~3 个特征性的氨基酸motif,依次由脯氨酸(Pro)、脯氨酸(Pro)、任意氨基酸(x)和酪氨酸组成(Tyr),即PPxY(下称PY motif)。PY motif 被破坏后, UL56 突变体无法结合含WW 结构域的Nedd4 蛋白[5]。HSV-2 和PRV UL56 的PY motif 均影响Nedd4 蛋白的细胞定位[12,16],且PY motif 的数量与UL56 和宿主蛋白互作的能力呈正相关[17]。本研究经序列分析显示ILTV UL56 氨基酸序列含2 个PY motif(图1A),理论上其应该能与Nedd4 或其他含WW 结构域的宿主蛋白发生相互作用,但这种假设是否成立后续将通过免疫共沉淀试验及蛋白质谱检测验证。
本研究分别构建了UL56 及其突变体的真核表达质粒,并分析UL56 蛋白的亚细胞定位及影响亚细胞定位的关键结构域,结果显示UL56 蛋白定位于高尔基体,PY motif 对其定位无明显影响,而TMD 对其的亚细胞定位至关重要,说明UL56 蛋白家族的亚细胞定位高度保守。虽然目前的研究一致认为完整的UL56 蛋白定位在高尔基体,但删除TMD 的突变体UL56(ΔTMD)存在不同的亚细胞定位。在转染条件下,本研究结果与HSV-2 UL56(ΔTMD)的亚细胞定位基本一致[18],均定位于细胞核。推测这可能是由于TMD 删除后UL56 内部的碱性氨基酸富集区暴露,形成核定位信号(Nuclear localization signal,NLS)致突变体进入细胞核;而在感染条件下,EHV-1 UL56(ΔTMD)则大量存在于细胞浆[7]。这两种截然不同的定位结果提示可能有其他病毒蛋白与UL56 结合,使之成为病毒粒子的一部分。
由于本研究所使用的ILTV 商品化活疫苗K317 株为鸡胚来源(Chicken embryo-origin),且尚未在传代易感细胞系LMH(Leghorn male hepatoma)中适应,所以无法在感染条件下研究UL56 蛋白的表达和定位。此外,目前商品化的细胞器抗体产品针对的物种大多为哺乳动物,这些抗体无论在鸡原代CEF 细胞,还是DF-1 和LMH 细胞系中,均很难产生特异性的信号,因此只能通过转染哺乳动物细胞来研究UL56蛋白的亚细胞定位。解决这些实验材料和方法的局限性是后续研究ILTV UL56 蛋白生物学功能的关键。
综上所述,本研究通过检测ILTV UL56 蛋白在两种感染模式下的表达差异,首次发现了该蛋白具有独特的表达特征,明显有别于其他动物α 疱疹病毒UL56 蛋白的表达特征,这些现象与ILTV UL56 的生物学功能是否存在关联需要进一步研究。本研究拓宽了对ILTV UL56 蛋白表达的认知,为其生物学功能的研究奠定了一定实验基础。
