非洲猪瘟病毒引物解旋酶C962R转录水平的动态分析及其互作病毒蛋白的鉴定
2022-11-05皇甫皓月黄炼榆王可欣沈冬冬张纪文张振江赵东明
席 飞,皇甫皓月,黄炼榆,王可欣,沈冬冬,张纪文,张振江,李 芳,赵东明
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是一种由ASF 病毒(ASFV)引起猪的传染性病毒病,死亡率可达100%[1]。该疾病于1921 年在肯尼亚首次被发现[2],并于2018 年在我国辽宁省沈阳市被发现[3],随后在全国快速流行,目前尚无针对该疾病有效的抗病毒药物及疫苗,严重威胁着我国养猪业的健康发展[4],针对ASFV的抗病毒药物及有效的疫苗研发显得尤为重要。
ASFV 是一种单分子线状DNA 病毒,属于双链DNA 病毒目非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus),也是Asfarviridae家族(Asfivirus属)的唯一成员[5]。ASFV 基因组非常庞大,约170 kb~190 kb,含150 多个开放阅读框[6](ORFs),病毒结构极其复杂[7]。基于该庞大的基因组,ASFV能够编码许多功能蛋白供其完成某些生命周期活动。例如,ASFV 可以编码与病毒基因组复制相关的蛋白[8]。已有研究表明,ASFV 基因组中G1211R、E301R、F1055L、P1192R、C962R等基因编码的蛋白为ASFV 基因组复制相关蛋白[9]。其中,C962R 蛋白类似于彩虹病毒中的引物酶家族成员,能够融合至D5 样解旋酶结构域[10],具有解开DNA 双螺旋及形成DNA 复制阶段所需RNA 引物的作用[11],C962R基因在不同ASFV 分离株中均高度保守[12]。引物解旋酶是ASFV 基因组复制过程中和DNA 合成过程中重要的功能蛋白,并能与DNA 聚合酶亚基相互作用及形成蛋白复合物,探究与C962R蛋白互作的病毒蛋白将有助于揭示C962R 蛋白的生物学功能和了解与ASFV 基因组复制相关的功能性复合体的组成和分子机理。
为分析ASFV引物解旋酶C962R基因的动态转录水平及探寻与其互作的病毒蛋白,本研究利用荧光定量PCR(RT-qPCR)检测ASFV Pig/HLJ/2018株感染猪肺泡巨噬细胞(PAM)后不同时间C962R基因的转录水平,并构建融合表达C962R 和Strep 标签的重组ASFV 及表达C962R蛋白的细胞,通过质谱分析及免疫共沉淀试验确定与C962R蛋白互作的病毒蛋白,为以C962R蛋白为靶蛋白的新型抗ASFV药物及疫苗的研发提供实验依据。
1 材料与方法
1.1 主要实验材料ASFV Pig/HLJ/2018 株、ASFV 基因组、HEK293T细胞、PAM、PK-15细胞、pCAGGS载体、表达C962R 蛋白和Strep 标签的慢病毒包装质粒LentiGuide-puro-962-Strep、慢病毒包装辅助质粒pVSVG、pPSPA、携带有mCherry基因的质粒pmCherry、pCAGGS-C962R-Strep 质粒、同源重组转染试剂K2M、K2 由本实验室保存;p3X-MCS 载体由pMD18-T 质粒改造构建,并保存在本实验室;E. coliDH5α 感受态细胞购自南京诺唯赞生物科技股份有限公司;转染试剂TransIT-Lenti 购自Mirus 公司;鼠源Strep 抗体、鼠源Flag 抗体、山羊抗小鼠IgG-HRP 及脱硫生物素(D-Desthiobiotin)均购自Sigma公司;Strep-Tactin®Sepherose 购自IBA 公司;OPTI-MEM 购自Gibco 公司;蛋白上样缓冲液、poly brene 购自Solarbio 公司;预染蛋白Maker、T4连接酶购自Thermofisher scientific公司。
本研究所涉及到的ASFV 操作均在中国农业科学院哈尔滨兽医研究所国家动物疫病防控高级别生物安全实验室完成。
1.2 引物的设计与合成根据GenBank 中ASFV Pig/HLJ/2018 株基因组序列(MK333180.1),利用Primer Premier 5.0 软件设计引物,并在上下游引物5′端分别引入相应酶切位点,引物均由吉林库美生物科技有限公司合成(表1)。

表1 本研究所需引物Table 1 Primers of the study
1.3 ASFVC962R基因转录水平的动态分析将ASFV Pig/HLJ/2018 株以MOI 10 感染PAM,感染后的0~20 h 内每间隔2 h 收获细胞,提取RNA,反转录成cDNA。利用C962R基因引物C962R-F/C962R-R,内参引物DNAJC14-F/DNAJC14-R 经RT-qPCR 扩增C962R基因和内参基因DNAJC14,每组设置3 个重复,DEPC 水作为阴性对照。将RT-qPCR 的结果用2-ΔΔCt(Ct 目的基因-Ct 内参基因=ΔCt;ΔCt 处理样品-ΔCt 对照样品=ΔΔCt)法处理,分析C962R基因转录水平的动态变化。
1.4 重组质粒的构建与鉴定以ASFV 基因组为模板,利用引物Upstream-F/R 经PCR 扩增距C962R基因起始密码子41 bp(内含子部分)处上游约1 000 bp的基因序列,得到Upstream片段,克隆至质粒p3X-MCS中, 构建重组质粒p3X-MCS-Upstream;以质粒pm-Cherry 为模板,利用引物mCherry-F/R 扩增mCherry片段并克隆至p3X-MCS-Upstream 质粒中构建重组质粒p3X-MCS-Upstream-mCherry;以ASFV 基因组为模板,利用引物Downstream-Strep-F/R、Downstream-41-F/R经PCR 扩增C962RN 端约1 000 bp 的基因序列(该N端融合Strep 标签)及C962R基因起始密码子上游的41 bp(内含子部分)基因序列,分别克隆至p3X-MCSUpstream-mCherry 质粒,构建重组质粒p3X-MCSC962R-mCherry,经双酶切(NdeI/Hind III)和测序鉴定。
1.5 表达C962R 蛋白融合Strep 标签的重组ASFV的构建与鉴定将PAM 以3×106个/孔铺于六孔细胞板中,24 h 后,每孔加入40 μL K2M 试剂;1.5 h后,分别配置A 液:130 μL 1640 培养基+10 μL K2试剂;B 液:130 μL 1640 培养基+3 μg p3X-MCSC962R-mCherry 质粒,将A 液和B 液混合,室温下放置10 min 后转染PAM。24 h 后,将ASFV Pig/HLJ/2018 株以MOI 1 感染PAM,48 h 后分别收获细胞与上清液。将收获的含重组ASFV 的上清液以MOI 1 感染PAM,24 h 后,分别收获上清液和PAM。提取细胞上清中的病毒基因组,利用引物962-F/962-R 扩增含mCherry融合Strep 标签的基因片段,并由库美公司测序;利用细胞裂解液(1 mmol/L Tris-HCl pH7.3,2.5 mmol/L NaCl,10% NP-40,20 mmol/L EDTA)裂解PAM,离心后取上清,以鼠源Strep 抗体(1∶1 000)为一抗、山羊抗小鼠IgG-HRP(1∶10 000)为二抗,经western blot 检测重组ASFV(rC962R-mCherry),以感染ASFV Pig/HLJ/2018 株的PAM 作为阴性对照。
1.6 表达C962R 蛋白的PK 15 细胞(PK-15-962-Strep)的构建与鉴定将HEK293T细胞以4×106个/孔铺于六孔板中,24 h 后将慢病毒包装质粒LentiGuidepuro-962-Strep、辅助质粒pVSVG、pPSPA 共同溶于OPTI-MEM 中;另将转染试剂TransIT-Lenti 与OPTIMEM 混合,孵育5 min 后将上述两种混合液混合,室温孵育30 min后转染HEK293T细胞,48 h后收获含慢病毒的细胞上清。将PK-15 细胞以3×106个/孔铺于六孔板中,将慢病毒按照1/2 细胞培养液体积转导至细胞中,每孔加入1.1 μL poly brene 试剂,以正常PK-15 细胞作为空白对照。转导48 h 后,利用嘌呤霉素(1 μg/mL)筛选,直至空白对照组的细胞全部死亡,收获存活的细胞。利用1.5 中的western blot 方法,检测获得的细胞中C962R 蛋白的表达,以正常PK-15细胞作为空白对照。
1.7 与ASFV C962R 蛋白互作病毒蛋白的Strep pull-down 试验分别利用构建的重组ASFV rC962RmCherry 和PK-15-962-Strep 细胞检测与ASFV C962R蛋白互作的病毒蛋白。前者:将重组ASFV rC962RmCherry 以MOI 1 感染PAM 作为实验组,以Pig/HLJ/2018 株感染PAM 作为阳性对照,正常PAM 作为空白对照。后者:将Pig/HLJ/2018 株以MOI 1 感染细胞PK-15-962-Strep 作为实验组,以PK-15-962-Strep细胞作为阳性对照,正常的PK-15 细胞作为空白对照。每组感染24 h 后,分别裂解细胞,离心取上清,并与Strep-Tactin®Sepherose 于4 ℃低速共孵育2 h 后,进行Strep pull-down 试验,以鼠源Strep 抗体(1∶1 000)为一抗、山羊抗小鼠IgG-HRP(1∶10 000)为二抗,经western blot 检测洗脱液中的C962R 蛋白及与其互作的病毒蛋白。将获得的洗脱液由中科院生物物理所质谱中心经质谱鉴定C962R 蛋白及与其互作的病毒蛋白。
1.8 与ASFV C962R 蛋白互作的病毒蛋白的Co-IP验证以ASFV 基因组为模板,利用表1 中的引物A137R-F/A137R-R、K145R-F/K145R-R、K205R-F/K205R-R 经PCR 扩增由1.7 质谱鉴定到的病毒蛋白编码基因,并分别通过PCR 融合Strep 标签于各基因的C 端,将扩增得到的基因片段分别克隆至pCAGGS 载体中,经双酶切(SacI/NheI)鉴定为阳性的质粒由库美生物科技有限公司测序,正确的质粒分别命名为:pCAGGS-A137R-Flag、pCAGGS-K145R-Flag、pCAGGSK205R-Flag。将HEK293T 细胞铺于六孔细胞板中,当细胞融合度达到80%~90%时,将质粒pCAGGSA137R-Flag+pCAGGS-C962R-Strep、pCAGGS-K145RFlag+pCAGGS-C962R-Strep、pCAGGS-K205R-Flag+pCAGGS-C962R-Strep 利 用 转 染 试 剂TransIT-Lenti 分别转染至HEK293T 细胞中,单独分别转染pCAGGSA137R-Flag、pCAGGS-K145R-Flag、pCAGGS-K205RFlag 的HEK293T 细胞作为对照。36 h 后裂解细胞离心后取上清,取部分上清作为Input 对照。将剩余的上清与Strep-Tactin®Sepherose 在4 ℃摇床中共孵育5 h 后,利用细胞裂解液清洗Strep-Tactin®Sepherose 5 次,最后加入2×蛋白上样缓冲液于沸水中煮样得到IP 样品,分别以1∶1 000 稀释的鼠源Strep 抗体与鼠源Flag 抗体为一抗,以1∶10 000稀释的山羊抗小鼠IgG-HRP 为二抗,对Input 样品及IP 样品经western blot 验证1.7 获得的与ASFV C962R 蛋白互作的病毒蛋白。
2 结 果
2.1 ASFV C962R 转录水平动态变化的检测结果将ASFV Pig/HLJ/2018 株感染PAM,感染后0~20 h 内每间隔2 h 取细胞,利用染料法RT-qPCR 检测细胞中C962R基因转录水平的动态变化。结果显示,感染病毒后6 h 能够检测到C962R基因的转录,随着感染时间的延长,C962R基因的转录水平升高,并在感染后18 h 达到峰值(图1)。阴性对照未检测该基因的转录,所以未展示该数据。结果表明C962R基因为ASFV 晚期转录基因,且其转录水平在一定的时间内与感染时间成正相关。

图1 ASFV C962R基因转录水平动态变化的RT-qPCR检测结果Fig.1 Detection of dynamic changes of transcript level of ASFV C962R gene by RT-qPCR
2.2 重组质粒的构建与鉴定结果分别以ASFV 基因组及pmCherry 质粒为模板,利用PCR 分别扩增相应基因片段,并依次克隆至p3X-MCS 载体,构建重组质粒p3X-MCS-C962R-mCherry。该重组质粒的双酶切鉴定结果显示,获得大小分别为2 741 bp 和2 494 bp(载体)的片段(图2),与预期结果相符。测序结果显示,插入基因序列正确。表明正确构建了重组质粒p3X-MCS-C962R-mCherry。
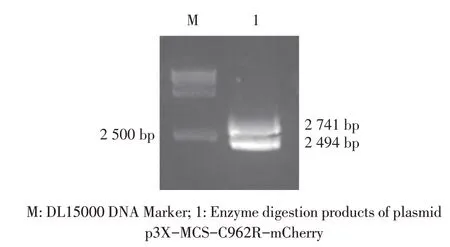
图2 重组质粒p3X-MCS-C962R-mCherry的酶切鉴定结果Fig.2 Identification of recombinant plasmid p3X-MCSC962R-mCherry by enzyme digestion
2.3 表达C962R 蛋白融合Strep 标签的重组ASFV的构建与鉴定结果将重组质粒p3X-MCS-C962RmCherry 转染PAM,24 h 后将ASFV Pig/HLJ/2018 株感染该PAM,48 h 后收获融合表达C962R 和Strep 标签的重组ASFV,并以MOI 1感染PAM,24 h后,分别收获上清和细胞,利用PCR 扩增上清中含mCherry及Strep 标签的融合基因序列并测序鉴定;收获的PAM裂解后经western blot 检测C962R 蛋白的表达。PCR 结果显示,扩增出一条约1 000 bp 的目的条带,测序结果与预期基因序列相符(图略);Western blot 结果显示,PAM裂解液离心后的上清中出现100 ku的特异性条带,而对照组无该特异性条带(图3)。上述结果表明,获得了融合表达C962R 蛋白和Strep 标签的重组ASFV(rC962R-mCherry)。
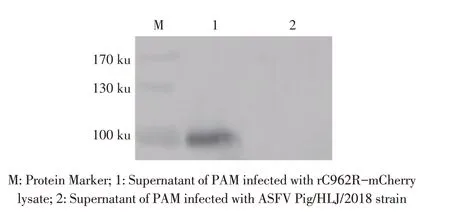
图3 重组病毒C962R-mCherry的western blot鉴定结果Fig.3 Detection of rC962R-mCherry by western blot
2.4 表达C962R 蛋白的PK-15 细胞的构建与鉴定结果分别将慢病毒包装质粒LentiGuide-puro-962-Strep、辅助质粒pVSVG、pPSPA 转染HEK293T 细胞48 h 后收获含慢病毒的上清液,并转导至PK-15 细胞中48 h 后,利用嘌呤霉素筛选融合表达C962R 蛋白和Strep 标签蛋白的细胞并经western blot 鉴定。结果显示,裂解细胞并离心后的上清液中出现100 ku的特异性条带,而未转导慢病毒的PK-15 细胞无该特异性条带(图4)。表明获得了表达ASFV C962R 蛋白的细胞PK-15-962-Strep。

图4 表达C962R蛋白的细胞的western blot鉴定结果Fig.4 Detection of cells that expressing C962R protein by western blot
2.5 与ASFV C962R 蛋白互作病毒蛋白的Strep pull-down 试验结果将rC962R-mCherry 感染PAM,同时将ASFV Pig/HLJ/2018 株感染PK-15-962-Strep,分别通过这两种方式经Strep pull-down 试验检测C962R 蛋白及筛选与其互作的病毒蛋白。结果显示,rC962R-mCherry 感染的PAM、Pig/HLJ/2018 株感染的细胞PK-15-962-Strep 以及无病毒感染的空白细胞PK-15-962-Strep 的洗脱液中均出现100 ku 的特异性条带(图5)。将每组的洗脱液经质谱鉴定,结果显示分别利用rC962R-mCherry 及表达C962R 蛋白的细胞PK-15-962-Strep 共筛选出3 种相同的病毒蛋白:A137R 蛋白、K145R 蛋白及K205R 蛋白。结果表明,C962R 蛋白在rC962R-mCherry 感染的PAM、Pig/HLJ/2018 株感染的细胞PK-15-962-Strep 以及无病毒感染的空白细胞PK-15-962-Strep中均获得了表达,且初步鉴定了与C962R蛋白互作的ASFV蛋白:A137R蛋白(~16.1 ku)、K145R 蛋白(~17.2 ku)、K205R 蛋白(~23.7 ku)。

图5 分别利用rC962R-mCherry(A)及PK-15-962-Strep(B)鉴定与ASFV C962R蛋白互作病毒蛋白的Strep pull-down试验结果Fig.5 Strep pull-down results of viral proteins interacting with ASFV C962R protein by using rC962R-mCherry and PK-15-962-Strep
2.6 与ASFV C962R 蛋白互作病毒蛋白的Co-IP 试验结果经PCR 分别融合Strep 标签于筛选出的3 种病毒蛋白编码基因A137R、K145R及K205R的C 端,并分别克隆至pCAGGS 载体中,获得表达A137R、K145R 和K205R 的重组质粒。并将这3 种质粒分别与pCAGGS-C962R-Strep 共转染HEK293T 细胞,36 h 后裂解细胞离心后取上清采用Co-IP 试验验证与ASFV C962R 蛋白互作的病毒蛋白。结果显示,利用鼠源Strep 抗体与鼠源Flag 抗体分别作为一抗时,Input 样品中均可以检测到各转染组分蛋白的表达;IP 样品中,利用Strep 抗体可以在实验组中检测到100 ku 的特异性条带,对照组中则无该特异性条带,利用Flag 抗体可以检测到约16 ku 及17 ku 的特异性条带(图6),根据条带大小,上述特异性条带分别对应A137R、K145R 蛋白。上述结果表明在实验组中可以检测到C962R 蛋白的表达,且A137R、K145R 蛋白与C962R 蛋白均存在相互作用。

图6 与ASFV C962R蛋白互作病毒蛋白的Co-IP试验结果Fig.6 Co-IP results y of viral proteins interacting with ASFV C962R protein
3 讨 论
在病毒的生命周期中,其基因组的复制和转录至关重要,ASFV 编码与病毒基因组复制相关的蛋白。Linda总结归纳了与ASFV 基因组复制相关的蛋白,分别为:G1211R、E301R、C962R、F1055L、P1192R、NP419L 蛋白[9]。其中,C962R 蛋白作为引物解旋酶,具有解开ASFV DNA 双链及形成RNA 引物的作用[11],该蛋白是DNA 聚合酶功能性复合体的重要组成部分,并与其亚基存在相互作用,找到与C962R 蛋白互作的病毒蛋白有利于揭示C962R 蛋白的功能及了解与ASFV 基因组复制相关的功能性复合体的组成。
本研究首先利用ASFV Pig/HLJ/2018 株感染PAM,通过染料法RT-qPCR 检测了C962R基因的动态转录水平,结果显示,在感染后6 h 能够明显地检测到C962R基因的转录,在感染后18 h 其转录水平达到峰值。表明C962R为ASFV 晚期转录基因,其转录水平在一定的时间内与感染时间成正比。已有研究显示,DNA 复制所需的酶在ASFV 从未被包膜的核心粒子进入细胞质后立即表达,即在其基因组复制前的转录翻译过程中表达,也即约在感染宿主后6 h ASFV 基因组开始复制,说明与ASFV DNA复制所需的酶需要在0~6 h之前转录,本研究结果均与之相符[12]。
本研究利用Strep pull-down 试验筛选到3 种与ASFV C962R 蛋白互作的病毒蛋白:A137R 蛋白、K145R 蛋白、K205R 蛋白。进一步利用Co-IP 试验验证C962R 蛋白与这3 种蛋白是否具有相互作用,结果显示,只有A137R、K145R 蛋白与C962R 蛋白有相互作用,由此推测A137R、K145R 蛋白可能通过与C962R 蛋白的相互作用影响ASFV 基因组的复制。已有研究表明,敲除A137R基因后可以抑制ASFV 的复制及降低病毒毒力[13],说明在ASFV 基因组复制过程中,A137R可能具有不可替代的作用。而敲除K145R基因后却对ASFV的复制及毒力无太大影响[14]。但有相关研究表明,共敲除ASFV Georgia 2007/1 株的MGF360-12L和K145R基因后,明显降低了ASFV 在巨噬细胞中的复制水平,说明K145R 蛋白可能为ASFV 基因组复制过程中的辅助因子。此外,敲除ASFV Georgia 2007/1 株中的K145R和DP148R能够延迟感染猪出现临床症状的时间,说明K145R对病毒的毒力也有一定的影响。A137R 蛋白、K145R 蛋白在ASFV 中的具体作用及其作用机制还有待进一步的研究。
综上所述,ASFV 引物解旋酶C962R 为晚期转录蛋白,病毒蛋白A173R、K145R 与其存在相互作用,该类复合体可能参与病毒基因组的复制阶段。本研究结果有助于了解与ASFV 基因组复制相关病毒蛋白分子的组成及ASFV 基因组复制的相关机制,为以C962R 蛋白为靶蛋白的新型抗病毒药物及疫苗的研发提供参考依据。
