基于特征肽发现与应用的胶类中药质量控制
2022-11-05韩疏影夏浩然闫郅烨黄潇正段金廒
蔡 朔,韩疏影,夏浩然,闫郅烨,黄潇正,赵 明,段金廒*,刘 睿, 3*
·综 述·
基于特征肽发现与应用的胶类中药质量控制
蔡 朔1, 2,韩疏影2,夏浩然2,闫郅烨2,黄潇正2,赵 明1, 2,段金廒1, 2*,刘 睿1, 2, 3*
1. 南京中医药大学 江苏省中药资源产业化过程协同创新中心,中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏 南京 210023 2. 南京中医药大学药学院,江苏 南京 210023 3. 江苏省海洋药用生物资源研究与开发重点实验室,江苏 南京 210023
胶类中药源于动物的皮、角、甲等组织部位,经提取、浓缩、干燥而形成固体胶块,是极具特色的传统中药。近年来,胶类中药以其独特的滋补功效愈发受到消费者青睐,市场需求不断扩大。然而,胶类中药原料短缺、有效质量控制方法缺乏,导致伪劣胶类中药及其产品大行其道,严重影响行业声誉,危害人民健康安全。基于此,中药行业的学者们围绕胶类中药的质量控制研究不断创新突破,建立了多种高效、灵敏的胶类中药质量检测方法,以确保胶类中药的质量,促进行业健康发展。从胶类中药物质组成、质控方法、基于特征肽发现与应用的胶类中药质控方法等方面系统阐述了胶类中药的质控研究现状,为进一步构建和完善科学合理的质控体系提供参考,以期推动胶类中药及行业健康发展。
胶类中药;特征肽;发现;应用;质量控制;生物标志物
胶类中药是由动物的皮、骨、角、甲等部位经煎煮、浓缩等工艺制成的固体胶块,具有悠久的应用历史和鲜明的民族特色。目前,主要的胶类中药包括《中国药典》2020年版收载的阿胶、鹿角胶和龟甲胶3种[1],以及市场上常见的黄明胶、新阿胶、鳖甲胶、鹿皮胶等;此外,以胶类中药为原料的衍生产品,如复方阿胶浆、阿胶补血膏、乌鸡白凤丸、龟鹿补肾丸、阿胶糕、鹿胶糕等得到广泛应用。
随着生活水平提高及大健康理念的普及与推广,人们对于养生补益类中药的需求增加,其中胶类中药以其独特的滋补功效备受消费者青睐,在中医临床和养生保健方面应用广泛。然而,需求的不断增加导致市场上胶类中药质量参差不齐,掺杂掺假的胶类中药严重扰乱市场良性竞争、危害行业健康发展。因此,实现胶类中药的准确鉴别、进一步完善胶类中药的质控方法,是亟待解决的问题之一。中药行业的学者们围绕胶类中药的质量控制研究不断创新突破,建立了多种高效、灵敏的胶类中药质量检测方法。本文从胶类中药物质组成、基于特征肽发现与应用的胶类中药质控方法等方面系统阐述了胶类中药的质控研究现状,以期为胶类中药质控方法提升与行业健康发展提供新的思路和策略。
1 胶类中药的物质组成
胶类中药含有丰富的蛋白质、肽类、氨基酸、微量元素等,其中蛋白质类成分以胶原蛋白为主。胶原蛋白作为机体的重要功能性物质,遍布于动物组织器官中,是体内相对含量最高、分布最广的蛋白质。根据每条肽链上的氨基酸序列及交联方式,可分为28种不同类型的胶原[2]。胶原的一级结构为多肽链的氨基酸序列,遵循甘氨酸(glycine,Gly)-X-Y的排列规则,其中X、Y常代表脯氨酸(proline,Pro)或羟脯氨酸(hydroxyproline,Hyp),稳定的Gly-X-Y重复序列使不同物种的胶原表现出高度的保守特性[3-4];二级结构代表单条α螺旋的多肽链在空间上呈左手螺旋;3条呈左手α螺旋结构的多肽链相互缠绕形成右手复合螺旋结构,构成胶原的三级结构,称为原胶原或胶原分子;胶原分子首尾相接,错位1/4,按规则平行排列成束,通过共价键搭接交联,形成胶原微纤维,并进一步聚集成束形成胶原纤维四级结构[5-6],见图1。
常见胶类中药的胶原蛋白成分主要源于Ⅰ型胶原、II型胶原及III型胶原[7-8],I型胶原主要存在于骨、真皮、肌腱、韧带等多种组织中,是动物中含量最丰富且研究最为广泛的胶原蛋白;II型胶原主要存在于软骨、玻璃体及髓核中;III型胶原则主要存在于皮肤、血管壁和网状纤维组织中[9]。以动物皮、角、骨、甲等为原料的胶类中药在制备过程中,胶原蛋白发生非特异性降解,形成一系列复杂的胶原降解产物,加之胶类中药生产过程中添加的辅料,使胶类中药物质组成异常复杂。
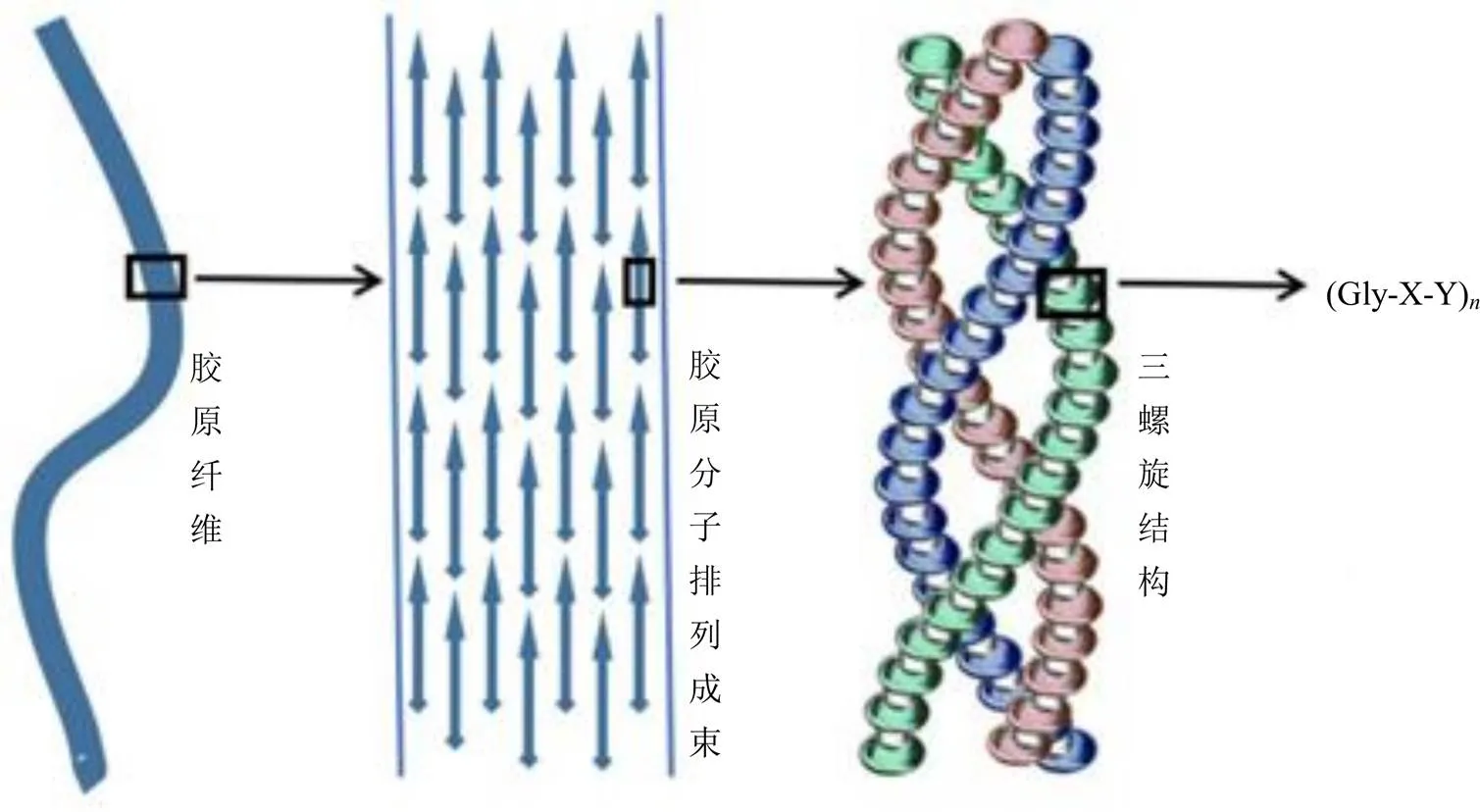
图1 各级胶原的结构特点
Fig. 1 Structural characteristics of collagen at different levels
进一步研究发现,羟基化、脱酰胺化等翻译后修饰(post-translational modifications,PTMs)[10]存在于胶原蛋白或发生于胶类中药加工过程中。Pro与赖氨酸(lysine,Lys)经羟基化后转变为Hyp与羟赖氨酸(hydroxylysine,Hyl);天门冬酰胺(asparagine,Asn)与谷氨酰胺(glutamine,Gln)脱乙酰化后则转变为天冬氨酸(aspartate,Asp)与谷氨酸(glutamic acid,Glu);此外,Hyl还会进一步发生糖基化修饰,形成半乳糖基化或葡萄糖-半乳糖基化结构[8],而这些不同修饰情况对胶原蛋白的理化性质及结构稳定性均具有影响。研究表明,Hyp、Hyl的形成有利于维持胶原蛋白的螺旋结构[11],糖基化的Hyl则与I型胶原纤维分子间共价交联密切相关[12],故羟基化修饰、糖基化修饰与胶原蛋白的结构成型及稳定性之间关联较大。本课题组前期研究对比生鹿皮与经熬制提取的鹿皮胶中蛋白修饰位点的类型及数量,发现鹿皮经过加工提取制成鹿皮胶后,羟基化与脱酰胺修饰位点数量明显增加,这2种修饰均可形成羟基基团,一定程度上可改善胶原成分的水溶性[13]。研究表明,Hyp的含量与胶原蛋白的热稳定性呈正相关[14],且含有羟基化位点的多肽已被证实存在多种生物活性[15-16]。因此,进一步探明胶原蛋白的“修饰信息”对深入研究其结构特点及性质功能具有重要意义。
2 胶类中药的质控方法
胶类中药通常为经过多道工序加工制成的块状固体,在外观、颜色、气味等方面没有明显差异,为建立科学合理的胶类中药质量评价方法,很多研究从胶类的组成成分、理化性质出发,采用多种方法进行检测分析,主要有凝胶电泳法、红外光谱法、元素分析法、氨基酸指纹图谱法、DNA分子标记法。
2.1 凝胶电泳法
李锋等[17]对7种常见胶类中药及杂皮胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳鉴别,发现不同来源胶类中药的电泳图谱差异明显,且伪品胶与正品胶的谱带数目及泳动率均存在较大差异;古今等[18]使用十二烷基硫酸钠-不连续聚丙烯酰胺凝胶电泳法对不同厂家的阿胶、鹿角胶及龟板胶进行鉴别,结果发现3种胶的电泳图谱具有各自的特征鉴别带,所以凝胶电泳法对鉴别胶类中药具有一定的应用价值。
2.2 红外光谱法
许长华等[19]采用傅里叶变换红外光谱法(Fourier transform infrared spectroscopy,FT-IR)和二维红外光谱技术(two-dimensional infrared vibrational echo spectroscopy,2D-IR)对阿胶、黄明胶及伪品阿胶进行对比鉴别,结果表明FT-IR光谱图无法区分,而2D-IR可依据蛋白质成分及含量差异直观反映出三者红外光谱图的区别,从而加以鉴别区分;Li等[20]采用近红外光谱指纹图谱技术和化学计量学方法,建立了东阿阿胶相似度匹配模型,可特异性识别东阿阿胶,说明红外光谱法在胶类中药的真伪鉴别与品牌维护上具有良好的应用价值。
2.3 元素分析法
黄必胜[21]使用原子吸收分光光度法测定了阿胶、鹿角胶、龟胶中锌、铜、铁、锰4种微量元素的含量,并认为这些微量元素含量差异与不同胶类中药性味归经、滋补功效存在内在联系;王文静等[22]采用X射线荧光光谱法测定了不同产地阿胶样品中元素种类及含量,并绘制元素特征谱,通过与阿胶对照品元素特征谱的对比分析,认为可以简便快速地鉴别阿胶真伪。
2.4 氨基酸指纹图谱法
李婉斯等[23]采用柱前衍生化法检测了10批阿胶中的氨基酸成分,并对阿胶中17种氨基酸成分进行了相似度分析及聚类分析,建立了具有一定专属性的阿胶指纹图谱;周芳妍等[24]测定了鹿角胶中18种氨基酸,建立了鹿角胶的氨基酸成分指纹图谱,为鹿角胶的质控提供了一种参考方法。
2.5 DNA分子标记法
近年来,DNA技术已广泛应用于胶类中药的原料鉴别[25-26],但在胶类中药制品的鉴别中无法成为普适性方法,其原因在于成品胶块经过加工提取后,物种特定DNA片段存量低,聚合酶链反应(polymerase chain reaction,PCR)扩增后容易产生假阳性或假阴性检测结果[27-28]。Zhang等[29]采用TaqMan探针方法将特异性探针引入实时定量PCR,分析阿胶中驴源DNA特性并寻找潜在掺假物如马、牛、猪源DNA,证明此改进方法可用于鉴定阿胶中驴源DNA的纯度以及掺假情况。
2.6 基于特征肽发现与应用的质控方法
《中国药典》2020年版中阿胶、鹿角胶及龟甲胶鉴别项下采用了液相色谱串联三重四级杆质谱法,在多重反应监测(multiple reaction monitoring,MRM)模式下,对特征离子进行检测以鉴别样品真伪。基于液-质联用技术(liquid chromatograph-mass spectrometry,LC-MS)检测物种特征肽的方法,凭借高专属性优势,成为近年来胶类中药鉴别的研究热点[30-32]。Cheng等[33-34]结合多元统计学分析方法,寻找鹿角胶、龟甲胶、阿胶、牛皮胶及猪皮胶的特征离子及其对应的特征肽段,验证了特征肽段的物种专属性并形成了相关质量检测标准;Li等[35]基于生物信息学方法比较了驴、马、牛、猪的胶原蛋白序列中的潜在物种差异肽段,并通过实验确定了4种动物的特征肽,可用于阿胶的真伪鉴别及马、牛、猪杂皮源的检测。
凝胶电泳法、红外光谱法等集中于分析胶类中药主要成分(胶原蛋白等)的理化性质差异,但由于动物胶原蛋白的高度同源性,极大地限制了此类鉴别方法的准确性与普适性。元素、氨基酸分析法等以组成成分的种类及含量差异建立指纹图片以图鉴别真伪,但胶类中药与其伪劣胶产品之间成分组成相似,以元素、氨基酸等非专属性成分为检测指标均难以准确鉴别真伪。基于特征肽发现的分析策略已逐渐成为目前胶类中药鉴别的主流方法,其检测原理是基于不同物种间的同源肽段氨基酸序列之间的差异,此差异在LC-MS中表现为同源肽段母离子与子离子在质荷比上的不同,通过检测这些肽段的MRM信息,可实现不同来源胶类中药的鉴别。基于特征肽发现的分析策略应用于胶类中药的质控,具有较高专属性及较好普适性,其主要研究思路与方法包括特征肽的发现和在质量控制中的应用等方面。
2.6.1 特征肽发现的方法与策略
(1)基于化学物质组与多元统计学结合分析发现特征肽(图2-A):Cheng等[33]采用超高效液相色谱-高分辨飞行时间质谱(ultra performance liquid chromatography-quadrupole time of flight-mass spectrometry,UPLC-QTOF-MS)得到了鹿角胶、龟甲胶、阿胶、牛皮胶及猪皮胶的胰酶酶解物总离子流图,使用多元数学统计方法对5种胶原肽图进行了主成分分析(primary component analysis,PCA),结合正交偏最小二乘法比较出各个物种的差异性特征离子,并通过Mascot网络检索这些物种的特征离子进而归属肽段,分别得到1个鹿源、3个龟源、4个驴源、4个牛源及3个猪源特征肽序列,进一步通过合成特征肽验证了其专属性。此方法基于酶解物中大量特征离子的数据信息,采用多元统计的分析方法,从大量数据中提取出关键离子信息以发现特征肽,因此要求有足够的样本量以保证特征肽离子的准确性;同时,部分特征离子由于序列尚未被数据库收载,特征肽序列信息的准确性有待确证,一定程度上限制了这些特征离子在胶类中药专属性鉴别方面的应用[34]。
(2)基于生物信息学比较分析发现特征肽(图2-B):Li等[35]基于生物信息学分析了阿胶的潜在特征肽,并进行了实验筛选验证。首先通过鸟枪法蛋白质鉴定分析驴、马、牛、猪皮中主要胶原蛋白类型,基于蛋白质数据库获取各物种相应类型胶原蛋白的序列信息后,使用BioEdit序列比对编辑器软件寻找不同动物序列中的差异氨基酸位点,并以含差异位点的胰蛋白酶酶切肽段为潜在的目标特征肽,通过LC-MS/MS对这些潜在特征肽进行检测,以序列长短、检测专属性为标准筛选,最终获得了具有良好专属性的6条不同物种的特征肽。王芳等[36]基于生物信息学分析结合UPLC-QTOF-MS检测到与预测结果匹配的1条驴皮特征肽,可用于阿胶与猪皮、牛皮胶的鉴别区分。生物信息学分析比较是基于已知的物种蛋白质序列发现特征肽的方法,可行性与准确度较高,但是基于已知序列的分析并未包含特征肽的PTM信息,因而仍可能缺失部分特征肽信息。此外,生物信息分析获得的理论存在的特征肽,可能由于样品前处理、肽段稳定性、离子化效率等方面影响,并不能在样品中检出,从而限制了此方法的实际应用。
(3)基于多肽组与数学集合比较分析发现特征肽:Liu等[37]采用数学集合理论解释了不同物种与目标物种酶解多肽之间的关系,建立了一种新的特征肽发现策略(图2-C):基于非靶向质谱方法分析目标动物胶与其他伪品胶的酶解肽图谱,取不同批次目标样品肽段的交集设为集合I,取其他各伪品、各批次样品中肽段的并集为集合II。集合I与集合II的交集部分为正品与伪品物种的共有肽段,不具有特异性,故将集合I中此交集部分肽段去除后,集合I中的剩余肽段即构成了具有潜在特征肽的目标差异集合,进一步分析差异集合中的特征肽并进行靶向质谱验证,确立了可用于专属性鉴别的2条鹿源特征肽的氨基酸序列,及6条含有不同PTM组合的特征肽。进一步通过同源肽段序列比对,确定了驴、马、牛、猪中的同源肽亦可作为识别相应物种的特征肽。此方法较生物信息学预测步骤更为简便,基于实际样品酶解肽图的数学集合分析,通过排除法去除非特异性肽段,确定的特征肽段还包含了不同的PTM信息,可最大限度的发现特征肽,且发现的特征肽段均可在真实样品中被检测到,因此具有更高的可行性与可信度。
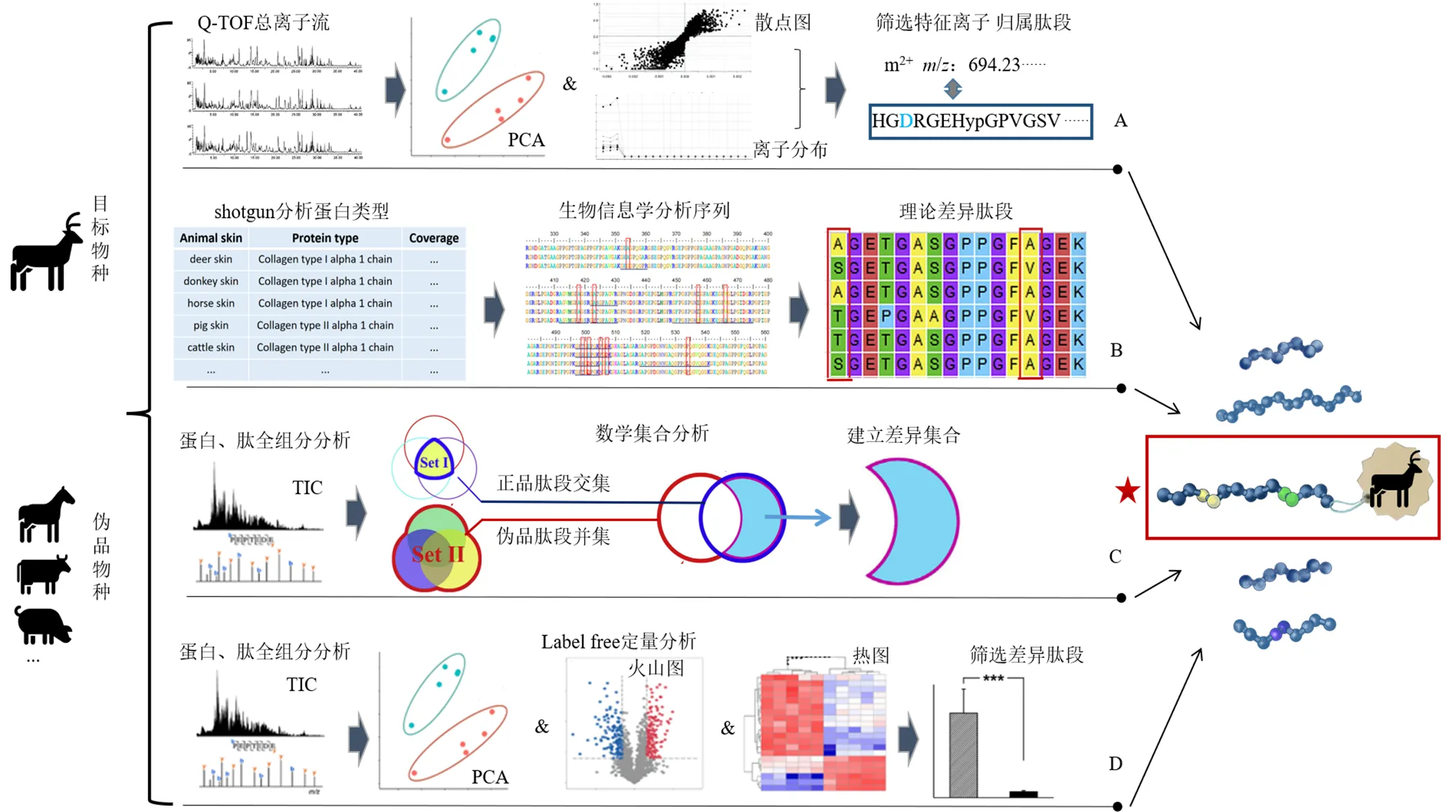
A-多元统计学分析 B-生物信息学预测 C-数学集合分析 D-LFQ筛选
(4)基于定量多肽组与修饰组结合比较分析发现特征肽:在实现不同物种来源胶原鉴别的基础上,Han等[38]基于非标记定量(label-free quantification,LFQ)多肽组学结合糖基化位点分析方法,筛选了含量差异特征肽,如图2-D所示。首先采用纳升液相-串联质谱法(nano-LC-MS/MS)全面检测并定量了鹿角胶及鹿皮胶的酶解肽段,结合PCA、火山图和热图对比寻找具有潜在差异的糖基化肽段,通过质谱的MRM模式筛选并确证了4条含有糖基化修饰位点的,且相对含量存在显著性差异的鹿角特征肽,根据特征肽的相对含量差异可区分鹿角与鹿皮样品,从而可实现相同基原不同部位来源的鹿角、鹿皮胶原产品的鉴别区分和相对掺伪定量,为进一步提高胶类中药的精准鉴别和质量评价提供了一种新的研究思路。
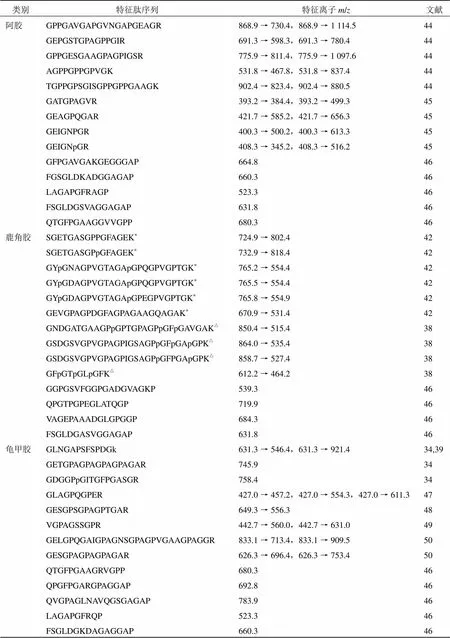
2.6.2 特征肽在胶类中药质量控制中的应用 特征肽作为具有物种差异性的生物标志物,可以有效解决胶类中药真伪鉴别问题。相比其他利用理化性质差异区分正品与伪品的鉴别方法,基于质谱检测的特征肽技术具有一个显著优势即可同时设定多个物种特征肽离子信息作为检测指标,在实现真伪鉴别的同时,可进一步准确判定掺伪成分并对掺伪成分相对定量。《中国药典》2020年版规定了阿胶、鹿角胶及龟甲胶中必须检出相应的物种特征离子,并颁布了伪品添加如猪皮、牛皮的特征肽补充检验方法;也有许多研究采用不同类型的伪品作为阴性对照,以筛选可用于胶类中药鉴别的特征肽段。本文整理了部分具有代表性的特征肽信息,见表1。
(1)基于特征肽判别胶类中药真伪与掺假情况:以物种专属的特征肽“有”或“无”作为指标,可对胶类中药的真伪进行判别。如在鉴别阿胶样品时,设定驴源特征肽离子对用于检测样品是否来源于驴皮,同时可设定多个伪品物种同源特征肽离子对,如牛、马、猪、羊等的特征肽离子对,正品阿胶仅可检测出驴源特征肽,若未检出驴源特征肽,则为伪品;若在检出驴源特征肽的同时检测到其他物种的特征肽,则为掺伪品。基于特征肽检测的方法适用于各种胶类中药的鉴别,可有效判别胶类中药的真伪及掺假情况。
表1 代表性胶类中药特征肽信息
Table 1 Characteristic peptide information of representative gelatinous Chinese materia medica
类别特征肽序列特征离子m/z文献 阿胶GPTGEPGKPGDK380.7 → 374.830,35 GPpGAAGPpGpR 539.8 → 612.4,539.8 → 923.834,39 HGDRGEpGPVGSVGPVGAVGPRGpSGPQGVRGDK**645.5 → 659.840-41 GPTGEPGK371.7 → 487.340-41 HGDRGEpGPVGSVGPVGAVGPR691.0 → 809.4 42 GPTGEpGKPGDK578.3 → 714.4,578.3 → 900.443 GppGAAGPPGLR 539.8 → 924.5,539.8 → 612.343 SGQPGTVGPAGVR591.8 → 910.5,591.8 → 455.843 GPAGPTGPVGK469.3 → 783.4,469.3 → 655.343 GPPGPVGppGLAGpPGESGR600.9 → 958.5,600.9 →772.443 SGDRGEAGPAGPAGPIGPVGAR649.7 → 955.4,649.7 → 556.343 GEAGPAGPAGPIGPVGAR765.9 → 1 048.6,765.9 → 991.643 GDGGPpGVTGFpGAAGR751.4 → 849.4,751.4 → 608.343 GEPGpVGSVGPVGAVGPR535 6 → 809.5,535 6 → 556.343 GLPGVAGSLGEpGpLGIAGpPGAR716.0 → 641.3,716.0 → 570.343 DGTSGHPGPIGPPGPR519.6 → 596.3,519.6 → 442.444 GPPGESGAAGPAGPIGSR517.6 → 586.3,517.6 → 797.344 PGEAGPPGPPGPAGEK731.8 → 1 035.5,731.8 → 300.144 GPPGPMGPPGIAGPPGESGR595.6 → 756.4,595.6 → 699.344 GPNGEPGSTGPAGPPGIR825.9 → 1 195.6,825.9 → 837.544 DGTLGHPGPIGPPGPR514.3 → 596.3,514.3 → 442.244 GEQGPAGPPGFQGIPGPAGTAGEVGKPGER940.8 → 474.2,940.8 → 756.444 TGPPGPSGISGPPGPPGAAGK602.0 → 767.4,602.0 → 689.944 PGPTGLEGPPGER640.3 → 741.4,640.3 → 511.344 GPAGPTGPVGK469.3 → 783.4,469.3 → 712.444 GIPGVAGSIGEPGPIGIAGPPGAR715.7 → 641.3,715.7 → 570.344 GIPGPAGAAGATGAR620.3 → 602.3,620.3 → 715.444 GPPGPVGPPGIAGPPGESGR893.0 → 1 264.6,893.0 → 1 207.644 GIPGVAGSIGEPGPIGIAGPPGAR1 073.1 → 513.3,1 073.1 → 416.244 GEPGPVGSVGPVGAVGPR802.9 → 809.5,802.9 → 1 052.644 GPAGPNGIPGEK555.8 → 446.2,555.8 → 885.444 GAPGAVGAPGPAGANGDRGEAGAAGPAGPAGPR914.4 → 1 073.5,914.4 → 1 137.544 GEPGPTGLPGPPGER733.3 → 741.4,733.3 → 640.344 GETGPSGPAGPTGAR656.3 → 967.5,656.3 → 870.444 SGDRGEAGPAGPAGPIGPVGAR649.3 → 766.5,649.3 → 955.444 IGAPGIIGIPGSR620.4 → 535.3,620.4 → 731.444 GLTGPIGPPGPAGAPGDKGETGPSGPAGPTGAR961.8 → 1 173.6,961.8 → 1 145.144 VGPPGPSGNAGPPGPPGPVGK614.6 → 837.4,614.6 → 667.444 GSPGGPGAAGFPGAR652.3 → 580.8,652.3 → 691.444 EGSPGAEGSPGR566.7 → 430.2,566.7 → 859.444
续表1
续表1
类别特征肽序列特征离子m/z文献 鳖甲胶GETGPVGVTGSVGPAGAR784.9 → 872.5,784.9 → 1 028.651 GLpGQpGDSGPAGK635.3 → 801.1,635.3 → 516.252 DGEAGAQGPPGAAGPAGER832.9 → 979.5,832.9 → 1 036.550 GEVGPQGAIGPAGSSGPAGPIGAAGPAGSR834.1 → 743.4,834.1 → 953.550 牛皮胶GEGGPQGPR427.8 → 668.335 GPPGESGAAGPTGPIGSR 790.934 IGQpGAVGPAGIR 604.8 34 SGETGASGPpGFVGEK746.9 → 846.542 GYpGDAGPVGAAGApGPQGPVGPVGK755.0 → 553.442 GETGPAGPAGPIGPVGAR780.931 GEAGPSGPAGPTGAR641.3 → 726. 2,641.3 → 783.333,39 猪皮胶GPTGPAGVR406.6 → 556.835 AGVMGPPGSR473.0 → 718. 2,473.0 → 586.332 GEPGPTGVQGPPGPAGEEGK 925.4 → 832.6,925.4 → 1 011.534,53 TGETGASGPpGFAGEK739.9 → 818.542 GYpGNPGPAGAAGApGPQGAVGPAGK736.0 → 526.442 GETGPAGPAGPVGPVGAR 774.5 → 977.8,774.5 → 752.534,39 马皮胶GASGPAGVR**386.3 → 499.3,386.3 → 643.335,54 GPSGEPGKPGDK**563.2 → 416.2,563.2 → 698.435,54 LSVEADIDGLR594.331 ISGEWYSIFLASDVK857.931 HGHRGEpGPVGSVGPVGAVGPRGpSGPQGVRGDK**649.7 → 670.840 GPSGEPGK364.7 → 487.340 HGHRGEpGPVGSVGPVGAVGPR698.3 → 809.442 羊皮胶TGEPGAAGPPGFVGEK751.9 → 903.5,751.9 → 846.632 GPAGPTGPAGK455.2 → 684.4,455.2 → 755.4,455.2 → 627.355 GFpGSDGVAGPK553.0 → 450.9,553.0 → 787.556
p-羟脯氨酸 k-羟赖氨酸*肽段为鹿皮胶与鹿角胶共有特征肽△肽段用于区分鹿皮胶与鹿角胶**肽段为骡皮胶共有特征肽
p-hydroxyproline k-hydroxylysine*peptides are shared by deer-skin gelatin and deer-horn gelatin△peptides are used to distinguish deer-skin gelatin and deer-horn gelatin**peptides are shared by mule-skin gelatin
(2)基于特征肽相对含量判别胶类中药掺伪比例:仅以物种特征肽的“有”或“无”作为指标并不能全面评价胶类中药质量,市场上的胶类中药可能因多种原因混入伪品原料而生产出掺有伪品的胶类产品。因此,《中国药典》2020年版补充检验方法结合市场调研与检测方法的差异,将杂皮含量不超过5%限度的胶类中药产品视为合格品[57]。在真伪鉴别的基础上,应进一步对特征肽进行定量分析,建立科学合理的掺伪比例测定方法,实现胶类中药产品的“优劣评价”。
《中国药典》2020年版中阿胶含量测定项下对2种驴源多肽设立限度要求,采用液质联用仪检测不同浓度驴源多肽的对照品溶液,以对照品峰面积对浓度建立标准曲线,计算样品中的多肽含量。但是,具有不同序列的肽段在离子化效率上存在差异,质谱响应与肽段丰度并不直接相关[58]。目前多种标记和非标记方法被开发应用于蛋白质定量组学,根据目的要求可分为绝对定量和相对定量方法,其中常用的同位素标记法多用于小分子蛋白、多肽的绝对定量,方法稳定可靠、重现性高,但同位素标记成本过高,因此,针对特征肽的准确、简便的定量方法仍需进一步探索。
研究表明,掺伪样品中伪品物种特征肽相对含量与伪品掺入量呈线性相关,可用于掺伪比例的相对定量[42,59]。如检测鹿皮胶中伪品牛皮的掺入量时,以牛皮及鹿皮特征肽为指标,检测不同浓度比例的牛皮胶与鹿皮胶的混合酶解液,以伪品牛皮特征肽相对峰面积(牛皮特征肽/鹿皮特征肽)对牛皮掺伪比值(牛皮/鹿皮)建立标准曲线,如图3-A所示,可用于测定鹿皮胶样品中牛皮的掺杂量。研究证明,特征肽相对含量(伪品特征肽/正品特征肽)与伪品掺入比例(伪品/正品)线性关系良好,适用于胶类中药中伪品掺入比例的测定。Han等[38]利用鹿角胶、鹿皮胶中的差异性鹿角特征肽,同样建立了鹿角胶中鹿皮胶的掺入比例测定方法。以鹿角特征肽Pep-G1的峰面积除以内参肽Pep-R的峰面积,计算不同鹿皮胶掺入量情况下的鹿角胶样品中鹿角特征肽Pep-G1的相对含量,即Pep-G1/Pep-R,并以鹿角特征肽相对含量为纵坐标,掺伪量为横坐标建立标准曲线,如图3-B所示,结果线性关系良好,可用于鹿角胶中鹿皮胶掺入比例的测定。
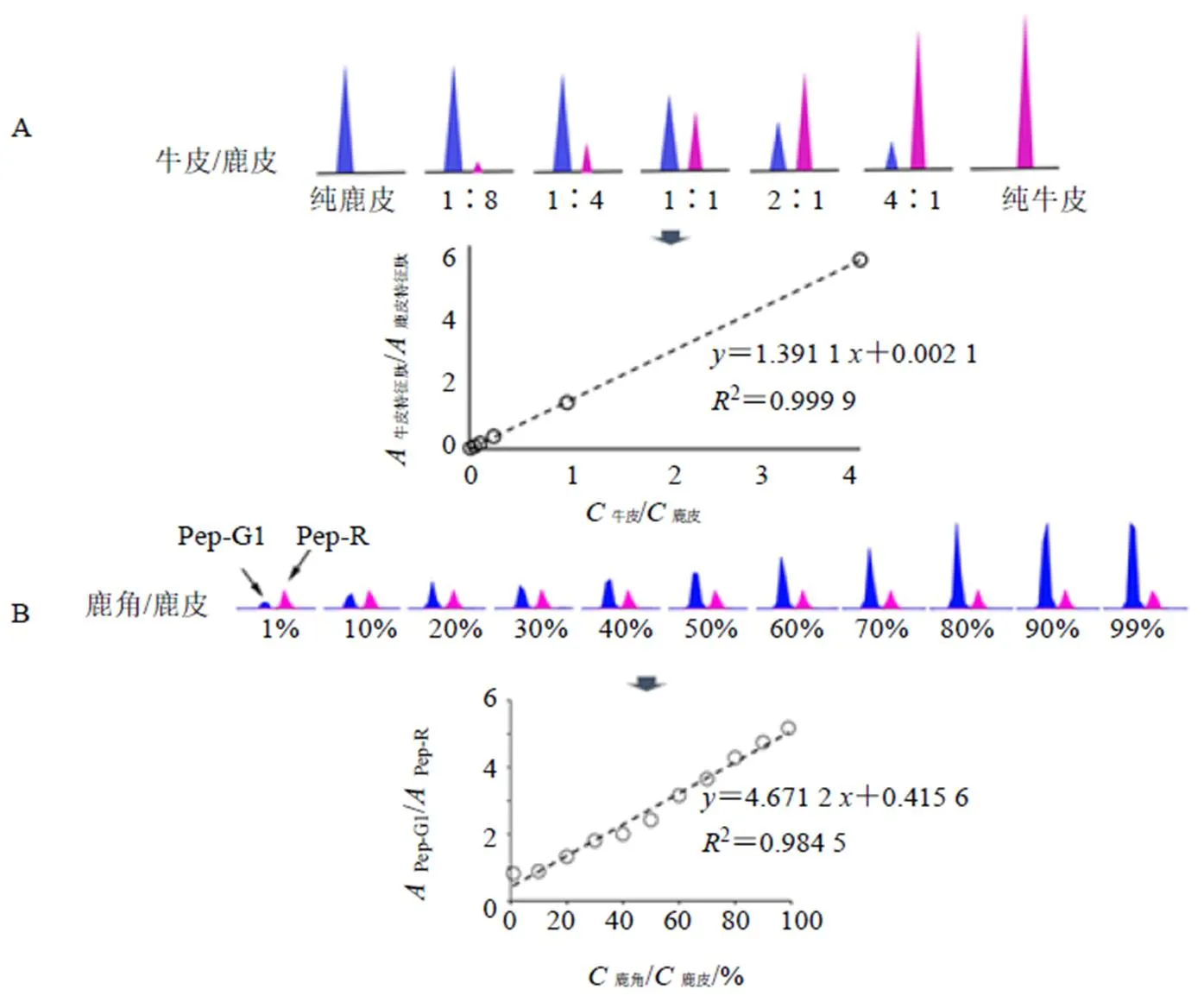
图3 特征肽相对含量与掺伪比例的线性关系
(3)PTM在特征肽检测中的应用:特征肽检测应用于胶类中药的质量控制,首先应以正品特征肽的“有”和伪品特征肽的“无”为评价标准,判断真伪情况或掺伪情况;再对存在掺伪的胶类产品进一步评价,通过测定特征肽的相对含量计算掺伪比例;最终根据结果是否符合《中国药典》2020年版中特征肽的检测要求、含量限度要求及杂皮伪品含量限度要求评判产品质量是否合格,进而实现较为全面的质量评价。针对在应用中尚未解决的问题,仍需在发展和创新中不断结合实际、完善质量控制体系。
在特征肽的发现和寻找过程中,含有修饰位点的氨基酸序列值得关注。Hyp为具羟基化修饰的Pro,在除胶原蛋白外的其他蛋白中较少见,因此选择含有Hyp的肽段作为动物胶原鉴别的特征肽更具有特异性。另外,由于羟基化修饰与胶原的热稳定性呈正相关,因此在经过高温熬制的胶类中药产品中,含Hyp的特征肽相对稳定性较高,更适用于鉴别检测,而含有甲基化、磷酸化、谷氨酸-末端环化等不稳定修饰的肽段则不被考虑[55]。
修饰位点的存在也丰富了可用于鉴别及含量测定的特征肽指标,Liu等[37]在鹿皮胶特征肽寻找过程中发现,在序列不同位点发生PTM但氨基酸序列相同的特征肽段,均可认为是鹿皮胶的特征肽。在实际检测中发现,基本序列为GYPGNA GPVGTAGAPGPQGPVGPTGK的鹿源特征肽中的Pro、Asn、Gln均存在修饰,不同的修饰组合均可认为是鹿源特征肽,如不同组合PTM的肽段有GYP(+15.99)GNAGPVGTAGAP(+15.99)GPQGPVGPTGK、GYP(+15.99)GN(+0.98)AGPVGTAGAP(+15.99)GPQGPVGPTGK、GYP(+15.99)GN(+0.98)AGPV GTAGAP(+15.99)GPQ(+0.98)GPVGPTGK,其中+15.99表示羟基化修饰,+0.98表示脱酰胺化修饰,上述3个肽段均为鹿源特征肽,可用于鹿皮胶的专属性检测。这个发现在后续研究中也得到证实:鹿皮胶样品中均可检测到上述3条肽段,且在其他动物胶原中未检出[42]。由此可见,在特征肽的寻找发现过程中,不同PTM增加了可检测的特征肽种类,对胶类中药质控方法的提升是有益的帮助与补充。
3 结语与展望
结合高分辨率质谱检测物种特征肽,已被证明可实现物种的准确溯源。《中国药典》2020年版在阿胶、鹿角胶、龟甲胶鉴别项下,均规定采用基于串联质谱MRM模式下检测专属性离子对的方法,而含量测定项下阿胶以2个驴源多肽以及Hyp、Pro、Gly、丙氨酸的含量为指标,鹿角胶、龟甲胶仅以这4种氨基酸的含量为指标。物种特征肽段的质谱检测方法已经被《中国药典》2020年版收载,表明以特征肽鉴别胶类中药的方法是可行的,但基于特征肽绝对定量的胶类中药质量评价方法尚需要进一步丰富与完善,这是未来胶类中药质量控制研究的方向之一。
基于已被研究证实具有物种高度专属性的特征肽,本文提出建立胶类中药的多维评价体系:(1)根据检测胶类中药产品中目标正品特征肽和各种伪品特征肽的“有无”判断其真伪及掺伪情况,分为正品、掺伪品、纯伪品。(2)根据特征肽相对含量关系测定掺伪品的掺伪比例,进一步判断产品质量的“优劣”情况。(3)根据对胶类中药特征肽建立的检测要求及含量限度要求最终评判产品质量是否合格。该体系的核心在于选择的特征肽应具有高度的物种专属性和检测稳定性。本文综合论述了几种发现、确定特征肽的方法策略,并介绍了修饰位点在特征肽确立及检测中的重要作用,为发现更多可用于质量检测的物种特征肽提供了新的思路。
稳定的物种特异性是特征肽最重要的特性,将其作为质量检测的生物标志物可解决动物胶原蛋白高度同源性的区分难题。基于特征肽检测建立科学、全面的胶类中药质量评价方法研究,可从以下方向进一步展开:(1)深入研究胶原蛋白中广泛存在的不同修饰类型与数量,关联特征肽序列中可能具有的各种修饰,丰富物种专属性鉴别、不同部位特征区分及含量测定的标志成分。(2)针对含有胶类中药的多种处方制剂及保健食品中特征肽标志物含量可能较低的情况,探索建立微量标志成分的检测方法。(3)多方面考察质谱检测中特征肽响应的影响因素,完善特征肽含量测定方法学验证,建立便捷稳定、可重复性高的特征肽绝对定量测定方法,有利于进一步评价胶类产品质量以及优化制胶工艺。随着科学技术的持续发展和相关理论研究的不断深入,结合先进技术和创新理念用于胶类中药的质控研究,才能更好地促进产品的质量提升和市场有序发展,进一步保障人民群众的健康安全。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 187-188, 197-198, 335-336.
[2] Ricard-Blum S. The collagen family [J]., 2011, 3(1): a004978.
[3] Boot-Handford R P, Tuckwell D S. Fibrillar collagen: The key to vertebrate evolution? A tale of molecular incest [J]., 2003, 25(2): 142-151.
[4] Kleinnijenhuis A J. Visualization of genetic drift processes using the conserved collagen 1α1 GXY domain [J]., 2019, 87(2/3): 106-130.
[5] Hu Y, Liu L, Gu Z P,. Modification of collagen with a natural derived cross-linker, alginate dialdehyde [J]., 2014, 102: 324-332.
[6] Liu X H, Zheng C, Luo X M,. Recent advances of collagen-based biomaterials: Multi-hierarchical structure, modification and biomedical applications [J]., 2019, 99: 1509-1522.
[7] Yang C T, Ghosh D, Beaudry F. Detection of gelatin adulteration using bio-informatics, proteomics and high-resolution mass spectrometry [J]., 2018, 35(4): 599-608.
[8] 刘睿, 蔡朔, 赵珂璇, 等. 鹿皮胶I型胶原赖氨酸位点的羟基化与-糖基化修饰分析 [J]. 中国中药杂志, 2021, 46(3): 591-598.
[9] Gelse K, Pöschl E, Aigner T. Collagens: Structure, function, and biosynthesis [J]., 2003, 55(12): 1531-1546.
[10] Mertins P, Qiao J W, Patel J,. Integrated proteomic analysis of post-translational modifications by serial enrichment [J]., 2013, 10(7): 634-637.
[11] Ma F F, Sun R X, Tremmel D M,. Large-scale differentiation and site specific discrimination of hydroxyproline isomers by electron transfer/higher-energy collision dissociation (EThcD) mass spectrometry [J]., 2018, 90(9): 5857-5864.
[12] Yamauchi M, Shiiba M. Lysine hydroxylation and cross-linking of collagen [J]., 2008, 446: 95-108.
[13] 刘睿, 朱悦, 郑云枫, 等. 基于“多肽组-修饰组”比较分析鹿皮与鹿皮胶物质基础 [J]. 药学学报, 2020, 55(8): 1882-1888.
[14] 焦昀. 羟基化修饰对胶原热稳定性影响研究 [D]. 泰安: 山东农业大学, 2015.
[15] Taga Y, Iwasaki Y, Shigemura Y,. Improvedtracking of orally administered collagen hydrolysate using stable isotope labeling and LC-MS techniques [J]., 2019, 67(16): 4671-4678.
[16] Gjaltema R A, Bank R A. Molecular insights into prolyl and lysyl hydroxylation of fibrillar collagens in health and disease [J]., 2017, 52(1): 74-95.
[17] 李锋, 张振秋, 任子和, 邹荣华. 七种动物胶类药材的SDS-聚丙烯酰胺凝胶电泳鉴别 [J]. 中药材, 1999, 22(4): 184-185.
[18] 古今, 刘萍, 胡景华. 三种动物胶的SDS不连续聚丙烯酰胺电泳法鉴别 [J]. 北京中医, 2003, 22(1): 33-34.
[19] 许长华, 周群, 孙素琴, 王宝琹. 二维相关红外光谱法与阿胶的真伪鉴别 [J]. 分析化学, 2005, 33(2): 221-224.
[20] Li W L, Han H F, Zhang L,. Manufacturer identification and storage time determination of “Dong’e Ejiao” using near infrared spectroscopy and chemometrics [J]., 2016, 17(5): 382-390.
[21] 黄必胜. 阿胶龟胶和鹿角胶中微量元素的测定与分析 [J]. 时珍国医国药, 2001, 12(6): 487.
[22] 王文静, 关颖, 朱艳英. 阿胶真伪品的X射线荧光光谱的鉴别研究 [J]. 光谱学与光谱分析, 2007, 27(9): 1866-1868.
[23] 李婉斯, 李婷, 陆春怡, 等. 基于HPLC指纹图谱及聚类分析评价市售阿胶的质量 [J]. 上海中医药大学学报, 2017, 31(6): 91-96.
[24] 周芳妍, 李婷, 刘力, 等. 鹿角胶中氨基酸类成分的HPLC指纹图谱 [J]. 中国实验方剂学杂志, 2014, 20(9): 47-51.
[25] 罗晖明, 肖炳燚, 聂平, 等. 阿胶原料驴源性成分的DNA分子鉴别方法 [J]. 药物分析杂志, 2017, 37(2): 202-211.
[26] Zuo H L, Zhao J, Wang Y T,. Identification of the adulteratedwith cytochrome c oxidase subunit I gene-based polymerase chain reaction [J]., 2017, 9(4): 313-318.
[27] Kleinnijenhuis A J, van Holthoon F L, Herregods G. Validation and theoretical justification of an LC-MS method for the animal species specific detection of gelatin [J]., 2018, 243: 461-467.
[28] Grundy H H, Reece P, Buckley M,. A mass spectrometry method for the determination of the species of origin of gelatine in foods and pharmaceutical products [J]., 2016, 190: 276-284.
[29] Zhang W J, Cui S H, Cheng X L,. An optimized taqman real-time pcr method for authentication of(donkey-hide gelatin) [J]., 2019, 170: 196-203.
[30] 石峰, 杭宝建, 迟连利, 等. 驴皮特征肽的发现及其在阿胶鉴别中的应用 [J]. 药物分析杂志, 2017, 37(12): 2272-2278.
[31] 房芳, 张九凯, 马雪婷, 等. 基于特征肽段的阿胶中异源性物种鉴别 [J]. 食品科学, 2019, 40(16): 267-273.
[32] 张静娴, 胡青, 董洪霜, 等. 超高效液相色谱-三重四级杆质谱法用于阿胶糕类食品中阿胶的鉴别及马、牛、羊、猪皮源成分的检测 [J]. 世界中医药, 2019, 14(4): 828-832.
[33] Cheng X L, Wei F, Xiao X Y,. Identification of five gelatins by ultra performance liquid chromatography/time-of-flight mass spectrometry (UPLC/Q-TOF-MS) using principal component analysis [J]., 2012, 62: 191-195.
[34] 程显隆. 胶类药材质量控制关键技术研究 [D]. 北京: 北京中医药大学, 2014.
[35] Li X, Shi F, Gong L P,. Species-specific identification of collagen components inusing a nano-liquid chromatography tandem mass spectrometry proteomics approach [J]., 2017, 12: 4443-4454.
[36] 王芳, 范雨, 叶茂, 等. 基于生物信息学和质谱技术的阿胶特异性肽段筛选与鉴定 [J]. 中国现代中药, 2019, 21(9): 1256-1261.
[37] Liu R, Huang Y, Xu H K,. A strategy for identifying species-specific peptide biomarkers in deer-hide gelatin using untargeted and targeted mass spectrometry approaches [J]., 2019, 1092: 32-41.
[38] Han S Y, Zhao K X, Cai S,. Discovery of peptide biomarkers by label-free peptidomics for discrimination of horn gelatin and hide gelatin fromTemminck [J]., 2021, 363: 130347.
[39] 程显隆, 陈佳, 李明华, 等. 特征肽段检测技术用于胶类药材专属性鉴别方法研究 [J]. 中国药学杂志, 2015, 50(2): 104-108.
[40] Cai S, Zhao K X, Jiang M T,. Collagen derived species-specific peptides for distinguishing donkey-hide gelatin () [J]., 2021, 13(2): 261-266.
[41] 刘睿, 赵珂璇, 蔡朔, 等. 一种利用蛋白质内切酶切割胶原蛋白获得专属性肽段的方法和应用: 中国, CN111239302A [P]. 2020-06-05.
[42] Cai S, Jiang M T, Zhao K X,. A quantitative strategy of ultrasound-assisted digestion combined UPLC-MS/MS for rapid identifying species-specific peptide markers in the application of food gelatin authentication [J]., 2021, 147: 111590.
[43] 季申, 胡青, 张静娴, 等. 一组驴源性特征肽和一种鉴定阿胶或阿胶制品的方法: 中国, CN109142598A [P]. 2019-01-04.
[44] 张鸿伟, 张晓梅, 梁成珠, 等. 一组鉴别阿胶及其制品中驴源性成分的多肽: 中国, CN105842375A [P]. 2016-08-10.
[45] 石峰, 陈晓, 巩丽萍, 等. 一组驴源性特征肽及其在驴皮和阿胶胶定性检测中的应用流程: 中国, CN106589063A [P]. 2017-04-26.
[46] Yang H, Shen Y P, Xu Y,. A novel strategy for the discrimination of gelatinous Chinese medicines based on enzymatic digestion followed by nano-flow liquid chromatography in tandem with orbitrap mass spectrum detection [J]., 2015, 10: 4947-4955.
[47] 秦玉峰, 尤金花, 周祥山, 等. 一种胶类中药及其制品中龟源性成分的液质联用检测方法: 中国, CN103630644A [P]. 2014-03-12.
[48] Tang M, Yan J Y, Ren J,. Differentiatingshell glue fromshell glue by UPLC-QTOF/MS coupled with binary compare tool of UNIFI [J]., 2019, 2(1): 50-58.
[49] 刘宇文, 谌宇, 郑娟, 等. 液质联用多肽识别技术用于龟甲的鉴别研究 [J]. 中国卫生检验杂志, 2020, 30(4): 408-409.
[50] 李国卫, 何民友, 胡绮萍, 等. 用于鳖甲和龟甲检测的特征多肽组合的筛选方法和应用: 中国, CN114354772A [P]. 2022-04-15.
[51] 刘宇文, 杨直, 谌宇, 等. 液质联用多肽识别技术鉴别鳖甲胶的研究 [J]. 中国现代应用药学, 2019, 36(24): 3061-3063.
[52] 刘睿, 陈盛君, 段金廒. 一种鳖甲特征肽段及其检测方法: 中国, CN113896770A [P]. 2022-01-07.
[53] Cheng X L, Wei F, Chen J,. Using the doubly charged selected ion coupled with MS/MS fragments monitoring (DCSI-MS/MS) mode for the identification of gelatin species [J]., 2014, 2014: 764397.
[54] 石峰, 巩丽萍, 李雪, 等. 一种马和骡共有特征性多肽及其应用: 中国, CN106198790A [P]. 2016-12-07.
[55] 阳洪波, 王韦达, 李意, 等. 基于特征肽段的液相色谱-质谱技术鉴定胶原蛋白的物种来源 [J]. 分析测试学报, 2018, 37(11): 1279-1286.
[56] 杭宝建, 田晨颖, 陈晓, 等. 超高效液相色谱-串联质谱法测定阿胶中马、牛、羊、猪、骆驼、鹿皮源成分 [J]. 色谱, 2018, 36(4): 408-412.
[57] 程显隆, 李明华, 郭晓晗, 等. 胶类药材质量问题变化情况及标准研究对策 [J]. 中国现代中药, 2020, 22(7): 996-999.
[58] Ankney J A, Muneer A, Chen X. Relative and absolute quantitation in mass spectrometry-based proteomics [J]., 2018, 11(1): 49-77.
[59] 蔡朔, 蒋梦彤, 赵珂璇, 等. 超声辅助酶解与串联质谱联用检测阿胶中马皮成分 [J]. 南京中医药大学学报, 2020, 36(5): 623-628.
Research progress on quality control of gelatinous traditional Chinese medicine based on discovery and application of specific peptides
CAI Shuo1, 2, HAN Shu-ying2, XIA Hao-ran2, YAN Zhi-ye2, HUANG Xiao-zheng2, ZHAO Ming1, 2, DUAN Jin-ao1, 2, LIU Rui1, 2, 3
1. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, and National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 3. Jiangsu Key Laboratory of Research and Development in Marine Bio-resource Pharmaceutics, Nanjing 210023, China
Gelatinous traditional Chinese medicine (TCM), as a valuable characteristic TCM in China, is derived from the skin, horn, shell and other tissues of animals, and it forms solid blocks after extraction, concentration and drying. Recently, gelatinous TCMs have been increasingly favored by consumers because of its unique nourishing effect, and its market demand has been expanded continuously. However, the shortage of raw materials and the lack of effective quality control methods lead to the widespread use of fake and inferior gelatinous TCMs and their products, which seriously affect the reputation of the industry and endanger health and safety of people. Therefore, in order to ensure the quality of gelatinous TCMs and promote the healthy development of the industry, investigators have made continuous innovations and breakthroughs around the quality control research of gelatinous TCMs, and established a variety of efficient and sensitive quality detection methods. Research status of quality control of gelatinous TCMs was systematically reviewed from substance composition and quality control method based on discovery and application of characteristic peptide in this paper, in order to provide reference for further constructing and perfecting scientific and reasonable quality control system, and to promote the healthy development of gelatinous TCMs and industry.
gelatinoustraditional Chinese medicine; specific peptide; discovery; application; quality control; biomarkers
R284.191
A
0253 - 2670(2022)21 - 6888 - 12
10.7501/j.issn.0253-2670.2022.21.028
2022-08-08
国家自然科学基金面上项目(81973450);国家重点研发计划资助项目(2018YFC1706100);江苏省高校“青蓝工程”中青年学术带头人;江苏省第六期“333高层次人才培养工程”第三层次培养对象
蔡 朔,男,在读本科,研究方向为中药资源与开发。E-mail: Caisure1999@163.com
段金廒,教授,博士生导师,研究方向为中药资源化学与资源循环利用。E-mail: dja@njucm.edu.cn
刘 睿,教授,硕士生导师,研究方向为中药动物药资源化学。E-mail: liurui@njucm.edu.cn
[责任编辑 崔艳丽]
