桑属植物中异戊烯基黄酮类化合物及其药理活性研究进展
2022-11-05刘洋洋田海涛邓志鹏
姜 玥,刘洋洋,田海涛,邓志鹏
桑属植物中异戊烯基黄酮类化合物及其药理活性研究进展
姜 玥,刘洋洋,田海涛,邓志鹏*
山东中医药大学药学院,山东 济南 250355
桑科桑属植物在我国分布广泛,其枝、叶、根皮、果实均可入药,具有很高的药用价值。目前从桑属植物中分离得到的化学成分有黄酮、生物碱、香豆素、萜类、多糖等,其中异戊烯基黄酮类化合物为其特征成分,具有抗菌、抗炎、抗肿瘤、抗病毒、降血压、降血糖、抗氧化等多种药理活性。主要对桑属植物中异戊烯基黄酮类化合物及其药理活性的研究进展进行综述,为桑属植物的开发利用和药效物质研究提供参考。
桑属;异戊烯基黄酮;抗菌;抗炎;抗肿瘤;抗病毒
桑科桑属植物全世界有30种10变种,我国目前已有桑属植物15种4变种,是世界上桑属植物最多的国家[1]。桑属种类丰富,分布广泛,多种可供药用,包括桑L.、鸡桑Poir.、吉隆桑Roxb.、黑桑Linn.、华桑Hemsl.、长穗桑Hand.、蒙桑Bur. Schneid.、奶桑Miq.等[2-3],其各部位均可入药。桑属植物的药用价值最早记载于《神农本草经》“中经·木”中的“桑根白皮”,具有泻肺平喘、利水消肿的功效[4]。《中国药典》2020年版收载了桑的干燥叶、嫩枝、根皮及果穗,分别为桑叶、桑枝、桑白皮和桑椹[5]。桑属植物中含有黄酮、生物碱、香豆素、萜类、多糖等化学成分[6],其中黄酮类化合物为主要活性成分之一。目前从桑科植物分离出多达6500个黄酮类化合物,其中400个化合物是异戊烯基和香叶基取代黄酮[7]。通过文献查阅,统计出桑属植物中至少有109种异戊烯基黄酮类化合物,其异戊烯基取代位置多样,可与酚羟基或双键环合,形成结构类型多样的黄酮、二氢黄酮、双黄酮类等类型化合物,表现出抗菌、抗炎、抗肿瘤、抗病毒、降血压、降血糖、抗氧化、抗骨质疏松等药理活性。本文主要对桑属植物的异戊烯基黄酮类化合物及其药理活性的研究进展进行综述。
1 化学成分
桑属植物中含有丰富的黄酮类化合物,根皮的含量最高,其次是茎皮、小枝和老叶[8]。桑属植物中含有的黄酮类化合物主要以含有异戊烯基的黄酮类化合物为主,其是该属植物的特征成分[9-10]。黄酮母核上有1个或多个异戊烯基取代,且这些取代基可与羟基环合形成呋喃环或吡喃环,或通过Diels-Alder反应形成结构新颖的双黄酮类化合物。异戊烯基主要有12种异构形式,见图1,其中A1型为主要结构类型,并且在黄酮母核A、B、C环上均有分布。目前从桑属植物发现的异戊烯基黄酮类化合物多达109个,包括黄酮、二氢黄酮、二氢异黄酮、查耳酮及双黄酮等多种类型。
1.1 黄酮类
该类化合物的结构特点是在黄酮母核的C-3、6、8、3′和5′位上含有多个异戊烯基取代,且这些取代基大多与其邻位或C-2′位上的羟基环合,形成五元、六元或七元环系。该类化合物是桑属植物异戊烯基黄酮中数量最多的,多达54个。化学结构见图2,具体信息见表1。
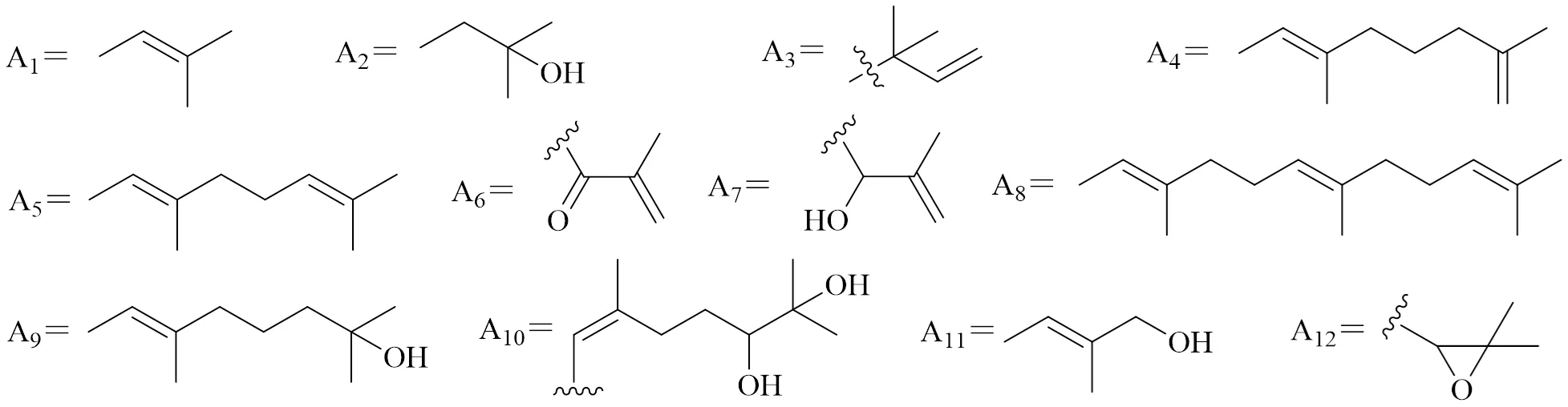
图1 异戊烯取代基的化学结构

图2 桑属植物中异戊烯基黄酮类化合物的化学结构
表1 桑属植物中的异戊烯基黄酮类化合物
Table 1 Prenylated flavonoids from Morus plants
编号化合物名称来源文献 1albanin A桑根皮11 25′-(1′′,1′′-dimethylallyl)-5,7,2′,4′-tetrahydroxyflavone桑根皮12 3(7′′R)-(−)-6-(7′′-hydroxy-3′′,8′′-dimethyl-2′′,8′′-octadien-1′′-yl) apigenin桑嫩枝13 4albanin D桑嫩枝13 5albanin E鞑靼桑M. alba var. tatarica (L.) Ser.根皮14 6桑根酮W(sanggenon W)桑根皮15 75′-geranyl-5,7,2′,4′-tetrahydroxyflavone桑根皮16 8甘草黄酮C(licoflavone C)桑根皮17-18 98-geranylapigenin桑叶19 10桑皮酮S(kuwanon S)桑叶、根皮19 11nigrasin I黑桑嫩枝20 12桑皮酮C(kuwanon C)鲁桑Morus alba Linn. var. multlcaulls (Perrott.) Loud.根皮21 13桑皮酮T(kuwanon T)鲁桑根皮21 148,3′-diprenylapigenin桑叶19 15cudraflavone C桑根皮22 1610-oxomornigrol F桑嫩枝13,23 17mornigrol E桑嫩枝13 18mornigrol F桑嫩枝13 195′-geranyl-4′-methoxy-5,7,2′-trihydroxyflavoneM. alba var. lhou根皮14 20moralbanone桑叶24 21morunigrol C黑桑嫩枝25 223′-geranyl-3-prenyl-2′,4′,5,7-tetrahydroxyflavone桑叶19 23mortatarin E桑叶26 24mortatarin B鞑靼桑根皮14 25mortatarin C鞑靼桑根皮14 26mortatarin A鞑靼桑根皮27 27morunigrol D黑桑嫩枝25 28cyclcommumnol桑根皮12 29环桑素(cyclomulberrin)黑桑嫩枝20 30环桑黄酮(cyclomorusin A)桑根皮28-29 31新环桑色烯(neocyclomorusin)M. alba var. lhou根皮14 32eudraflavone B hydroperoxide桑根皮29 33桑辛素(morusin)桑叶、根皮30-31 34albasin D桑根皮11 35atalantoflavone桑叶32 36桑根皮醇(morusinol)桑根皮29 372-(2,4-dihydrophenyl)-5-hydroxy-8-(hydroxymethyl)-8-methyl-3-(3-methyl-2-butenyl)-(9CI) 桑嫩枝13 38morminM. alba var. lhou茎皮14

续表1
1.2 二氢黄酮类
目前,从桑属植物中分离得到的二氢黄酮类化合物共有32个。异戊烯基大多位于其二氢黄酮母核的C-2、3、6、8、3′和5′上,大多以链状或与其邻位的羟基环合形成吡喃环的形式存在。部分二氢黄酮醇的C-3位羟基与C-2′位羟基发生分子脱水形成呋喃环。少数的二氢黄酮类化合物的异戊烯基可与小分子酚酸类化合物中的双键发生Diels-Alder反应,如化合物78。该类型化合物的化学结构见图3,具体信息见表2。

图3 桑属植物中异戊烯基取代二氢黄酮类化合物的化学结构
表2 桑属植物中的异戊烯基取代二氢黄酮类化合物
Table 2 Prenylated dihydroflavones from Morus plants
编号化合物名称来源文献 55sanggenol Q桑根皮28 56桑皮酮E(kuwanon E)M. alba var. multicaulis根皮21 57桑根酮醇A(sanggenol A)桑根皮28 58里查酮G(leachianone G)桑根皮29 59euchrenone a7桑根皮15 60sepicanin A桑根皮22 617,2′,4′,6′-tetrahydroxy-6-geranylflavanone桑根24 62cathayanon H华桑茎皮14 63cathayanon I华桑茎皮14 64morusalnol A华桑根皮35 65桑根酮醇P(sanggenol P)桑根皮36-37 66桑根酮U(sanggenon U)桑根皮15 67mortatarin D鞑靼桑根皮27 68桑皮酮U(kuwanon U)桑根皮16,36 69nigragenon A黑桑嫩枝20 70nigragenon E黑桑嫩枝20 71sanggenol F黑桑嫩枝20 72nigrasin K黑桑嫩枝20 73nigragenon D黑桑嫩枝20 74sanggenol H黑桑嫩枝20 75nigragenon B黑桑嫩枝20 76nigragenon C黑桑嫩枝20 77桑根酮A(sanggenon A)桑根皮30 78桑根酮B(sanggenon B)桑根皮38 79桑根醇L(sanggenol L)桑根皮28 80morusalnol B桑根皮35 81桑根酮F(sanggenon F)桑根皮21,28 82桑根酮N(sanggenon N)桑根皮28 83桑皮酮F(kuwanon F)桑根皮12 84桑根酮H(sanggenon H)桑根皮、黑桑根17 85桑根酮醇O(sanggenol O)桑根皮28 86dicyclokuwanon E桑根皮16
1.3 其他类型
除了黄酮类和二氢黄酮类之外,桑属植物中还发现了少量的异黄酮类、查耳酮类和双黄酮类化合物。其中,双黄酮类化合物大多是由黄酮或二氢黄酮结构中的异戊烯基与查耳酮结构中的α,β位的双键通过Diels-Alder反应所形成,少数由2分子的二氢黄酮通过醚键形成。目前已报道的双黄酮类化合物有17个(化合物93~109)。而异黄酮和查耳酮类化合物的异戊烯基大多以链状形式存在。该类型化合物的化学结构见图4,具体信息见表3。
2 药理作用
2.1 抗菌和杀虫
桑属植物中的多种异戊烯基黄酮活性成分对金黄色葡萄球菌等有一定的抗菌活性。Wu等[31]发现化合物12、33、94和95能够通过增加膜渗透性和耗散质子动力对多种耐甲氧西林金黄色葡萄球菌(methicillin-resistant, MRSA)表现出较高的抗菌活性,结构中的环己烯-苯基酮和异戊烯基是其主要活性基团。化合物94能够通过形成氢键和静电相互作用靶向作用于细胞膜上的磷脂酰甘油和心磷脂,表现出快速的杀菌活性,且不易产生耐药性。此外,化合物8、12、13、33、95还对粪肠球菌和耐万古霉素肠球菌具有很好的抑制活性,且其抗菌活性优于标准抗生素氨苄青霉素和环丙沙星[45],提示结构中某些核心基团对抗菌活性至关重要。研究发现,不同位置的异戊烯基黄酮类化合物如12、13对MRSA具有相同活性,具有改良C-3戊烯基的化合物36抗菌活性明显弱于未改良化合物33,化合物30、80在B环上引入1个烯丙基环化,其抗菌活性表现不活跃,这些足以证明异戊烯基的重要性。Zuo等[46]研究发现化合物33、56不仅具有抗甲氧西林敏感金黄色葡萄球菌(meticillin sensitive,MSSA)和MRSA的活性,并且与部分常规抗菌药物联合使用对MRSA和MSSA表现出不同程度的协同作用;化合物36单独使用时活性较弱,但与阿米卡星、环丙沙星、万古霉素和链霉素的协同作用很好,可进一步作为联合用药的候选药物。桑属植物中的异戊烯基黄酮还具有一定的杀虫活性。从桑的根皮中分离得到的化合物94和102能够通过破坏细胞膜,杀灭寄生在淡水鱼鳃和皮肤上的重要纤毛虫,减轻嗜水气单胞菌感染,具有成为安全有效的鱼鳞病防治药物的潜力[47]。

图4 桑属植物中其他类型异戊烯基取代黄酮化合物的化学结构
表3 桑属植物中其的他类型异戊烯基取代黄酮化合物
Table 3 Other prenylated flavonoids from Morus plants
编号化合物名称来源文献 87kenusanone A桑根皮23,39 88tetrapterol A桑根皮24 89摩查耳酮A(morachalcone A)桑嫩枝22 90异补骨脂查耳酮(isobavachalcone)桑果实40-41 91morachalcone B桑叶40 92morachalcone C桑叶40 93australone B鸡桑皮层42 94桑皮酮G(kuwanon G)桑根皮31 95桑皮酮H(kuwanon H)桑根皮31 96moracenin D鸡桑根14 97guangsangon G奶桑茎皮43 98guangsangon I奶桑茎皮43 99guangsangon F奶桑茎皮43 100guangsangon H奶桑茎皮43 101桑皮酮L(kuwanon L)桑根皮16 102桑皮酮O(kuwanon O)桑根皮16 103桑根酮G(sanggenon G)桑根皮38 104桑根酮C(sanggenon C)桑根皮38 105桑根酮D(sanggenon D)桑根皮38 106桑根酮E(sanggenon E)桑根皮、黑桑根17 107桑皮酮J(kuwanon J)奶桑茎皮43 108ramumorin A桑嫩枝13 109chalcomoracin桑叶44
2.2 抗炎
桑属植物具有抗炎作用,异戊烯基黄酮是其主要活性成分。Kavitha等[48]证实化合物41可以通过抑制细胞因子的形成,表现出抗炎活性。化合物13和77能够明显抑制脂多糖诱导的小胶质细胞和巨噬细胞中一氧化氮(nitric oxide,NO)的产生,表现出显著的抗炎活性[49]。Wu等[50]对桑根皮提取物进行抗炎实验研究,发现化合物78和105对脂多糖刺激的小鼠单核细胞RAW264.7巨噬细胞产生NO有抑制作用,其分子机制是通过减少促炎细胞因子和介质的产生,并降低诱导型NO合酶和环氧化酶-2的表达,为新型抗炎药物发现提供潜在的天然来源。化合物104能够抑制醋酸所致小鼠腹腔毛细血管通透性的增加以及足肿胀,减少中性粒细胞浸润及抑制各种炎症反应介质的生成和释放,改善小鼠的急性炎症反应[51]。Zhao等[52]发现化合物104可下调促炎因子(肿瘤坏死因子-α、白细胞介素-1β、白细胞介素-6)水平,上调心肌细胞缺氧时抗氧化酶的活性,可通过抑制心脏炎症反应,显著改善主动脉束带引起的心肌肥厚、纤维化及收缩舒张功能恶化,治疗1周可减少炎症和氧化反应,抑制脑内细胞凋亡。此外,化合物12、33、36、56和79也被证实具有一定的抗炎活性[18,53]。以上数据均表明,桑属植物的抗炎活性与其所含异戊烯基黄酮类化合物关系密切。这些研究从多途径深入探讨了各种抗炎机制之间相互影响协作,为异戊烯基黄酮类化合物的活性研究提供理论依据。
2.3 抗肿瘤
桑属植物含有的异戊烯基黄酮类化合物,对肝癌细胞、巨噬细胞、结肠癌细胞、结直肠癌细胞等均具有细胞毒性,表现很好的抗癌活性,其作用机制多样。化合物30、33和35通过阻滞细胞周期于G2/M期和抑制拓扑异构酶II活性来发挥体外抗肝癌活性[54]。化合物33还可以显著抑制人结直肠癌HT-29细胞的生长和克隆原性[55]。化合物41是通过阻断核因子-κB从人单核细胞系来源的巨噬细胞THP-1的胞质转位到细胞核来发挥其抗癌作用,被确定为肿瘤坏死因子R基因表达和分泌的有效抑制剂[56]。化合物21和109能够诱导凋亡和抑制癌细胞的生长,对人结肠癌HCT-15细胞和乳腺癌MCF-7细胞等有细胞毒活性[7,57]。化合物104对游离脂肪酸诱导的人肝癌HepG2细胞脂质蓄积具有改善作用,并且能够显著抑制黑色素瘤和肝癌细胞的生长和增殖,可以作为候选抗癌药物使用[58-59]。化合物103通过激活胱天蛋白酶3和抑制核糖体蛋白L5介导的基因来诱导细胞凋亡,且化合物103增强了与阿霉素共同作用的凋亡效应,具有与阿霉素联合使用的可能[60]。此外,Smejkal等[61]对从桑属植物中分离得到的化合物56和68进行了7种不同人细胞系的细胞毒活性试验,结果证实异戊烯基黄酮类化合物比普通黄酮表现出更强的细胞毒活性。细胞毒实验证明化合物8、22、33、36、79表现出对人原髓细胞白血病细胞、海拉细胞系、肝母细胞瘤、人非小细胞肺癌细胞和人胃腺癌细胞种人肿瘤细胞系的细胞毒活性[18]。桑属植物中具有抗肿瘤活性的异戊烯基黄酮类化合物种类多样,细胞毒实验充分验证异戊烯基的存在显著增强了该类化合物的抗肿瘤活性,并且部分化合物还具有联合用药的潜能,可开发为联合抗肿瘤的候选药物。
2.4 抗病毒
桑属植物中的黄酮类化合物被证明对单纯疱疹病毒、鼻病毒、轮状病毒、人体免疫缺陷病毒和各种呼吸道病毒表现出很好的抑制活性。体外抗病毒研究证明,化合物94可能通过抑制人冠状病毒229E包膜病毒的配体来抑制病毒与宿主细胞结合位点的相互作用,能够抑制或阻止产生新冠状病毒(严重急性呼吸系统综合征冠状病毒2)的菌株[62],为抗人类冠状病毒的研究提供了一种创新药物疗法的替代方案。此外,化合物101对副流感病毒、流感病毒、呼吸道合胞病毒、腺病毒Ⅲ和单纯疱疹病毒-1(herpes simplex virus-1,HSV-1)等均具有很好的抑制活性[63]。Kim等[64]发现化合物33可通过降低被HSV-1感染的细胞和线粒体活性氧水平来抑制HSV-1的复制,提高感染HSV-1的非洲绿猴肾细胞的存活率。化合物12、13、56、68对HSV-1和HSV-2的复制具有抑制活性,构效关系表明含有2个异戊烯基的化合物13活性最高,其次是具有相似结构的化合物12[45]。
2.5 降血压
桑白皮具有降血压的功效[65],异戊烯基黄酮是其主要活性成分。化合物33、94、95、104、105具有显著的降压作用,且其降压作用均呈剂量相关性[66-67]。化合物33和93能够浓度相关性地抑制肾上腺素及花生四烯酸等诱发的血小板聚积;并通过抑制环磷酸腺苷磷酸二酯酶的活性达到降压作用[42,67]。化合物94、95、104、105的降压机制主要包括2个方面:(1)通过促进血管结构型NO合酶的合成来增加血管NO含量,从而引起血管舒张,最终达到降血压效果[68];(2)通过抑制12-羟基-5,8,10-十七碳三烯酸和血栓素B的形成,从而达到降血压效果[69]。有关桑属植物中异戊烯基黄酮类化合物的降压作用研究相对较少,其主要降压机制还有待进一步明确。
2.6 降血糖
桑叶具有很好的降血糖的功效[70],其降糖作用与异戊烯基黄酮关系密切。Liu等[71]证实化合物43和85具有α葡萄糖苷酶抑制活性,有助于降低餐后血糖水平。过氧化物酶体增殖物激活受体γ(peroxisome proliferater-activated receptor γ,PPARγ)主要表达于脂肪组织及免疫系统,与胰岛素抵抗关系密切,是一个重要的抗糖尿病靶点。化合物71和72具有PPARγ激动作用[20]。Zhang等[27]经实验研究证实化合物1、4、5、12、13、18、24、26、67、68均表现出一定程度的α-葡萄糖苷酶抑制活性,其中化合物4、67、68抑制活性最强,化合物1、5、12、13、18为中等抑制活性,通过构效关系研究发现1个额外的异戊烯基基团提高了对α-葡萄糖苷酶的抑制作用。Kwon等[72]通过分子对接和酶动力学等研究显示化合物12、94对α-葡萄糖苷酶具有良好的抑制作用,其半数抑制浓度为1.44~47.35 µmol/L。以上表明,异戊烯基的存在能够显著提高降糖活性,提示异戊烯基对降糖机制的发挥具有重要影响,很有可能是配体结合部位。
2.7 抗氧化
桑属植物中的异戊烯基黄酮类成分在抑制氧化应激方面发挥极其重要作用,具有很强的抗氧化能力。Mazimba等[73]测定了单体化合物清除1,1-二苯基-2-三硝基苯肼自由基的活性,发现化合物12、30、33自由基清除活性依次降低,推测化合物30活性较低是因为其结构中C-3异戊二烯基被环化,化合物33活性最强是因为C-8丙烯基的环化增加了33的共轭效应。Martins等[74]发现化合物33与其他活性物质通过协同作用发挥抗氧化活性,且抗氧化活性具有浓度相关性。在研究抗氧化作用时,值得注意的是异戊烯基是否环化及共轭效应对其活性的影响,由于该方面研究相对较少,其机制及作用靶点尚未明确,抗氧化作用方面也有待进一步研究。
2.8 抗骨质疏松
异戊烯基黄酮类化合物104和105能够有效地抑制破骨细胞并促进成骨细胞分化,可以激活分泌型糖蛋白/β-连环蛋白(Wnt/β-catenin)信号通路中Runt相关转录因子2,表现出良好的抗骨质疏松作用[75]。刘芬等[76]进一步证实桑白皮中异戊烯基黄酮类化合物104能促进小鼠成骨细胞MC3T3-E1增殖、分化和矿化,其机制可能与Wnt/β-catenin信号通路中的Runt相关转录因子2蛋白表达有关。以上结果表明,桑属植物中的异戊烯基黄酮类成分是其抗骨质疏松的药效成分之一。
3 结语与展望
桑属植物药用历史悠久,且药用价值广泛,是一种具有很大应用前景的中药资源。黄酮类化合物是其主要活性成分之一,异戊烯基取代的黄酮显著增强了黄酮类化合物的活性。因其异戊烯基的疏水特性导致化合物更大的脂水分配系数,提高其成药性,然而桑属植物中的异戊烯基黄酮类化合物的研究开发依旧有很多制约因素,大部分化合物的药理研究仅停留在细胞活性筛选上,尚未开展深入的药理机制研究,且其被认为是多靶点药物,大部分药理作用靶点尚不明确,还有一部分的药理作用研究也相对较少如抗氧化作用。因此,加强对桑属植物中异戊烯基黄酮类化合物的深入研究对于阐释桑属植物的药用价值显得十分必要。根据构效关系,了解到异戊烯基的种类、数目、位置等与黄酮类化合物的药理活性相关,它甚至决定着部分黄酮类化合物活性的强弱,对部分活性弱的化合物进行结构修饰也是有必要的。今后应对已筛选出的桑属植物中活性较强的异戊烯基黄酮类化合物的药理机制及作用靶点、构效关系等进一步的研究,明确其机制及靶点,为其药动学及临床研究提供依据。本文对桑属植物中异戊烯基黄酮类化合物及药理作用进行总结,以期为此类化合物的深入研究提供帮助,也为桑属植物药效物质研究提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 夏明炯. 桑树的分类及研究简史 [J]. 中国蚕业, 2015, 36(3): 7-13.
[2] 宿树兰, 段金廒, 欧阳臻, 等. 我国桑属 (L.) 药用植物资源化学研究进展 [J]. 中国现代中药, 2012, 14(7): 1-6.
[3] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 2006: 6.
[4] 尚志钧校注. 神农本草经校注 [M]. 北京: 学苑出版社, 2008.
[5] 中国药典 [S]. 一部. 2020: 310.
[6] 钟熙, 杨鹤, 柯晓雪, 等. 桑树化学成分及药理活性研究进展 [J]. 中国中药杂志, 2022, 47(9): 2373-2391.
[7] 陈积常, 黄初升, 刘红星, 等. 具有生物活性的异戊烯基及香叶基黄酮类化合物 [J]. 化工技术与开发, 2013, 42(1): 12-17.
[8] Hawari D, Mutakin M, Wila G,. Flavonoids of,, and(Moraceae): A review on their antioxidant activity and the influence of climate on their biosynthesis [J]., 2021: 45-64.
[9] 李炳钦. 新疆药桑叶化学成分和生物活性研究 [D]. 阿拉尔: 塔里木大学, 2019.
[10] 李明. 桑叶和桑枝的化学成分及生物活性研究 [D]. 济南: 山东大学, 2017.
[11] Huang Q H, Lei C, Wang P P,. Isoprenylated phenolic compounds with PTP1B inhibition from[J]., 2017, 122: 138-143.
[12] Guo Y Q, Tang G H, Lou L L,. Prenylated flavonoids as potent phosphodiesterase-4 inhibitors from: Isolation, modification, and structure-activity relationship study [J]., 2018, 144: 758-766.
[13] Tran H N K, Nguyen V T, Kim J A,. Anti-inflammatory activities of compounds from twigs of[J]., 2017, 120: 17-24.
[14] Yan J J, Ruan J Y, Huang P J,. The structure-activity relationship review of the main bioactive constituents ofgenus plants [J]., 2020, 74(2): 331-340.
[15] Jung J W, Park J H, Lee Y G,. Three new isoprenylated flavonoids from the root bark of[J]., 2016, 21(9): 1112.
[16] Zhu M, Wang Z J, He Y J,. Bioguided isolation, identification and bioactivity evaluation of anti-MRSA constituents fromLinn. [J]., 2021, 281: 114542.
[17] Li M, Wu X W, Wang X N,. Two novel compounds from the root bark ofL. [J]., 2018, 32(1): 36-42.
[18] Qin J, Fan M, He J,. New cytotoxic and anti-inflammatory compounds isolated fromL. [J]., 2015, 29(18): 1711-1718.
[19] Chan E W C, Lye P Y, Wong S K. Phytochemistry, pharmacology, and clinical trials of[J]., 2016, 14(1): 17-30.
[20] Xu L J, Yu M H, Huang C Y,. Isoprenylated flavonoids fromand their PPARγ agonistic activities [J]., 2018, 127: 109-114.
[21] Yang Z G, Matsuzaki K, Takamatsu S,. Inhibitory effects of constituents fromvar.on differentiation of 3T3-L1 cells and nitric oxide production in RAW264.7 cells [J]., 2011, 16(7): 6010-6022.
[22] Ha M T, Tran M H, Ah K J,. Potential pancreatic lipase inhibitory activity of phenolic constituents from the root bark ofL. [J]., 2016, 26(12): 2788-2794.
[23] Tran P L, Tran P T, Tran H N K,. A prenylated flavonoid, 10-oxomornigrol F, exhibits anti-inflammatory effects by activating the Nrf2/heme oxygenase-1 pathway in macrophage cells [J]., 2018, 55: 165-173.
[24] Ram, Singh E, Bagachi A,. Traditional uses, phytochemistry and pharmacology ofLinn.: A review [J]., 2013, 7: 461-469.
[25] Qu K J, Wang B, Jiang C S,. Rearranged Diels-alder adducts and prenylated flavonoids as potential PTP1B inhibitors from[J]., 2021, 84(8): 2303-2311.
[26] Ma G Q, Chai X Y, Hou G G,. Phytochemistry, bioactivities and future prospects of mulberry leaves: A review [J]., 2022, 372: 131335.
[27] Zhang Y L, Luo J G, Wan C X,. Four new flavonoids with α-glucosidase inhibitory activities fromvar.[J]., 2015, 12(11): 1768-1776.
[28] Jung J W, Ko W M, Park J H,. Isoprenylated flavonoids from the root bark ofand their hepatoprotective and neuroprotective activities [J]., 2015, 38(11): 2066-2075.
[29] Du J, He Z D, Jiang R W,. Antiviral flavonoids from the root bark ofL. [J]., 2003, 62(8): 1235-1238.
[30] Nomura T, Fukai T, Hano Y. Constituents of the Chinese crude drug “sāng-bái-pí” (root bark) [J]., 1983, 47(1): 30-34.
[31] Wu S C, Han F, Song M R,. Natural flavones fromagainst methicillin-resistantvia targeting the proton motive force and membrane permeability [J]., 2019, 67(36): 10222-10234.
[32] Dat N T, Binh P T X, Quynh L T P,. Cytotoxic prenylated flavonoids from[J]., 2010, 81(8): 1224-1227.
[33] Wang L, Yang Y, Liu C,. Three new compounds fromL. [J]., 2010, 12(6): 431-437.
[34] Wang L, Cui X Q, Gong T,. Three new compounds from the barks of[J]., 2008, 10(9/10): 897-902.
[35] Ha M T, Shrestha S, Tran T H,. Inhibition of PTP1B by farnesylated 2-arylbenzofurans isolated fromroot bark: Unraveling the mechanism of inhibition based onandstudies [J]., 2020, 43(9): 961-975.
[36] Kollar P, Bárta T, Keltošová S,. Flavonoid 4′--methylkuwanon E frominduces the differentiation of THP-1 human leukemia cells [J]., 2015, 2015: 251895.
[37] 耿长安, 姚淑英, 薛多清, 等. 桑白皮中1个新的异戊二烯基取代黄酮[J]. 中国中药杂志, 2010, 35(12): 1560-1565.
[38] Grienke U, Richter M, Walther E,. Discovery of prenylated flavonoids with dual activity against influenza virus and[J]., 2016, 6: 27156.
[39] Sohn H Y, Son K H, Kwon C S,. Antimicrobial and cytotoxic activity of 18 prenylated flavonoids isolated from medicinal plants:L.,Schneider,(L.) Vent,Ait andNakai [J]., 2004, 11(7/8): 666-672.
[40] Chen C, Mohamad Razali U H, Saikim F H,.L. plant: Bioactive compounds and potential as a functional food ingredient [J]., 2021, 10(3): 689.
[41] Seo K H, Lee D Y, Jeong R H,. Neuroprotective effect of prenylated arylbenzofuran and flavonoids fromfruits on glutamate-induced oxidative injury in HT22 hippocampal cells [J]., 2015, 18(4): 403-408.
[42] Ko H H, Wang J J, Lin H C,. Chemistry and biological activities of constituents from[J]., 1999, 1428(2/3): 293-299.
[43] Dai S J, Ma Z B, Wu Y,. Guangsangons F-J, anti-oxidant and anti-inflammatory Diels-alder type adducts, fromMiq [J]., 2004, 65(23): 3135-3141.
[44] Chan E W C, Wong S K, Tangah J,. Phenolic constituents and anticancer properties of(white mulberry) leaves [J]., 2020, 18(3): 189-195.
[45] Čulenová M, Sychrová A, Hassan S T S,. Multiplebiological effects of phenolic compounds fromroot bark [J]., 2020, 248: 112296.
[46] Zuo G Y, Yang C X, Han J,. Synergism of prenylflavonoids fromroot bark against clinical MRSA isolates [J]., 2018, 39: 93-99.
[47] Liang J H, Fu Y W, Zhang Q Z,. Identification and effect of two flavonoids from root bark ofagainstin grass carp [J]., 2015, 63(5): 1452-1459.
[48] Kavitha Y, Geetha A. Anti-inflammatory and preventive activity of white mulberry root bark extract in an experimental model of pancreatitis [J]., 2018, 8(4): 497-505.
[49] Ko W, Liu Z M, Kim K W,. Kuwanon T and sanggenon a isolated fromexert anti-inflammatory effects by regulating NF-κB and HO-1/Nrf2 signaling pathways in BV2 and RAW264.7 cells [J]., 2021, 26(24): 7642.
[50] Wu Y X, Kim Y J, Kwon T H,. Anti-inflammatory effects of mulberry (L.) root bark and its active compounds [J]., 2020, 34(12): 1786-1790.
[51] 周萍, 董晓先, 汤平. 桑根酮C抗炎作用实验研究 [J]. 广州医科大学学报, 2017, 45(3): 10-14.
[52] Zhao Y L, Xu J F. Sanggenon C ameliorates cerebral ischemia-reperfusion injury by inhibiting inflammation and oxidative stress through regulating RhoA-ROCK signaling [J]., 2020, 43(4): 1476-1487.
[53] Zelová H, Hanáková Z, Čermáková Z,. Evaluation of anti-inflammatory activity of prenylated substances isolated fromand[J]., 2014, 77(6): 1297-1303.
[54] Rafiq I, Buhroo Z I, Nagoo S A. Mulberry (.): A versatile tree with inherent bioactive compounds of promising pharmaceutical and nutraceutical properties [J]., 2019, 8(1): 731-738.
[55] Lee J C, Won S J, Chao C L,. Morusin induces apoptosis and suppresses NF-kappaB activity in human colorectal cancer HT-29 cells [J]., 2008, 372(1): 236-242.
[56] Hošek J, Bartos M, Chudík S,. Natural compound cudraflavone B shows promising anti-inflammatory properties[J]., 2011, 74(4): 614-619.
[57] Deepa M, Sureshkumar T, Satheeshkumar P K,. Antioxidant richleaf extract induces apoptosis in human colon and breast cancer cells by the downregulation of nitric oxide produced by inducible nitric oxide synthase [J]., 2013, 65(2): 305-310.
[58] 邢菊玲, 刘芬, 冯萌, 等. 桑根酮C对游离脂肪酸诱导人肝癌HepG2细胞脂质蓄积的改善作用 [J]. 中国药房, 2021, 32(15): 1868-1873.
[59] 王艺, 李妍, 谢天平, 等. 桑根酮C体内外抗肿瘤作用研究 [J]. 石河子大学学报: 自然科学版, 2019, 37(4): 524-528.
[60] Park J E, Jung J H, Lee H J,. Ribosomal protein L5 mediated inhibition of c-Myc is critically involved in sanggenon G induced apoptosis in non-small lung cancer cells [J]., 2021, 35(2): 1080-1088.
[61] Smejkal K, Svacinová J, Slapetová T,. Cytotoxic activities of several geranyl-substituted flavanones [J]., 2010, 73(4): 568-572.
[62] Thabti I, Albert Q, Philippot S,. Advances on antiviral activity ofspp. plant extracts: Human coronavirus and virus-related respiratory tract infections in the spotlight [J]., 2020, 25(8): 1876.
[63] 张国刚, 黎琼红, 叶英子博, 等. 桑白皮抗病毒有效成分的提取分离及体外抗病毒活性研究 [J]. 沈阳药科大学学报, 2005, 22(3): 207-209.
[64] Kim T I, Kwon E B, Oh Y C,.and its major component morusin inhibit herpes simplex virus type 1 replication and the virus-induced reactive oxygen species [J]., 2021, 49(1): 163-179.
[65] Chang B Y, Koo B S, Kim S Y. Pharmacological activities forL., focusing on the immunostimulatory property from the fruit aqueous extract [J]., 2021, 10(8): 1966.
[66] Nomura T. Chemistry and biosynthesis of prenylflavonoids [J]., 2001, 121(7): 535-556.
[67] 杨爽, 王宝莲, 李燕. 植物桑的药理研究进展 [J]. 药学学报, 2014, 49(6): 824-831.
[68] 冯冰虹, 苏浩冲, 杨俊杰. 桑白皮丙酮提取物舒张血管作用机制研究 [J]. 中药新药与临床药理, 2005, 16(4): 247-250.
[69] Kimura Y, Okuda H, Nomura T,. Effects of phenolic constituents from the mulberry tree on arachidonate metabolism in rat platelets [J]., 1986, 49(4): 639-644.
[70] 买买提依明, 卢红, 木合达尔, 等. 新疆药桑的有效成分测定及药理作用的研究初报 [J]. 北方蚕业, 2006, 27(4): 16-18.
[71] Liu B R, Yan T N, Xiao J,. Α-Glucosidase inhibitors and antioxidants from root bark of[J]., 2018, 10(3): 331-335.
[72] Kwon R H, Thaku N, Timalsina B,. Inhibition mechanism of components isolated frombranches on diabetes and diabetic complications via experimental and molecular docking analyses [J]., 2022, 11(2): 383.
[73] Mazimba O. Antioxidant and antibacterial constituents from[J]., 2011, 5(6): 751-754.
[74] Martins B A, Sande D, Solares M D,. Antioxidant role of morusin and mulberrofuran B in ethanol extract ofroots [J]., 2021, 35(24): 5993-5996.
[75] 邢菊玲, 党院霞, 刘芬, 等. 桑白皮总黄酮联合知母总皂苷改善高脂血症伴骨质疏松症大鼠的作用机制 [J]. 中国实验方剂学杂志, 2021, 27(2): 37-43.
[76] 刘芬, 党院霞, 邢菊玲, 等. 基于分子对接的方法探讨桑根酮C对MC3T3-E1细胞的作用 [J]. 中国实验方剂学杂志, 2020, 26(10): 44-50.
Research progress on prenylated flavonoids fromplants and their pharmacological activities
JIANG Yue, LIU Yang-yang, TIAN Hai-tao, DENG Zhi-peng
School of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China
plants in Moraceae family are widely distributed in our country with high value for the medicinal uses of their branches, leaves, root bark, and fruits. At present, chemical constituents isolated fromplants mainly are flavonoids, alkaloids, coumarins, terpenes, polysaccharides, etc. Among them, prenylated flavonoids are the characteristic components inplants with multiple pharmacological properties, such as antibacterial, anti-inflammatory, antitumor, antiviral, hypotensive, hypoglycemic and antioxidant activities. In this paper, research progress on prenylated flavonoidsfromplants and their pharmacological activities was reviewed, in order to provide references for development and medicinal substances ofplants.
Linn.; prenylated flavonoids; antibacterial; anti-inflammatory; antitumor; antiviral
R282.710.5
A
0253 - 2670(2022)21 - 6948 - 11
10.7501/j.issn.0253-2670.2022.21.033
2022-05-20
山东省自然科学基金资助项目(ZR2019MH051);山东省自然科学基金资助项目(ZR2021QC080)
姜 玥(1999—),女,研究方向为中药分析。E-mail: jiangyuemlt@163.com
邓志鹏(1980—),男,副教授,博士,研究方向为中药分析。E-mail: depon2005@126.com
[责任编辑 崔艳丽]
