添加复合酶制剂和复合菌制剂对凡纳滨对虾免疫指标、抗病力以及肠道和肝胰腺健康的影响
2022-11-04熊莹槐罗晓春钱雪桥黄锦炉刘绪博彭书华
熊莹槐,罗晓春,钱雪桥, 黄锦炉,刘绪博,彭书华
(1.广东海大集团股份有限公司畜牧水产研究中心,农业农村部微生态资源养殖利用重点实验室,广东 广州 511400;2.华南理工大学生物科学与工程学院,广东 广州 510006)
引 言
凡纳滨对虾(Litopenaeusvannamei)又名南美白对虾,是中国和世界范围内三大养殖对虾种类之一[1],具有盐度适应能力强(0.5~50),适温范围广(6~39℃),生长速度快,抗病力强,肉质鲜美等特点,深受消费者喜爱。
近几十年来,随水产养殖业快速发展,作为水生动物饲料主要原料的鱼粉开始出现供应短缺,价格不断上涨,在水生生物饲料中用植物蛋白替代鱼粉已经成为一种流行趋势[2-3]。相对于动物蛋白,虾类无法利用植物蛋白存在的诸多抗营养因子,如植酸盐、大豆抗原蛋白等[4-6]。营养摄入不足和残留饵料对水质的污染会持续损害养殖对虾的健康,对其免疫功能造成损害。
饲料添加复合酶制剂可以显著提高水产动物对饲料植物蛋白的消化吸收能力,甚至在一定程度上可以提高水生动物的免疫能力[7-8]。例如,王国霞等[4]报道饲料添加植酸酶和复合酶可以提高黄颡鱼(Pelteobagrusfulvidraco)抗氧化能力和肠道健康状况。武明欣等[9]发现饲料中木聚糖酶、纤维素酶、淀粉酶或其复合酶的添加可以显著提高刺参的生长和免疫能力。
此外,复合菌制剂在对虾养殖产业中也起到重要作用。随全球对虾市场的不断扩大[10],高密度养殖对虾模式已经被广泛运用[11-12],这使虾持续暴露在人工次优的养殖条件下,水环境污染严重,大量繁殖的有害微生物会进一步影响对虾的生长、发育和健康[13]。饲料益生菌的添加可以在一定程度上缓解养殖弊端,可以抑制肠道致病菌过度生长,有助于调节肠道菌群的平衡,进一步提高宿主的免疫力[14]。
本实验通过在饲料中添加复合酶制剂,复合菌制剂以及复合菌酶制剂来研究复合酶制剂和复合菌制剂对凡纳滨对虾免疫力,肠道和肝脏健康状况以及抗病毒能力的影响,以期为凡纳滨对虾健康养殖提供理论依据。
1 材料与方法
1.1 实验设计
本实验分别设计了1个对照组和3个处理组,其中,A为对照组,基础饲料(主要成分见表1);B为基础饲料+酶制剂(消化酶和非淀粉多糖酶等复合酶);C为基础饲料+复合菌制剂组(复合菌由嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母和粪链球菌构成);D为基础饲料+复合菌酶制剂(主要由嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母和粪链球菌复合菌与消化酶和非淀粉多糖酶等复合酶)。饲料制剂购于欧科拜克生物有限公司(洛阳,河南,中国)。菌酶制剂通过搅拌的方法与饲料均匀混合,B组酶制剂浓度为150 mg/kg,C组复合菌浓度为2×109cfu/g,D组菌、酶浓度分别为2×109cfu/g、150 mg/kg;饲料中添加的菌、酶剂量均为25 g/kg。每个处理组分别设4个重复,每个重复分别放养100尾虾。

表1 基础饲料的主要成分
本实验于广州海鸥岛试验基地进行,将实验用虾养殖在400 L白色塑料桶中。对虾购买运回时养殖用水盐度17。首先进行驯化暂养阶段,暂养时间为10 d。暂养期间保持合适充氧,定时测定水温,定时投喂适量基础饲料,并且将养殖用水的盐度每天提升2,逐渐驯化直到盐度升至养殖用水的自然盐度31。驯化暂养结束后稳定两天,准备进行正式实验。
驯化暂养结束后,将实验用虾饥饿一天。然后选取规格相近,无病无伤、健康活泼的凡纳滨对虾分轮次随机放入16个相同规格的400 L塑料桶中,每次放入对虾10尾,共放10轮即每个养殖桶中共放凡纳滨对虾100尾,在放虾过程中称量并记录每个重复中虾的总重量。然后进行45 d的养殖实验。养殖过程中,使水温保持27 ℃左右,溶氧高于5 mg/L,养殖用水盐度31,酸碱度8.0±0.1。养殖水质使用多功能YSI专业水质分析仪进行测定(Yellow Spring Instrument Co., Yellow Spring, Ohio, USA)。每天于上午8:30及下午5:00定时投喂,每天的投喂量以对虾体重3%~5%为准。每次投喂前分别收集养殖桶底部的残饵、粪便,同时换水1/3~2/3。每天检查并记录对虾的摄食和死亡情况。在45天养殖实验结束后采集对虾血清和肝脏进行指标检测。
养殖实验结束后,在养殖条件不变的情况下将取样后剩余的虾正常饲喂稳定后进行攻毒实验。每个处理3个重复,每个重复15尾虾。稳定饲喂3 d后,开始向每个处理组养殖桶中泼洒副溶血弧菌(所用副溶血弧菌来自海大集团微生物实验室)。具体操作如下:将副溶血弧菌经活化后接种于营养肉汤(NB),28 ℃条件下振荡培养18~24 h,后将培养菌液8 000 g离心5 min,用海水重悬泼洒到各处理养殖桶,使各处理养殖桶中副溶血弧菌的终浓度为1×108cfu/mL。攻毒实验持续两周,攻毒期间养殖条件不变。每天观察记录对虾的活动、摄食及死亡情况。
1.2 样品采集与指标测定
1.2.1 血清等样品采集
养殖周期结束后,对虾饥饿处理一天。使用一次性无菌注射器(1 mL)在对虾腹部血窦中缓慢抽取血淋巴置于1.5 mL无菌离心管中,并置于4 ℃的冰箱过夜。次日用无菌针头捣碎离心管中的血凝块,在4 ℃环境下,3 000 r/min的条件下离心10 min,使用灭菌枪头将血清转移至新的无菌离心管中,之后需保存到-80 ℃冰箱中备用。
1.2.2 血清非特异免疫酶的测定
血清超氧化物歧化酶(Superoxide dismutse, SOD)、碱性磷酸酶(Alkaline phosphatase,AKP)、酸性磷酸酶(Acid phosphatase, ACP)、溶菌酶(Lysozyme, LSZ)均通过南京建成生物工程研究所试剂盒进行检测,具体步骤严格按照说明书的要求进行。
1.2.3 肠道和肝脏切片制作与观察
截取凡纳滨对虾肠道和肝脏,用10%中性福尔马林固定24 h后,纱布包裹组织块缓水冲洗8 h,用梯度酒精逐步冲洗组织块水分。酒精梯度为:70%,2 h;80%,2 h;90%,2 h;95%,1 h;100% Ⅰ,1 h;100% Ⅱ,1 h。然后将组织依次放入1∶1酒精:二甲苯溶液、二甲苯溶液I和二甲苯溶液Ⅱ,分别处理20 min、15 min和15 min。在58 ℃条件下,将处理后的组织依次放入1∶1二甲苯-石蜡混合液、石蜡(软)、石蜡(硬)中分别处理30 min、1 h和1 h。使用切片机对石蜡进行切片,并将切片附着于玻璃板上,于37 ℃烘箱过夜。
选用H.E染色法对切片进行染色,染色温度为35 ℃,染色液为苏木素-伊红染液。染色前,先对切片进行脱腊处理。具体方法详见杨乾等[15]。将制作好的组织切片放于显微镜下观察,并拍照保存。
1.3 数据计算与统计分析
数据使用平均值±标准误(Mean±S.E.)表示。利用SPSS 22.0对凡纳滨对虾以上各指标的变化作单因子方差分析(e-Way ANOVA)和Duncan’s多重比较检验,并以P<0.05作为差异显著水平。
2 结果
2.1 血清免疫指标
如图1—图4所示,饲料复合酶制剂和菌制剂显著提高了凡纳滨对虾血清SOD酶、AKP酶、ACP酶和LSZ酶的活性(P< 0.05),其中饲料单一添加复合菌制剂(C组)的促进效果显著优于单一添加酶制剂(B组)(P< 0.05)。饲料中同时添加复合菌酶制剂(D组)对凡纳滨对虾血清超氧化物歧化酶、酸性磷酸酶的促进效果最好,显著高于单一饲料制剂添加组(P< 0.05)。

图1 不同处理凡纳滨对虾血清超氧化物歧化酶含量情况
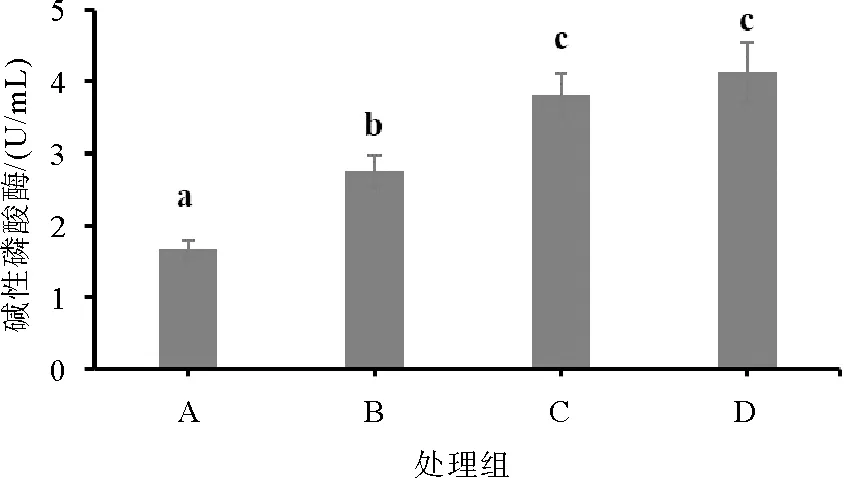
图2 不同处理凡纳滨对虾血清碱性磷酸酶含量情况
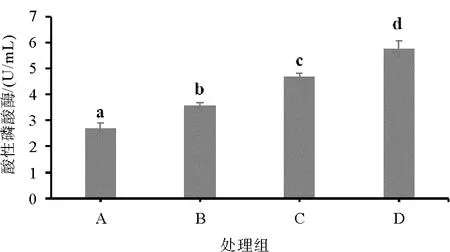
图3 不同处理凡纳滨对虾血清酸性磷酸酶含量情况
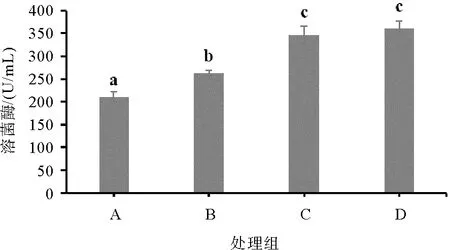
图4 不同处理凡纳滨对虾血清溶菌酶含量情况
2.2 攻毒后死亡情况
在对凡纳滨对虾进行副溶血弧菌攻毒试验后,对虾死亡率在0~8 d逐步上升,在第8天基本稳定。稳定后,对照组A组的死亡率为80%,饲料添加复合酶制剂、菌制剂和菌酶制剂均能降低攻毒后对虾的死亡率,B、C、D组的死亡率分别为61%,45%和28%(图5)。

图5 不同处理凡纳滨对虾攻毒后累计死亡率情况
2.3 肠道和肝脏切片
由组织切片可观察到本实验肠道和肝脏切片染色整体效果较好。相比于对照组(A)和复合酶制剂组(B),复合菌制剂组(C)和复合菌酶制剂组(D)凡纳滨对虾肠道结构完整,肠道上皮层与基膜紧密连接,细胞游离面的微绒毛排列更为整齐、紧密。复合酶制剂组(B)凡纳滨对虾肠道部分上皮层与基膜浮离,个别上皮细胞脱落;对照组(A)凡纳滨对虾肠道结构疏松,肠上皮层与基膜全部浮离,上皮细胞脱落(图6)。
对照组A组凡纳滨对虾肝胰腺部分肝小管坏死或基膜破损,部分B细胞体积增大,数量减少,出现大量R细胞。饲料添加酶制剂和菌制剂均可以改善凡纳滨对虾肝胰腺的健康状态。饲料同时添加菌酶制剂时(D组),凡纳滨对虾肝小管排列较为整齐,较为紧密,B细胞与R细胞数量均较为丰富(图7)。
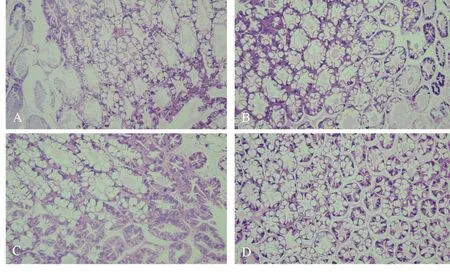
图7 不同处理凡纳滨对虾肝脏切片
3 讨论
添加酶制剂和菌制剂可以显著提高水产动物的生产性能和健康水平已经被广泛报道[13-14,16-17]。本实验结果也表明饲料中添加复合酶制剂(消化酶和非淀粉多糖酶)和复合菌制剂(嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母和粪链球菌)可显著提高凡纳滨对虾的生长性能和免疫能力。饲料菌制剂和酶制剂的添加均可以提高凡纳滨对虾的特定生长率,同时添加菌酶制剂比单独添加酶制剂效果好。
在不良环境下,水生动物会受到刺激产生大量活性氧,如果过量的活性氧未能被机体及时清除,则会严重损害机体的健康,造成免疫损伤[18-20]。水生动物主要依靠SOD等抗氧化酶来分解活性氧[21]。本实验发现,饲料中酶制剂和菌制剂的添加均可以显著提高凡纳滨对虾的SOD酶活性,表明了饲料制剂的添加可以提高对虾的抗氧化能力,且添加菌制剂效果优于酶制剂,同时添加效果最好。
AKP和ACP酶是两种能够将对应底物去磷酸化的酶,对钙质和磷酸钙的形成起到重要作用,是水生动物不可缺少的酶类[22]。本实验结果发现,饲料菌制剂和酶制剂的添加可以显著提高凡纳滨对虾AKP和ACP酶的活性,且同时添加效果最好。此外,卢彤岩等[23]认为ACP和AKP会参与机体代谢和蛋白质的合成,在生物营养吸收上起到重要作用。同样地,本实验也发现ACP和AKP活性高的组凡纳滨对虾的生长性能更好。
LZM是水生动物重要的非特异性免疫因子,主要来源于巨噬细胞,对外源性物质具有相关性破坏作用,可以用来指示水生动物的免疫能力和对寄生虫、细菌以及病毒的抵抗能力[24]。相似地,本研究发现,饲料中菌制剂和酶制剂的添加均可以显著提高凡纳滨对虾的LZM活性,表明饲料制剂的添加显著增强了对虾的免疫性能。通过对凡纳滨对虾的副溶血弧菌攻毒实验进一步印证了此效果:饲料酶制剂和菌制剂的添加均显著提高了凡纳滨对虾在受到副溶血弧菌攻毒后的存活率,且同时添加菌酶制剂效果最好。
组织石蜡切片是组织学常规制片技术中最为广泛应用的方法,是病理学用以研究、观察及判断细胞组织的形态变化的主要方法。本实验通过制作凡纳滨对虾肠道石蜡切片观察到相比于对照组和复合酶制剂组,复合菌制剂组和复合菌酶制剂组凡纳滨对虾肠道细胞与底膜连接紧密,肠细胞形态更为完整,细胞排列整齐紧密,细胞核饱满,说明凡纳滨对虾饲料中添加复合菌制剂和复合菌酶制剂可以促进对虾肠道的发育和健康。这种肠道促进作用可能是来源于饲料中添加的微生物,因为研究结果表明肠道有益菌可以与病菌争夺肠道表面吸附位点、营养物质和能量,还可以通过改变肠道微环境来抑制病菌增长,从而维持肠道平衡和健康[17]。此外,本实验通过制作凡纳滨对虾肝胰腺石蜡切片观察到,对照组A组凡纳滨对虾肝胰腺部分肝小管坏死或基膜破损,部分B细胞体积增大,数量减少,出现大量R细胞。而B、C组基膜相对A组较为完整,说明饲料添加酶制剂和菌制剂均可以改善凡纳滨对虾肝胰腺的健康状态。另外,切片结果显示,饲料同时添加菌酶制剂时(D组),凡纳滨对虾肝小管排列最为整齐、紧密,B细胞与R细胞数量均较为丰富。结合攻毒实验结果来看,D组的存活率最高,而A组最低,说明肝胰腺对凡纳滨对虾生长和健康至关重要,其主要功能是分泌胆汁,进行蛋白质、脂肪、碳水化合物的异化和同化,储存、解毒、产生抗体等[25]。当肝组织出现异常时,这些功能就会受影响甚至丧失。本实验发现,饲料酶制剂和菌制剂可以提高凡纳滨对虾在本养殖条件下肝脏的健康程度,且同时添加具有协同作用,效果更好。
4 结论
本实验发现在饲料中添加复合酶制剂,复合菌制剂可以显著提高凡纳滨对虾的生长性能、免疫水平和抗副溶血弧菌能力。且研究结果表明,凡纳滨对虾饲料中酶制剂和菌制剂起到协同作用,同时添加效果最好。
