海洋红酵母不同添加形式对凡纳滨对虾生长、消化酶活性及免疫相关指标的影响
2022-11-04靳博文李海东田相利刘龙镇李腾飞
靳博文,李海东,2,田相利*,王 波,刘龙镇,何 玉,李腾飞
(1.中国海洋大学 海水养殖教育部重点实验室,山东 青岛 266003;2.浙江海洋大学 水产学院,浙江 舟山 316022)
引 言
凡纳滨对虾(Litopenaeusvannamei),具有抗逆性强、耐盐范围广、环境适应能力强等诸多优点,是我国最主要的对虾养殖品种。但随着凡纳滨对虾的集约化高密度养殖及抗生素等药品的不科学使用,致使养殖环境恶化、耐药性增强、抗生素残留等一系列问题接踵而至,制约了对虾养殖产业的可持续发展。近年来益生菌因其无毒、无污染、安全可靠等优点被广泛关注。益生菌指活菌、无活性的微生物细胞(完整或破碎)或细胞粗提物(含有复杂的化学成分),作用效果因菌株或添加形式的差异而有所不同[1]。研究表明,益生菌作为饲料添加剂,可以提高水产养殖动物的成活率、生长性能、抗病力和改善肠道菌群结构等[2-3]。而益生菌的不同添加形式作为饲料添加剂用于对虾养殖的研究较少,已有报道的有植物乳杆菌的不同添加形式对凡纳滨对虾的生长、消化酶和肠道组织结构的影响[4]。
海洋红酵母(Rhodotorulamucilaginosa)是一种抗逆性强、营养价值高的真菌,其不仅富含水产动物所需的蛋白质、氨基酸、维生素和各种消化酶,而且能产生以虾青素为主的类胡萝卜素从而具有促进抗体产生、增强宿主免疫功能和提高抗病力的功能。因此,对于水产动物来说,海洋红酵母具有很高的营养价值。有研究显示,海洋红酵母作为水产幼苗的开口饵料及作为水产动物益生菌,具有促进水产动物生长、免疫力提高等功能[5]。然而,从已有的研究与应用看,既有以死亡菌体形式添加的,也有以活菌形式进行使用的,尚缺乏对海洋红酵母不同形式添加效果差异的比较研究。本研究比较了活菌、热灭活菌体和超声波破壁菌体的海洋红酵母对凡纳滨对虾生长、消化酶活性、非特异性免疫指标及免疫信号通路相关基因表达量的影响,以期为海洋红酵母在凡纳滨对虾养殖中的使用形式和相关作用机制的研究提供基础。
1 材料和方法
1.1 实验材料
1.1.1 不同添加形式的海洋红酵母
本实验使用的海洋红酵母(编号:RG)来自于中国海洋大学水产养殖生态实验室筛选、保存的菌种。实验所用的海洋红酵母分为三种形式:活菌菌体、破壁菌体以及热灭活菌体。实验菌体准备如下:海洋红酵母基础培养基25 ℃培养48 h后,10 000 rpm/min 离心10 min收集菌体,再用生理盐水制成浓度为1×1010cfu/mL的菌悬液备用。将1×1010cfu/mL的海洋红酵母菌悬液进行超声波破碎(20 min)。热灭活菌(105 ℃灭活)由根源生物集团有限公司处理后提供,用生理盐水制成浓度为1×1010cfu/mL的菌悬液备用。
1.1.2 实验饲料制备
对照组饲料由凡纳滨对虾商品饲料表面直接包裹一层褐藻酸钠(3.15 g/500 g)和鱼油(4.25 mL/500g)制成。实验组饲料按照1×1010cfu/kg比例将活菌菌悬液、热灭活菌粉菌悬液和破碎菌体菌悬液喷洒在凡纳滨对虾商品化饲料表面,揉搓阴干,再在其表面包裹一层褐藻酸钠和鱼油,实验饲料分别标记为HY、HS和PH。
1.2 实验对虾及饲养管理
健康的凡纳滨对虾购自青岛宝荣水产有限公司,养殖用水盐度为17‰左右,在水族箱中驯化暂养,暂养期间每天将养殖用水每天提升2‰的盐度直到30左右,稳定两天用于养殖实验。暂养结束后,对虾进行饥饿处理24 h,然后挑选健康、个体大小均匀的对虾200尾初(初始体重3.57±0.01 g),均匀分配于20个50 L的玻璃缸中,每个玻璃缸中放置10尾。20个玻璃缸随机分为4个实验组,每个组5个重复。实验期间,每天投喂2次,分别为上午8:00和下午5:00各投喂一次,每天的投喂量为对虾体重的4%~5%,每次投喂前用虹吸法吸出残饵和粪便。每天换一次水,换水量为原水位的1/3到2/3左右,水温23 ℃左右,盐度28~30,pH 7.8~8.0,溶氧量5 mg/L以上,每日检查并记录对虾的摄食及死亡情况。
1.3 样品采集及处理
实验结束后,饥饿24 h,称重并记录虾的末体重。分别采取对虾的血淋巴和肝胰腺。用1 mL无菌注射器在对虾的腹部头胸甲处,针头向前抽取对虾体内的血淋巴,将收集的血淋巴置于2 mL的离心管中,4 ℃静置过夜后,5 000 rpm离心10 min收集血清,存于-80 ℃备用。用无菌剪解剖对虾,取出肝胰腺,用无菌剪刀剪成小块,存放于含有RNA保护液的2 mL离心管中,4 ℃放置12 h后,存于-80 ℃保存。
1.4 指标测定
1.4.1 生长指标
为对比整个实验期间的各处理组生长性能,分别在开始实验和结束实验时对各水族箱中的对虾进行体重和数量的统计,并将各处理组在实验期间的投饵量、残饵量,计算各生长指标。
成活率=(实验后对虾数量/实验前放养数量)×100%
增重率(WGR)=(W末-W初)×100%/W初
特定生长率(SGR)=[(lnW末-lnW初)/t]×100%
式中,W末为末体重;W初为初体重。
1.4.2 消化酶活性测定
选取肝胰腺淀粉酶、胰蛋白酶以及脂肪酶作为评价指标。活性测定均使用南京建成生物工程研究所生产的试剂盒测定。
1.4.3 非特异性免疫酶活性测定
免疫酶选取5个指标作为评价标准:超氧化物歧化酶(SOD)、总一氧化氮合酶(TNOS)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)以及溶菌酶(LSZ)活性测定均使用南京建成生物工程研究所生产的试剂盒测定,具体测定方法参照产品说明书。
1.4.4 基因表达
对虾肝胰腺使用RNA提取试剂盒获取总RNA,之后用1%琼脂糖凝胶电泳进行验证,用Nanodrop2000进行总RNA浓度的定量。利用荧光实时定量PCR(qRT-PCR)检测凡纳滨对虾免疫相关基因(Toll,Imd和Relish)的相对表达量。利用q-PCR检测,使用的引物如下:
18S-F:GCCTGAGAAACGGCTACCACATC, 18S-R:GTAGTAGCGACGGGCGGTGTGT
Rel3-F:CCTGTGAAGACATTAGGAGGAGTA, Rel5-R:CCAGTTGTGGCATTCTTTAGG
Toll-F1:TGGACTTCTGCTCGGACAAC, Toll-R1:GTACATGTCCTTGGTCGGCA
Imd-F2:TCACATTGGCCCCGTTATCC, Imd-R2:ATCTCGCGACTGCACTTCAA
1.5 数据统计分析
数据统计分析采用SPSS21软件进行,各处理之间的差异采用单因子方差(one-way ANOVA)分析和Duncan’s多重比较分析,数据结果以平均值±标准误(Mean±SE)表示。
荧光实时定量PCR(qRT-PCR)数据统计分析,使用2-△△CT法(相对定量法)对各目标组基因相对表达量进行分析,结果用平均值±标准误(Mean±SE)表示。
2 结果
2.1 对生长的影响
如表1所示各实验组对虾的末体重、特定生长率、增重率均显著高于对照组(P<0.05)。饲料中添加三种形式的海洋红酵母均可促进凡纳滨对虾的生长,但添加热灭活和破壁酵母处理对虾的生长更佳(P<0.05)。各处理组对虾成活率均在90%以上,与对照组之间差异不显著(P<0.05)。
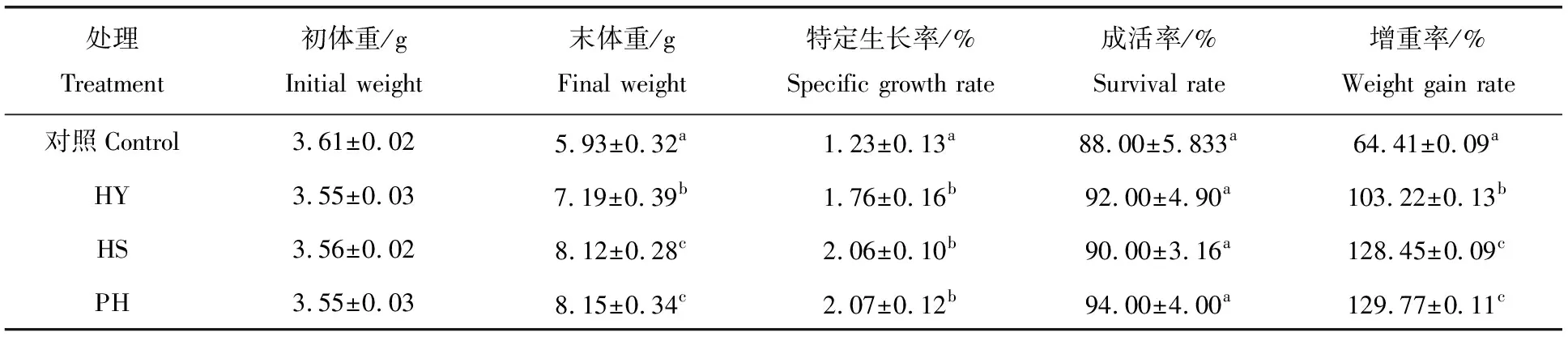
表1 凡纳滨对虾的生长、特定生长率、成活率和增重率
2.2 对肝胰腺消化酶活性的影响
2.2.1 淀粉酶
如图1所示,饲料中添加不同形式的海洋红酵母均可以显著提高对虾肝胰腺中淀粉酶活性(P<0.05),实验组对虾的肝胰腺中淀粉酶活性显著高于对照组(P<0.05),但各实验组之间没有显著差异(P>0.05)。
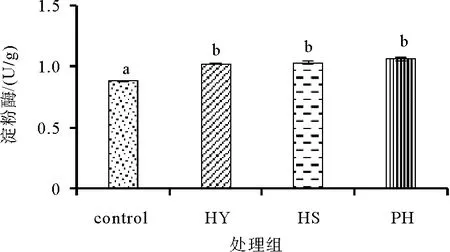
图1 饲料中添加不同形式海洋红酵母对凡纳滨对虾淀粉酶活性的影响
2.2.2 胰蛋白酶
如图2所示,饲料中添加不同形式的海洋红酵母均可以显著提高对虾肝胰腺中胰蛋白酶活性(P<0.05),其中PH组对虾的肝胰腺中胰蛋白酶活性最高,显著高于其他实验组(P<0.05);HY组和HS组对虾的肝胰腺中胰蛋白酶活性显著高于对照组(P<0.05)。
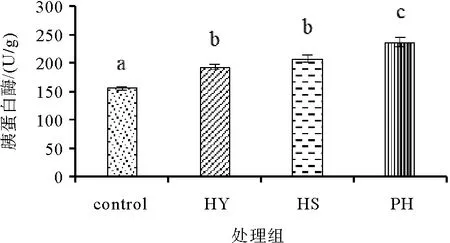
图2 饲料中添加不同形式海洋红酵母对凡纳滨对虾胰蛋白酶活性的影响
2.2.3 脂肪酶
由图3可知,饲料中添加不同形式的海洋红酵母均可以显著提高对虾肝胰腺中脂肪酶活性(P<0.05),其中对虾肝胰腺中脂肪酶活性在PH组达到最大值,显著高于对照组和HY组(P<0.05);HY和HS组之间的对虾肝胰腺中脂肪酶活性没有显著差异(P>0.05),但均显著高于对照(P<0.05)。

图3 饲料中添加不同形式海洋红酵母对凡纳滨对虾脂肪酶活性的影响
2.3 对非特异性免疫酶的影响
2.3.1 超氧化物歧化酶
由图4可知,饲料中添加不同形式的海洋红酵母可以显著提高凡纳滨对虾的血清超氧化物歧化酶(SOD)活性。其中,PH与HY组差异不显著(P>0.05),但均显著高于HS组(P<0.05)。

图4 饲料中添加不同形式海洋红酵母对凡纳滨对虾超氧化物歧化酶的影响
2.3.2 溶菌酶
由图5可知,饲料中添加不同形式的海洋红酵母对凡纳滨对虾的血清溶菌酶(LSZ)活性影响不同。其中,PH组和HY组活性显著高于对照组(P<0.05),HS组略高于对照组,但差异不显著(P>0.05)。
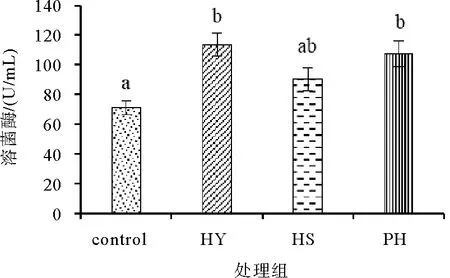
图5 饲料中添加不同形式海洋红酵母对凡纳滨对虾溶菌酶的影响
2.3.3 酸性磷酸酶
由图6可知,饲料中添加不同形式的海洋红酵母对凡纳滨对虾的血清酸性磷酸酶(ACP)活性影响不同。其中,HY组和PH组活性显著高于对照组(P<0.05),PH组显著高于HY组(P<0.05)。

图6 饲料中添加不同形式海洋红酵母对凡纳滨对虾酸性磷酸酶的影响
2.3.4 碱性磷酸酶
由图7可知,饲料中添加不同形式的海洋红酵母对凡纳滨对虾的血清碱性磷酸酶(AKP)活性影响不同。其中,HY组和PH组活性显著高于对照组(P<0.05),但HS组与对照组差异不显著(P>0.05)。

图7 饲料中添加不同形式海洋红酵母对凡纳滨对虾碱性磷酸酶的影响
2.3.5 总一氧化氮合酶
由图8可知,饲料中添加不同形式的海洋红酵母对凡纳滨对虾的血清碱总一氧化氮合酶(TNOS)活性影响不同。其中,PH组活性显著高于其他实验组和对照组(P<0.05),但HY和HS组与对照组差异不显著(P>0.05)。
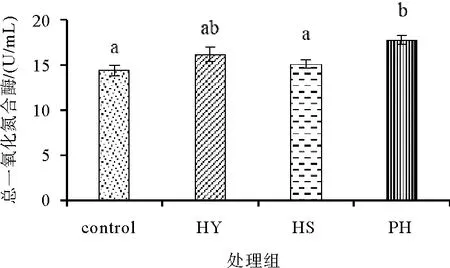
图8 饲料中添加不同形式海洋红酵母对凡纳滨对虾总一氧化氮合酶的影响
2.4 免疫基因在肝胰腺中的表达
2.4.1 Imd基因
由图9可知,饲料中添加不同形式的海洋红酵母对凡纳滨对虾肝胰腺中Imd基因相对表达量影响有所不同。对虾肝胰腺中Imd基因相对表达量在HY组达到最大值显著高于对照组和PH组(P<0.05),但与HS组相比没有显著差异(P>0.05)。
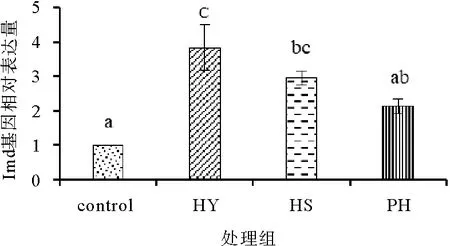
图9 饲料中添加不同形式海洋红酵母对凡纳滨对虾肝胰腺Imd免疫基因相对表达量的影响
2.4.2 Toll基因
饲料中添加不同形式的海洋红酵母对凡纳滨对虾肝胰腺中Toll基因表达量的影响如图10所示,HY组和HS组肝胰腺中Toll基因相对表达量显著高于对照组(P<0.05),PH组与对照组没有显著差异(P>0.05)。
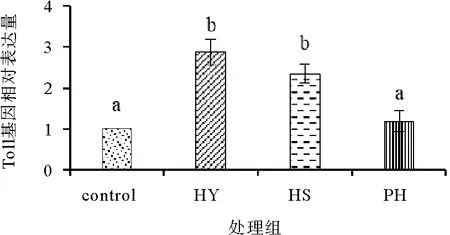
图10 饲料中添加不同形式海洋红酵母对凡纳滨对虾肝胰腺Toll免疫基因相对表达量的影响
2.4.3 对虾肝胰腺Relish基因的表达
由图11可知,饲料中添加不同形式的海洋红酵母对凡纳滨对虾肝胰腺中Relish基因相对表达量影响有所不同,对虾肝胰腺中基因相对表达量在HY组达到最大值,显著高于对照组(P<0.05);HS与PH组与对照组均无显著差异(P>0.05)。
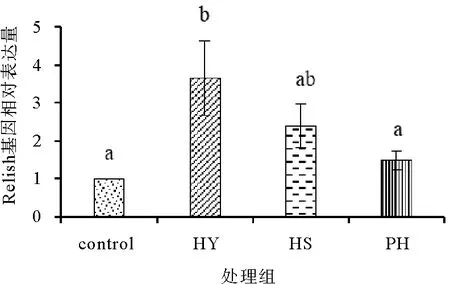
图11 饲料中添加不同形式海洋红酵母对凡纳滨对虾肝胰腺Relish免疫基因相对表达量的影响
3 讨论
3.1 海洋红酵母不同使用形式对凡纳滨对虾生长和消化酶活性的影响
在水产养殖中,益生菌作为饲料添加剂,可显著提高水产养殖动物的成活率、生长性能、抗病力和改善肠道菌群结构等[2-3]。作为提高水产动物免疫力、生长等的益生菌除了革兰氏阳性菌和革兰氏阴性菌外,还有噬菌体、微藻类以及酵母等。而海洋红酵母菌体富含丰富的蛋白质、氨基酸、不饱和脂肪酸、虾青素、β-胡萝卜素、多糖以及其他未知的营养因子,可以提高水产动物的存活率、免疫力、抗病力,改善产品品质,从根本上减少对抗生素的依赖,是生态养殖优良的添加剂。研究表明,海洋红酵母作为饲料添加剂对凡纳滨对虾[6]、卵形鲳鯵(Trachinotusovatus)[7]和刺参(Apostichopusjaponicas)[8]均有良好的促生长作用。Romo-Figueroa等[9]和Zhao等[10]研究发现海洋红酵母可以产生较高的β-葡聚糖,可与肝胰腺中的β-GBP-HDL结合,可能通过合成血淋巴蛋白质增强对虾免疫酶活力,通过促进糖类和脂肪代谢促进对虾的生长。还有研究指出,虾青素对水产动物的生长具有显著促进作用,是对虾早期发育所必需的生长因子[11]。本研究结果表明,活菌体、破壁菌体和灭活菌粉三种不同形式的海洋红酵母作为饲料添加物均能显著提高凡纳滨对虾的末体重和特定生长率,与王计刚等[12]、吕玉华等[13]的研究结果相似,不过三者相比,相对于活菌,饲料中添加热灭活和破壁菌体对对虾的促长作用更佳。
有研究表明,益生菌对凡纳滨对虾的促生长机理可能与益生菌能提高对虾的消化酶活性有关[14]。消化酶活性的高低是衡量养殖生物消化水平高低的重要指标之一。Waché等[15]认为酵母菌能刺激水产养殖动物消化系统的成熟。熊家等[16]报道了饲料中添加3%酵母水解物可以显著提高对虾肝胰腺的淀粉酶活性、淀粉酶活性以及胰蛋白酶活性。杨世平等[17]在饲料中添加沼泽生海洋红酵母,发现添加干酵母粉可以显著提高凡纳滨对虾肝胰腺中蛋白酶和脂肪酶活力,减少其肠道弧菌数,可作为对虾养殖的益生菌。本研究结果表明,添加不同形式的海洋红酵母后均能提高对虾肝胰腺消化酶活性,尤其是肝胰腺胰蛋白酶和淀粉酶活性,这与丁贤等[18]对凡纳滨对虾的研究结果相似。从三种不同的添加形式相比,破壁菌体对胰蛋白酶和脂肪酶活性的促进作用比活菌和热灭活菌体效果更为显著。丁贤等[18]在饲料中添加芽孢杆菌对凡纳滨对虾生长的研究结果中消化酶活性与生长的相关性相对要强,在本研究中消化酶活性与生长之间存在一定的相关性,是否具有明显的正向关系有待进一步验证。
3.2 海洋红酵母不同使用形式对凡纳滨对虾免疫防御因子的影响
已有研究表明,凡纳滨对虾的免疫系统并不完善,主要靠非特异性免疫对外部刺激进行防御[19]。其中,超氧化物歧化酶、溶菌酶、酸性磷酸酶、碱性磷酸酶和总一氧化氮合酶等指标均能体现对虾非特异性免疫能力[20]。超氧化物歧化酶(SOD)是一种可以清除体内多余自由基提高免疫水平的抗氧化物酶,本研究中三个实验组的超氧化物歧化酶活性均明显高于对照组,与Yong等[6]研究结果一致。溶菌酶(LSZ),可以溶解病原菌细胞壁,使其病原菌破裂死亡,从而起到机体防御的功能。本研究中饲料中添加海洋红酵母活菌体和破壁菌体均能显著提高对虾溶菌酶活性,这一实验结果与包鹏云等[8]研究结果相似。酸性磷酸酶(ACP)是巨噬细胞溶酶体的标志酶,巨噬细胞吞噬异物颗粒形成吞噬体,然后用包括ACP在内的溶解酶消化异物颗粒。碱性磷酸酶(AKP)是催化磷酸单脂水解的酶类,与ACP反应机理相似,参与磷酸基团的转移和代谢,同时在动物解毒体系中发挥也起着重要作用。本研究中添加海洋红酵母活菌体和破壁菌体组ACP与AKP活性相较对照组都有显著提高。总一氧化氮合酶(TNOS)可以催化产生NO,进而抑制代谢酶以及与氧自由基结合生成强氧化剂来消灭异物。张春晓等[21]在饲料中添加海洋红酵母,但刺参的NOS只是在一定程度上有所提高,效果并不显著,与本研究结果相似。在本研究中,使用海洋红酵母活菌和破壁菌体组,凡纳滨对虾血清中的酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶等的活性显著高于对照组,均不同程度地提高了免疫防御因子的活性,效果优于热灭活菌体。
研究表明,红酵母可以刺激免疫应答,激活动物体产生体液免疫和细胞免疫。β-葡聚糖可能是产生免疫应答的重要的化合物,但某些其他细胞壁成分或可溶性因子也可起到免疫刺激的作用[22]。王洪斌等[23]利用海洋红酵母多糖提取物注射日本鲟(Charybdisjaponica),48h内其体内免疫活性因子超氧化物歧化酶、酸性磷酸酶、溶菌酶均有不同程度提高,可见其对日本鲟有较强的免疫刺激作用。而刘雨等[24]认为,海洋红酵母可以产生虾青素,虾青素具有很好的抗氧化作用以及提高凡纳滨对虾的免疫力。本研究结果显示,在凡纳滨对虾饲料中添加海洋红酵母破壁菌体,ACP、AKP、SOD等各项免疫指标均显著高于对照组,根据包云鹏等[8]研究显示,口服β-葡聚糖或核苷酸可以增强幼参体腔细胞的吞噬活力或呼吸爆发,以及提高溶菌酶和酚氧化酶活力,推测本研究中酵母菌细胞组分(如葡聚糖或核苷酸)可能有助于免疫刺激作用,更深入的原因有待研究。
3.3 海洋红酵母不同使用形式对肝胰腺免疫基因相对表达量的影响
研究显示,对虾主要细胞免疫和体液免疫识别和破坏病原体,病原体的侵入触发了信号转导通路包括NF-κB信号通路、Toll和IMD通路,从而激活了参与宿主防御的基因,一般认为,抗菌肽作为体液免疫的效应物,在杀死和控制病原微生物方面起着重要作用,也可调节其他免疫反应[25]。许多研究表明,Toll信号通路和Imd信号通路可以调节多种抗菌肽类物质产生[25-26]。在对虾的Imd信号通路中,Imd基因和Relish基因是两个独立过程[27]。研究表明,Relish基因是众多同源抗菌肽类物质产生的调节因子[25]。本研究发现,不同形式的海洋红酵母对对虾肝胰腺Toll、Imd、Relish基因相对表达量具有显著不同的影响。海洋红酵母活菌可以显著提高肝胰腺Toll、Imd、Relish基因相对表达量,但对比起来,添加破碎菌体和热灭活菌体对这几个相关基因相对表达量影响并不显著。考虑到养殖动物机体免疫过程的复杂性,其具体的机制有待进一步深入研究。
4 结论
饲料中添加不同形式的海洋红酵母对凡纳滨对虾的生长、消化酶活性、免疫防疫因子及免疫基因表达的影响存在一定的差异。其中,添加热灭活和破壁菌体对对虾的促长作用更佳,破壁菌体对提高胰蛋白酶和脂肪酶活性更为有效,但热灭活菌体对血清中相关免疫酶活性影响不大,而活菌则显著提高了对虾肝胰腺免疫信号通路Toll、Imd和Relish基因相对表达量。鉴于此,不同形式海洋红酵母对凡纳滨对虾生理生态学影响差异的作用机理以及可能的差异化应用方式值得深入进一步研究。
