氢氧化钠、温水和IBA浸种对华山松幼苗生长和生物量的影响
2022-11-04李小军李莲芳张合瑶周冬梅侯海雄
李小军,李莲芳,顾 梦,张合瑶,刘 娴,周冬梅,侯海雄
(西南林业大学 林学院,云南 昆明 650224)
【研究意义】华山松(Pinus armandi),分布于山西、甘肃、陕西、云南、四川、贵州、湖北、西藏和部分青海地带等,以秦岭为界,分为南方和北方资源区[1]。华山松根系发达,树干通直,冠形优美,材质优良,是其分布区营造防护林、用材林等的速生优良树种,是分布区主要造林树种之一,因其果材兼用,林下可食用野生菌资源丰富,成为高寒山区重要的用材和经济树种[2-3],其人工林良好的培育对分布区,尤其南方种源区经济和社会发展具有重要意义。目前,华山松苗木主要采用种子繁殖[4],虽然在适宜的温湿度条件下,容易发芽,但在场圃条件下,因其种壳坚硬,发芽时间则相对较长。氢氧化钠(NaOH)溶液和温水浸种可软化种壳,促进种子发芽,结合外源激素浸种可促进苗木的生长和生物量的积累。因此,本研究开展NaOH、温水及吲哚丁酸(Indolebutric acid,IBA)浸种对华山松苗木生长和生物量影响的研究,对华山松苗木培育具有重要意义。【前人研究进展】NaOH通常用于种壳坚硬种子的软化处理,其中Na+可降低种皮细胞膜的渗透性,促进种子水分吸收,加速种子发芽,缩短其发芽时间[5-6],在相同的苗木培育期间,为苗木赢得更长的生长和生物量积累时间。温水、NaOH 和IBA 溶液单一浸种已有相关文献。王玮等[7]研究NaOH 对梨(Pyrusspp.)的种子发芽及生长影响,发现其胚根长、假子叶长和宽随NaOH 溶液浓度和浸种时间的增加呈现先增加后减小的趋势;赵明德等[8]研究指出,低浓度的碱性条件下,有利于燕麦(Avena sativa)茎的生长。温水浸种被认为是提高种子发芽和苗木生长最简单、易操作的方法,可缩短发芽时间而间接促进苗木生长。曹志伟等[9]研究指出,温水浸泡长柄扁桃(Amygdalus pedunculata)种子,成苗率和幼苗高径比均较高;张小平等[10]研究表明,温水处理香果树(Emmenopterys henryi)种子,可促进其苗木生长。IBA 是植物生长调节剂,可提高幼苗生长[11]。马宇梅[12]研究表明,IBA 溶液浸泡蒙古栎(Quercus mongolica)种子,可显著促进其苗木生长;袁莲珍等[13]指出,不同浓度的IBA 溶液浸泡杉木(Cunninghamia lanceolata)种子,可显著地促进苗高和地径的生长;王文俊等[14]研究表明,0.25 g/L 的IBA 溶液处理催吐萝芙木(Rauvolfia vomitoric)种子,可显著地促进苗木生长。幼苗生物量是生物有机体的干质量,反映幼苗干物质的积累能力,是壮苗评价的指标之一,幼苗的生物量与壮苗培育紧密相关,生物量越大培育壮苗的潜力越大[15]。生物量较大的苗木,适应环境和利用环境资源能力较强。因此,研究幼苗生物量的积累及其苗木器官的分配规律,是壮苗培育的理论基础[16-18]。相对含水率反映苗木持水能力,亦是适应环境的指标之一[19]。【本研究切入点】NaOH、温水和IBA单一处理种子,可缩短种子发芽时间,通过加快细胞分裂和伸长等方式从而促进苗木生长,但结合此3种物理、化学和生物方法共同处理华山松苗木种子的研究则较少涉及。【拟解决的关键问题】本研究对当年采收的华山松种子,采用NaOH 溶液、温水和IBA溶液浸种,了解实验因素水平及处理组合对华山松幼苗生长、生物量积累和含水量的影响,从而为实生苗培育提供种子预处理的科学依据。
1 试验材料与方法
1.1 试验材料
华山松种子于2020年在会泽县驾车乡的优良林分内采集,此地区年平均气温10.2 ℃,年平均降雨量1 480 mm[20]。此批种子的千粒质量为458.43 g。NaOH 为无色透明晶体,纯度≥96%;IBA 为纯度≥99%的分析纯粉剂,发芽采用长×宽×高为16.5 cm×11 cm×3.5 cm 塑料盒进行。发芽基质选用在烘箱中约150oC高温下消毒的森林土。实验于2020年11月在西南林业大学林学院森林培育种苗实验室内开展,实验期间室内温度在16~36 ℃内波动。
1.2 试验方法
试验的因素包括NaOH 浓度(A)、温水浸种时间(B)和IBA 浓度(C)3 个因素,每因素包括3 个水平,根据因素水平表,试验采用L9(34)正交设计(表1)进行。

表1 华山松种子处理的因素水平和L9(34)正交试验设计Tab.1 Factors with levels and the L9(34)orthogonal experimental design of seed treatment for P.armandii
种子发芽实验共9 个处理组合(自带对照),每个塑料盒播种50 粒种子,6 次重复,每处理组合播种300粒,共播种2 700粒种子。种子用0.5%的高锰酸钾溶液消毒30 min,取出后用清水冲洗干净,再按顺序浸入NaOH(1 h)、温水(按设计时间)和IBA(3 h)溶液中,浸种后播种。幼苗培育期间,主要进行水分管理,即基质水分保持湿润。
幼苗从置床后开始计算苗龄(播种后第3 周开始发芽,第4 周每个处理组合发芽5 株以上),在苗龄128 d时,测定华山松幼苗生长量(地径、胚轴长、主根长和苗高)和生物量(根、干和叶)。每个重复取3株幼苗(第3和4周发芽部分),每个处理组合共18株。分别将处理组合的单株进行编号,按根、干和叶3部分分别测定其鲜重,再将编号的单株放入信封中,信封亦编号,置于105 ℃烘箱内杀青30 min 后调至75 ℃,直到恒重,最后计算含水率。含水率公式计算如下:
含水率=[(Wa-Wb)/Wa]× 100%(1)式(1)中,Wa为烘干前的质量,Wb为烘干后的质量。
采用Excel进行数据整理、绘图,SPSS 26.0进行数据分析,若处理组合和因素水平间呈现显著或极显著的差异,采用邓肯氏(Duncan’s)法进行多重比较,若百分数有≤30%或≥70%的,为满足齐性要求,数据先经过反正弦变换后再进行方差分析。
2 结果与分析
2.1 幼苗生长分析
2.1.1 处理组合的幼苗生长及其差异处理组合的幼苗地径、苗高、胚轴长和主根长分别为1.52~2.04 mm、7.0~9.6 cm、6.0~8.8 cm 和14.1~22.8 cm,其中,处理组合6 的地径极显著地大于处理组合1、2、3和9的(P=7.39E-10<0.01),且对照的平均地径最小;处理组合3的苗高和胚轴长极显著地高于除处理组合2和5以外的其余处理组合的(PSH=3.94E-04<0.01,PHL=6.21E-05<0.01);处理组合1的主根长极显著地长于除处理组合2 和3 以外的其余处理组合的(P=6.66E-11<0.01;表2)。处理组合间的生长差异揭示NaOH、温水和IBA浸种可改变华山松幼苗的生长进程,温水浸种4 h后0.30 g/L IBA溶液浸种有益于幼苗的生长。虽然对照的主根长最长,但其余指标生长较差,表明在种子不浸种前提下,华山松幼苗期间,养分由下分配至根系生长,导致地上部分生长缓慢,也许是生产实践中华山松种子直接播种引起地径和苗高生长缓慢的原因。在生产实践中,建议采用温水和IBA 溶液浸种,可改变华山松幼苗养分在器官间的分配,促进苗木地上器官生长。不同水平组合对苗木生长指标影响不一致,是何原因造成此结果,是如何影响养分在其生长指标中的分配格局,有待进一步实验研究。

表2 幼苗的生长指标Tab.2 Growth parameters of seedlings
2.1.2 影响幼苗生长的主次因子及其随因素水平的变化表3 显示,NaOH 溶液浸种是影响幼苗地径、苗高、胚轴长和主根长生长的主导因子,随NaOH 溶液浓度从0.00%上升到0.15%,地径极显著地增大(P=6.58E-11<0.01),当其浓度升高至0.30%时,地径略微降低;苗高、胚轴和主根长则与地径相反,随NaOH 浸种浓度升高而极显著地降低(P=5.31E-05、1.12E-05、2.29E-12<0.01)。幼苗生长随因素水平的变化结果表明,适宜浓度的NaOH(0.15%以下)有益于华山松幼苗地径生长,但其浓度范围较窄且抑制幼苗的其余指标生长,因此,从幼苗生长总体方面考虑,不宜采用NaOH 溶液浸种。随温水浸种时间从0~4 h 的延长,幼苗地径缓慢增大后趋于稳定,苗高和胚轴长变化不明显,而主根长逐渐降低;随IBA 浸种溶液浓度的升高,苗高和胚轴长显著和极显著地增高和伸长(PSH=0.013<0.05,PHP=0.005<0.01,表3),地径先减小后略增大,主根长略微伸长后缩短。生长指标随温水浸种时间和不同IBA 溶液浓度浸种的变化,表明温水浸种对幼苗生长影响较小;IBA 浸种则显著或极显著影响苗高和胚轴伸长,0.30 g/L 的IBA溶液浸种显著地促进苗高生长。
地径的理论优水平组合为0.15%NaOH 溶液浸种和温水浸种2 h(A2B2C1),与实际地径最大的0.15%NaOH 溶液浸种和温水浸种4 h(A2B3C1)不一致(表3),也许与温水和IBA 的交互作用显著地影响地径生长(P=0.017<0.05)有关,即虽然温水浸种对幼苗生长未产生显著的差异影响,但其与IBA 溶液共同浸种,其交互作用显著影响地径的结果,表明两者共同浸种可促进华山松幼苗地径生长。苗高的理论优水平组合为温水浸种2 h 和0.30 g/L 的IBA 溶液浸种(A1B2C3),与实际最高的组合温水浸种4 h 和0.30 g/L 的IBA 溶液浸种(A1B3C3)不一致;主根长的理论优水平组合为仅用0.15 g/L 的IBA 溶液浸种(A1B1C2),与实际主根最长的组合为对照的(A1B1C1)不一致;胚轴长理论优水平组合与实际的相一致(表3)。理论优水平组合和实际最高的不一致,也许是因素水平的交互作用和正交设计为不完全实验两方面原因导致的。
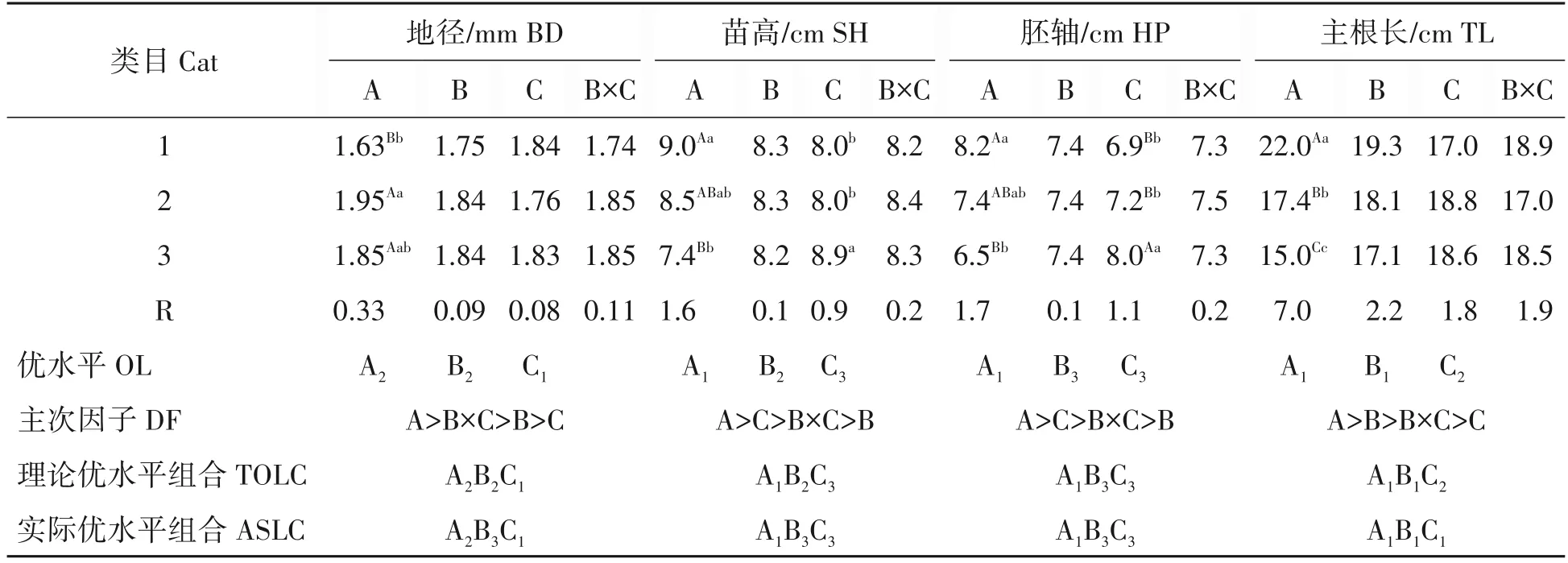
表3 幼苗的生长指标极差分析Tab.3 Range analysis of growth parameters of seedlings
2.2 幼苗生物量分析
2.2.1 处理组合的幼苗生物量及其差异处理组合根、干、叶和全株烘干生物量分别为0.046 9~0.071 2、0.058 4~0.081 7、0.126 6~0.174 0 和0.236 7~0.314 1 g/株。处理组合5 的根生物量显著地大于除处理组合6以外的所有处理组合的(P=0.021<0.05);处理组合4的干生物量极显著地大于处理组合1、7、8和9的(P=0.001<0.01);与地径的相一致,处理组合6 的叶与全株的生物量极显著地大于除处理组合4 与4 和5以外的其余处理组合的(P叶=0.001<0.01,P全株=0.003<0.01),且除处理组合7 以外,其余处理组合叶和全株生物量都比对照的高(表4),表明所设因素水平的组合可促进幼苗生物量的积累,即通过NaOH 结合温水与IBA 溶液浸种处理可提高华山松幼苗的生物量积累,验证物理、化学和生物的方法共同处理华山松种子,促进其生物量积累,构建良种培育壮苗的种子处理基础,可应用于华山松壮苗培育的生产实践。不同水平组合对苗木器官生物量影响不一致,即实验因素水平的组合可改变养分在其器官内的分配格局,可根据器官生物量积累的需要选择性地采用相应的水平组合处理种子,但如何改变养分在其器官内的分配格局的,有待进一步实验研究。
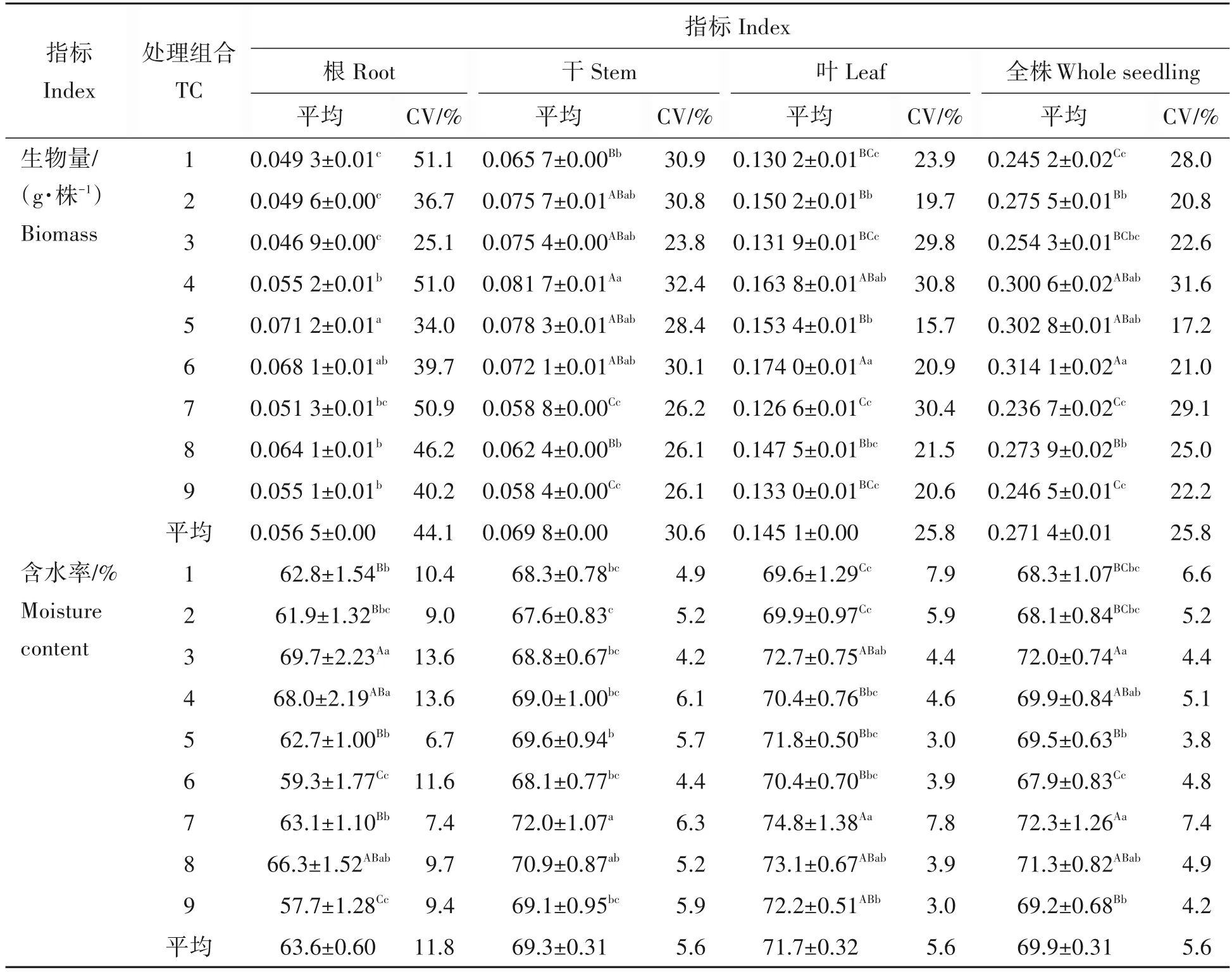
表4 幼苗的生物量和含水率指标Tab.4 Biomass and moisture contents of seedlings
2.2.2 影响幼苗生物量的主次因子及其随因素水平的变化影响根、干、叶和全株生物量积累的主导因子是NaOH 溶液浸种。随NaOH 溶液浓度的升高,幼苗器官和全株生物量呈现极显著地先增大后减小的趋势(P根=0.003<0.01,P干=5.51E-05<0.01,P叶=6.05E-05<0.01,P全株=7.96E-05<0.01,表5 和表6),即0.15%的NaOH 溶液浸种,有利于幼苗器官生物量和全株生物量的积累,可能与Na+促进种子发芽有关,但0.30%的NaOH 溶液浸种不利于华山松幼苗生物量积累,进一步证实前述NaOH 有效浸种华山松的浓度范围较窄的结论。幼苗器官和全株生物量随温水浸种时间的延长呈先增大后下降的趋势;IBA的浓度对器官和全株生物量积累影响较小,随其浓度增加,根、叶和全株的生物量积累略微降低,但干的生物量则略微升高,即IBA 溶液浸种对华山松器官生物量积累的影响随器官的不同而变化。生产实践中可根据相应的需求,采用不同处理实现壮苗的目标;器官和全株生物量的理论优水平组合与实际最高的组合也不一致(表5和表6),原因与幼苗生长量的相一致。

表5 器官生物量和含水率极差分析Tab.5 Range analysis of organic biomass(OB)and moisture contents(OMCs)

表6 全株生物量和含水率极差分析Tab.6 Range analysis of whole seedling biomass(WSB)and moisture contents(MCWSs)
2.3 幼苗含水率分析
2.3.1 处理组合的幼苗含水率及其差异处理组合的根、干、叶和全株含水率分别为57.7%~69.7%、67.6%~72.0%、69.6%~74.8%和67.9%~72.3%,处理组合3 的根含水率极显著地高于除处理组合4 和8 以外的其余处理组合的(P=1.28E-06<0.01),处理组合7 的干含水率显著地高于除处理组合8 以外的其余处理组合的(P=0.015<0.05),处理组合7 的叶含水率极显著地高于除处理组合3、8 和9 以外的其余处理组合的(P=0.001<0.01),处理组合3和7全株含水率极显著地高于除处理组合4和8以外的其余处理组合的(P=0.001<0.01),即实验因素水平组合极显著地改变器官含水量的分配,可通过调整因素水平组合调节器官含水量;与对照相比较,除处理组合2和6以外,其余的处理组合全株含水率都比对照的高(表4),结合生物量,表明实验所采用的因素水平组合促进生物量的积累、有利于提高幼苗器官储水能力,通过苗期提高含水量的培育组合应用,有益于在华山松分布区造林地相对干旱地区提高造林成活率和保存率。不同水平组合对地上部分和地下部分含水率影响不一致,是何原因造成此结果,是如何影响苗木含水率的分配规律,苗木各部分含水率是否对养分有不同需求,有待进一步实验研究。
2.3.2 影响幼苗含水率的主次因子及其随因素水平的变化由表5和表6可知,影响根含水率的主导因子是温水和IBA 溶液浸种的交互作用(B×C),干和叶的则是NaOH 溶液浸种,全株的是IBA 溶液浸种,即影响器官含水率的主导因子不同,可通过因素水平的调整组合,改变器官含水率。干、叶和全株的含水率都随NaOH 溶液浓度的增大极显著或显著地升高(P干=0.003<0.01,P叶=4.03E-04<0.01,P全株=0.032<0.05);根含水率则随NaOH溶液浸种浓度的升高而降低,表明NaOH溶液浸种有利于提高幼苗干、叶和全株的储存水分能力,提高抗性。根、干和全株含水率都随温水浸种时间的延长而降低,叶则相反,温水浸种对含水率影响较小,可根据温水浸种对其他指标的影响选择温水浸种及其浸种时间。
表5 和表6 显示,叶和全株含水率随IBA 溶液浓度的升高极显著地下降后升高(P叶=0.003<0.01,P全株=0.003<0.01),表明0.30 g/L 的IBA 有利于叶和全株水分的储存,全株含水率随温水浸种时间的延长而降低,但结合IBA 溶液浸种可显著的提高全株含水率,主要是温水和IBA 的交互作用显著地影响全株含水率导致的(P=0.011<0.05)。根和干的含水率随IBA 浓度的升高先下降后升高,若需要提高根和干的储水能力,则应采用IBA 浸种。根和叶含水率的理论优水平组合与实际最高组合不一致,也许是正交设计为不完全的实验或因素水平间交互作用影响有关,有待继续实验研究。干和全株含水率的理论优水平组合为0.30%的NaOH 浸种和0.30 g/L 的IBA 浸种(A3B1C3),与实际含水率最高的组合相一致,表明实验的可靠性。
2.4 幼苗器官生物量和含水率的构成
幼苗根、干和叶的生物量分别占全株的20.8%、25.7%和53.5%(图1),说明幼苗生物量主要由叶构成,即华山松幼苗期间养分首先分配至形成光合作用的器官叶的生长发育,符合幼苗器官生物量构成的一般规律。与生物量不同,根、干和叶的含水率分别占全株的31.1%、33.9%和35.0%(图2),虽然叶的略高,但器官间占全株含水率的差异较小,也许与幼苗的根和干的木质化程度相对较低有关,有必要对每木木质化后的器官含水率继续观测分析,为苗木的含水量调节提供依据。

图1 幼苗各器官生物量构成Fig.1 Biomass composition of seedling organs

图2 幼苗各器官含水率构成Fig.2 Moisture content composition of seedling organs
2.5 温水和IBA浸种的交互作用对地径和全株含水率影响的分析
温水和IBA 浸种的交互作用对华山松幼苗地径及全株含水率具有显著的差异影响,因此,对这两指标的交互作用进行分析(图3)。图3指出,当C1与B1~B3相交时,地径呈现逐渐增大趋势,即无IBA溶液浸种时,地径随温水浸种时间的延长而增大,主要是温水浸种加速种子发芽导致的;C2(0.15 g/L IBA)与B1~B3相交时,地径在B2C2相交时减小,B3C2相交时则略微增大,总体呈下降的趋势,即0.15 g/L IBA 单独浸种,地径大于其与温水共同浸种的,温水与0.15 g/L IBA 溶液浸种抑制地径生长;C3(0.30 g/L IBA)与B1~B3相交时,地径先略微增大,之后急剧减小,即0.30 g/L IBA 溶液与温水浸种2 h 的交互作用略微促进地径生长,与温水浸种4 h则抑制地径生长,也许此时的温水与此浓度IBA共同浸种促进种子对IBA的吸收增加,过量的IBA抑制地径生长。从B3C1地径最大(图3),表明IBA总体抑制地径生长,仅温水浸种4 h则可促进华山松幼苗地径生长。
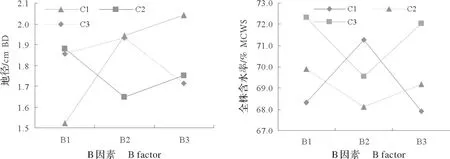
图3 温水和IBA浸种的交互作用Fig.3 The interaction of seed soaked with warm water and IBA solution
温水和IBA 浸种的交互作用对全株含水率的影响与地径的不一致(图3),当C1与B1~B3相交时,全株含水率从B1至B2时上升,至B3时则降低,C2和C3与B2相交时,均呈现全株含水率降低的趋势,与B的其余2 水平相交则含水率上升;含水率最高的是B1与C3和B3与C3,且前者略高于后者,即仅0.30 g/LIBA 单独浸种或温水浸种4 h后再用此溶液浸种,有益于幼苗全株含水率提高,表明通过IBA 溶液浸种,可改变华山松幼苗的水分含量状况,0.30 g/L的IBA溶液浸种,可提高苗木含水率。
2.6 指标和因素间的相关性分析及其方程构建
Pearson 相关分析结果(表7)表明:地径与器官和全株烘干生物量、因素A 之间呈极显著的正相关(P<0.01);胚轴与主根长、苗高以及干和全株生物量、C 因素间极显著正相关(P<0.01),与根生物量呈显著正相关(P<0.05),与干含水率和A 因素呈极显著负相关(P<0.01),即NaOH 溶液浸种不利于胚轴生长;主根长除与胚轴长外,还与苗高、器官和全株生物量呈极显著正相关(P<0.01),与干、叶和全株含水率及A 因素呈极显著负相关(P<0.01),即NaOH 溶液浸种抑制主根长;苗高除与胚轴和主根长外,还与根、干和全株生物量呈极显著正相关(P<0.01),与C 因素呈显著正相关(P<0.05),与A 因素呈极显著负相关(P<0.01),与干的含水率呈显著负相关(P<0.05),揭示与主根类似,NaOH 溶液浸种极显著地抑制苗高生长,干含水率越高其生物量越小,故其与苗高生长负相关。与以上指标类似,器官含水率和生物量间呈现负相关,符合生物量和含水率的关系;A 因素除与根生物量、干、叶和全株含水率外,与其余的生物量和含水率呈负相关;温水浸种降低干生物量,以及根、叶和全株含水率;IBA 除降低根、叶和全株生物量外,可促进幼苗生长和提高其含水率(表7)。IBA 溶液浸种总体促进幼苗生长及地上部分水分的积累,与极差分析结果相一致,揭示综合的幼苗培育措施可促进苗木生长。
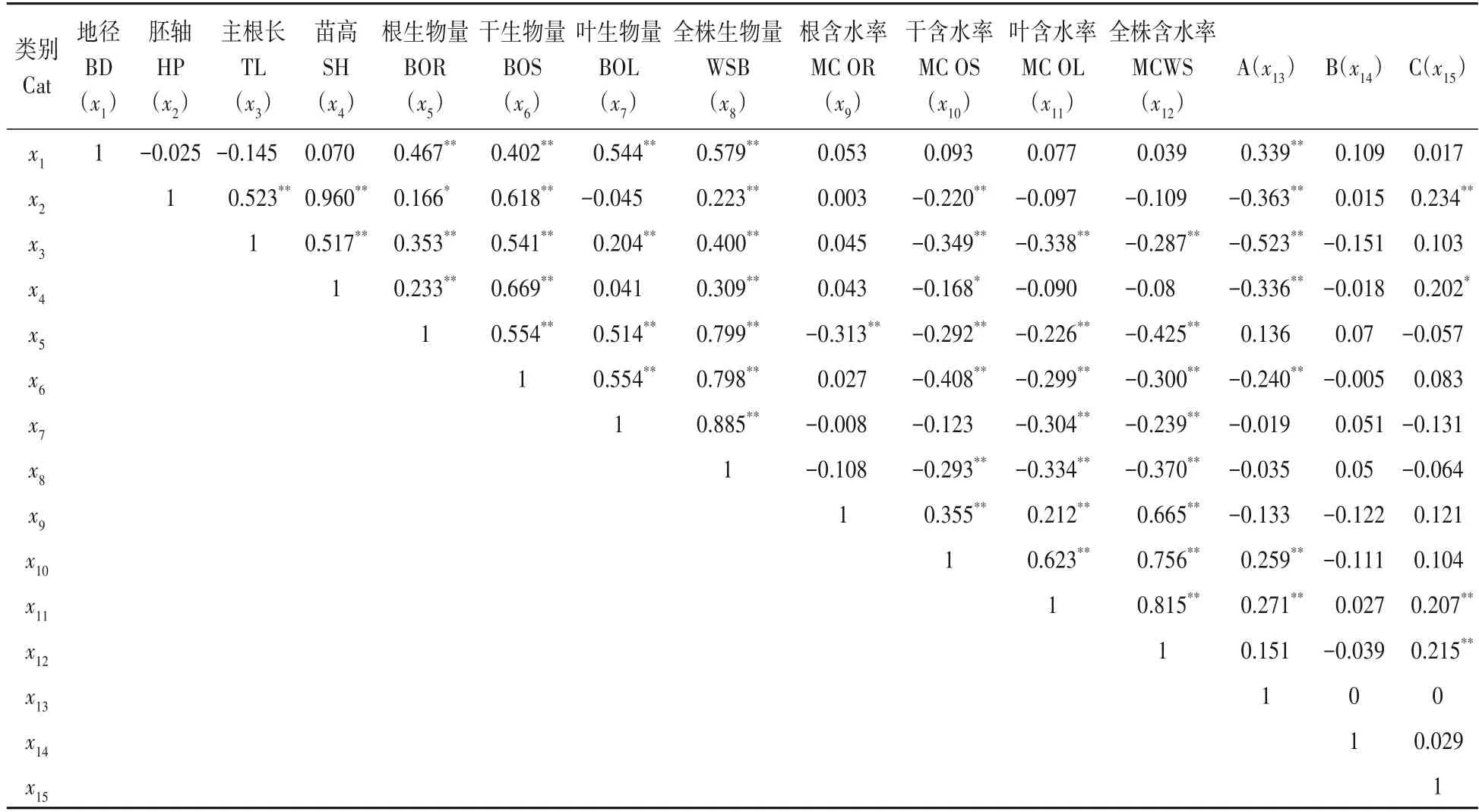
表7 相关性分析Tab.7 Correlation analysis
幼苗生长与生物量指标,以及因素回归结果见表8。地径、胚轴长、主根长、苗高、干生物量,以及干、叶和全株含水率与因素间具有线性关系,其线性关系呈现指标间及其与因素水平间相互促进或抑制的关系,与相关分析结果基本一致,揭示实验结果具有可靠性。
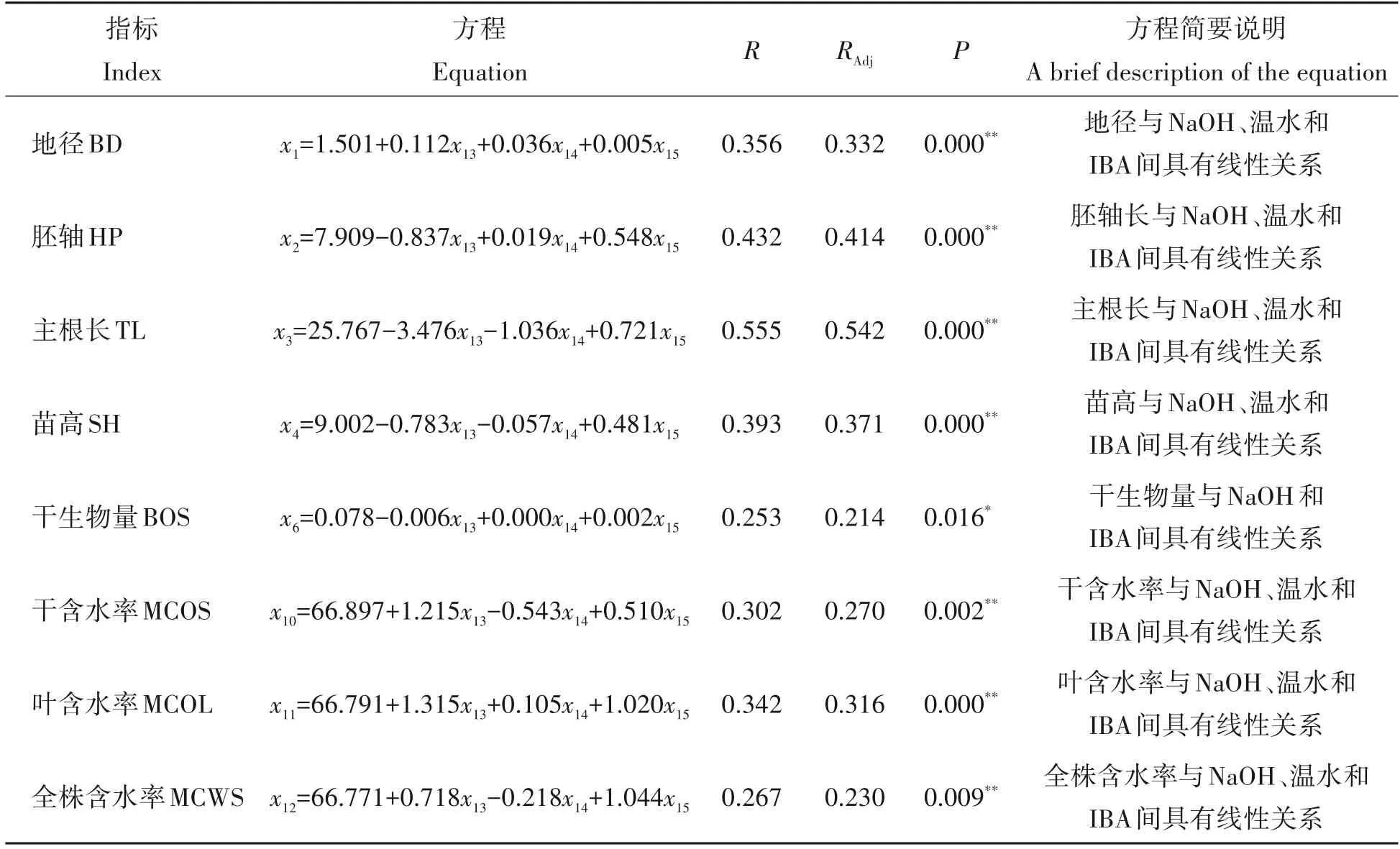
表8 幼苗生长、生物量和含水率方程Tab.8 The equations between seedling growth,biomass and the moisture contents
3 讨论与结论
3.1 讨论
采用碱溶液浸种,不仅软化种皮,还可除去种子角质层,更好的增加种子通透性,有利于抑制物质排出,促进种子发芽,缩短发芽时间,为苗木生长和生物量积累获得更长的时间。本实验中,NaOH 溶液浸种是影响幼苗胚轴长、主根长和苗高的主导因子,且随浓度的升高极显著地抑制此3个指标的生长,地径则极显著的增大后略微减小,王玮等[7]研究指出,NaOH 溶液浸种和60 d 沙藏层积处理梨种子,明显增加幼苗胚长和直径;胚根长、假子叶长和宽随NaOH 溶液浸种的浓度(2~6 g/L)和浸种时间(1~24 h)的增加呈现先增加后降低的趋势。该结果与本研究结果不一致,也许是树种和浸种浓度不同以及沙藏层积处理可以调控种子内源激素导致的。张明婷[21]的研究表明,NaOH 溶液浸种,3种沙生植物沙冬青(Ammopiptanthus mongolicus)、小沙冬青(A.nanus)和柠条(Caragana korshinskii)种子的胚在发芽前已受到NaOH不可逆的伤害,幼苗胚根、胚芽生长及物质积累均被抑制;也有研究指出,NaOH 溶液浸种抑制发芽中关键酶等蛋白的合成,可降低发芽,进一步抑制后期的胚根的呼吸作用等新陈代谢,使其生长缓慢,但有利于山黧豆(Lathyrus quinquenervius)地径的生长[22-23],本研究结果部分与已有的研究结论相一致,即NaOH 溶液浸种对幼苗生长具有共性,也具有个性,其对不同林木种子的影响,需要进行实验研究,分析利弊。本实验中,NaOH 溶液浸种极显著地影响华山松苗木生物量的积累,生物量随NaOH 溶液浓度的增加呈现先增大后减小的趋势,这与赵明德等[8]的研究结果相似,即NaOH 溶液浸种对不同树种具有相同的响应。张谭等[24]研究表明,随着碱环境浓度的增大,枸杞(Lycium barbarum)幼苗根、干、叶生物量受到显著地抑制作用,王光涛等[25]研究指出,随着碱环境的增大,小麦(Triticum aestivum)幼苗的地上部分和根系生物量均比对照的小,也许是在碱环境条件下,破坏了植物离子的平衡和营养吸收,影响植物新陈代谢,物质积累的能量减少,生物量积累受到抑制,本研究与上述作者的结果不一致。张明婷[21]研究指出,3种沙生植物幼苗叶片的相对含水量随NaOH 溶液浓度的升高而降低,本研究结果为随NaOH 溶液浸种浓度的升高,华山松幼苗含水率增大,与其结论不一致,也许是树种和实验因素组合不同导致的。适宜浓度的NaOH 溶液浸种可促进种子发芽、苗木生长和生物量积累,但不同树种,浸种浓度不同,需要在实验研究基础前获得最佳浓度前提下应用于实践中。
温水浸种也是催芽的一种方式,降低机械阻力,缩短发芽时间,间接促进苗木生长。本实验中,温水浸种未呈现明显促进华山松幼苗生长的效果,这与曹志伟等[9]和张小平等[10]的结果不一致,也许是因树种和实验因素组合或者浸种时间不一致导致的。
苗木生长受环境因子及自身特征影响外,还受外源激素的影响。马宇梅[12]研究表明,300 mg/L 的IBA溶液浸种12 h能显著地促进蒙古栎主根的伸长、苗高的生长和幼苗侧根数的增加;袁莲珍等[13]指出,IBA 处理杉木种子,其地径和苗高都优于对照的,不同浓度的IBA 溶液浸种能显著促进地径和苗高的生长,且浓度为200 mg/L 的IBA,苗高最高;王文俊等[14]采用L9(34)和L8(27)的正交试验设计开展催吐萝芙木浸种试验研究,指出IBA 和赤霉素(gibberellin,GA3)是影响其下胚轴和苗高生长的主导因子,0.25 g/L IBA、1.0或0.80 g/L GA3溶液与40~60 ℃温水浸种的组合显著地促进催吐萝芙木幼苗的生长。本研究中,IBA 溶液浸种促进华山松幼苗生长,且0.30 g/L 的IBA 溶液浸种对华山松胚轴和苗高具有极显著和显著的促进作用与已有研究结果相类似,主要是IBA 能促进细胞的分裂和生长导致的。本研究中,与华山松幼苗生长相反,生物量随IBA 浸种溶液浓度的升高呈现下降的趋势,与鲍雪纤等[26]报道的IBA 溶液浸种抑制滇青冈(Cyclobalanopsis glaucoide)幼苗生物量积累的结果相一致,与李允菲等[27]指出的IBA 溶液浸种促进云南松的地径、苗高及根、干、叶的生物量,且吲哚乙酸(Indole-3-acetic,IAA)和IBA 配合浸种明显促进苗木生长和生物量的积累的结果不一致,也许是实验采用不同介质浸种有关,有待更多的实验研究总结其规律性。温水和IBA 溶液浸种对苗木生长和生物量的积累的影响与NaOH 的类似,故生产实践中应用其处理种子,应在实验基础上进行。
目前有关NaOH、温水和IBA 浸种对华山松幼苗生长、生物量及含水率的文献查及较少,建议今后开展NaOH、温水及IBA等浸种,以及华山松壮苗培育的相关实验,为华山松优质壮苗培育提供技术支撑。
3.2 结论
实验采用L9(34)正交设计开展华山松幼苗培育的实验研究。128 d 的幼苗,处理组合的地径、苗高、胚轴长和主根长分别为1.52~2.04 mm、7.0~9.6 cm、6.0~8.8 cm 和14.1~22.8 cm,指标间呈现极显著的差异(P<0.01),NaOH 是影响苗木生长的主导因子,不同生长指标对NaOH 溶液浸种浓度的响应不一致,除0.15%的NaOH 溶液浸种极显著地促进华山松幼苗地径生长外,抑制其余指标的生长。同时,处理组合的全株生物量和含水率分别为0.236 7~0.314 1 g/株和67.9%~72.3%,其对实验因素水平的组合呈现积极的响应,NaOH 仍然是影响生物量的主导因子,0.15%的NaOH 溶液浸种促进生物量积累;实验因素对幼苗器官和全株含水率的影响趋于复杂化,影响不同器官含水率的主导因子不一致。生长量、生物量和含水率的指标间及其与因素间的相关分析结果具有线性关系。通过实验因素不同水平的组合可促进华山松幼苗生长和生物量积累,并改变其器官和全株含水率,可根据苗木培育的目标需求,采用不同水平组合培育幼苗。华山松幼苗阶段,以促进苗高生长为主,因此,温水浸种4 h后0.30 g/L 的IBA 溶液浸种3 h能促进胚轴伸长和苗高生长,可作为种子处理的措施应用。
